名校
1 . 甲醇是重要的化工原料,又可作燃料,工业上可利用CO2来生产燃料甲醇。
(1)已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示:
①500℃时测得反应i在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.8mol·L-1、0.1mol·L-1、0.3mol·L-1、0.15mol·L-1,则此时v(正)___ (填“>”“=”或“<”)v(逆)。
②下列措施能使反应i的平衡体系中n(CH3OH)增大的是___ (填序号)。
A.将H2O(g)从体系中分离出去B.恒容时充人He(g),使体系压强增大
C.升高温度D.恒容时再充入1molH2(g)
(2)200℃时,甲醇气相脱水制甲醚的反应可表示为:2CH3OH(g) CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:
①10~30min内,用CH3OCH3(g)表示该反应的平均速率为___ 。
②CH3OH(g)的平衡转化率为___ 。
③反应开始时,容器内的起始压强为P0,求该反应在200℃时的平衡常数Kp=___ (以分压表示,分压=总压×物质的量分数)。
(3)某研究小组用以酸性介质为电解质的甲醇-氧气燃料电池,电解HCl气体,制备高纯度氯气,其装置如图,其中a、b均为惰性电极。
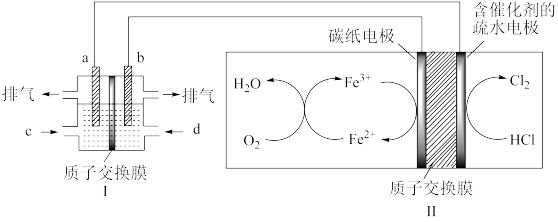
①b极的电极反应式为:___ 。
②理论上,当燃料电池消耗16gCH3OH标准状况下能制备Cl2___ L。
(1)已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示:
| 化学反应 | 化学平衡常数 | 温度(℃) | ||
| 500 | 700 | 800 | ||
i.3H2(g)+CO2(g) CH3OH(g)+H2O(g)△H1 CH3OH(g)+H2O(g)△H1 | K1 | 2.5 | 0.58 | 0.38 |
②下列措施能使反应i的平衡体系中n(CH3OH)增大的是
A.将H2O(g)从体系中分离出去B.恒容时充人He(g),使体系压强增大
C.升高温度D.恒容时再充入1molH2(g)
(2)200℃时,甲醇气相脱水制甲醚的反应可表示为:2CH3OH(g)
 CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②CH3OH(g)的平衡转化率为
③反应开始时,容器内的起始压强为P0,求该反应在200℃时的平衡常数Kp=
(3)某研究小组用以酸性介质为电解质的甲醇-氧气燃料电池,电解HCl气体,制备高纯度氯气,其装置如图,其中a、b均为惰性电极。

①b极的电极反应式为:
②理论上,当燃料电池消耗16gCH3OH标准状况下能制备Cl2
您最近一年使用:0次



