1 . 氯化亚砜(SOCl2)具有很强的氯化能力和脱水能力,在有机合成中具有重要的应用。工业上用硫酸厂尾气中的 SO2与 SCl2、Cl2为原料合成 SOCl2,反应如下:
①SO2(g)+Cl2(g) SO2Cl2(g) ΔH=-471.7 kJ·mol-1
SO2Cl2(g) ΔH=-471.7 kJ·mol-1
②SCl2(g)+SO2Cl2g) 2SOCl2(g) ΔH=-5.6 kJ·mol-1
2SOCl2(g) ΔH=-5.6 kJ·mol-1
回答下列问题:
(1)该条件下,由 SO2(g)、Cl2(g)和 SCl2(g),制备 1 mol SOCl2(g)放出的热量为___ kJ。
(2)一定条件下,在 5 L 的恒容密闭容器中通入一定量的 SO2、SCl2与 Cl2,反应 4min 后达到平衡。若初始压强为 p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示(平衡时温度与初始温度相同)。
容器内各组分物质的量如下表。

I.0-1 min 容器内压强增大的原因为___ 。
II.反应①、②达平衡时,SCl2的平衡转化率为___ 。
III.K 为平衡常数,pK=-lgK,该温度下,反应Ⅱ的 pK =___ (保留两位有效数字,lg2 = 0.30)。
(3)常温下,将 SO2通入到 NaOH溶液中,充分反应后得到 a mol·L-1的 NaHSO3溶液,该溶液的 pH=5的电离常数约为___ (用含 a 的式子表示)。
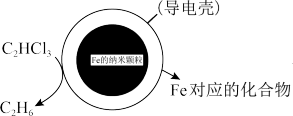
(4)Fe 的纳米颗粒具备优于零价单质的一些新性能,可有效降解多种环境污染物。下图是利用原电池原理除去酸性废水中三氯乙烯的过程,请写出该装置的正极反应式___________ 。
①SO2(g)+Cl2(g)
 SO2Cl2(g) ΔH=-471.7 kJ·mol-1
SO2Cl2(g) ΔH=-471.7 kJ·mol-1②SCl2(g)+SO2Cl2g)
 2SOCl2(g) ΔH=-5.6 kJ·mol-1
2SOCl2(g) ΔH=-5.6 kJ·mol-1回答下列问题:
(1)该条件下,由 SO2(g)、Cl2(g)和 SCl2(g),制备 1 mol SOCl2(g)放出的热量为
(2)一定条件下,在 5 L 的恒容密闭容器中通入一定量的 SO2、SCl2与 Cl2,反应 4min 后达到平衡。若初始压强为 p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示(平衡时温度与初始温度相同)。
容器内各组分物质的量如下表。

| 组分 | SO2 | Cl2 | SCl2 | SO2Cl2 | SOCl2 |
| 起始/mol | 0.25 | 0.25 | 0.25 | 0 | 0 |
| 平衡/mol | 0.1 |
I.0-1 min 容器内压强增大的原因为
II.反应①、②达平衡时,SCl2的平衡转化率为
III.K 为平衡常数,pK=-lgK,该温度下,反应Ⅱ的 pK =
(3)常温下,将 SO2通入到 NaOH溶液中,充分反应后得到 a mol·L-1的 NaHSO3溶液,该溶液的 pH=5的电离常数约为
(4)Fe 的纳米颗粒具备优于零价单质的一些新性能,可有效降解多种环境污染物。下图是利用原电池原理除去酸性废水中三氯乙烯的过程,请写出该装置的正极反应式

您最近一年使用:0次
解题方法
2 . 甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知 、
、 、
、 的燃烧热分别为
的燃烧热分别为 ,
,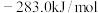 ,
,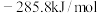 。利用甲烷制备合成气的反应为
。利用甲烷制备合成气的反应为
 。
。
根据上述数据能否计算
________ (填“能”或“否”),理由是________________ 。
(2)在某密闭容器中通入
 和
和 ,在不同条件下发生反应:
,在不同条件下发生反应:


测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。

①
________  ,
,
________ (填“<”、“>”或“=”)。
②m、n、q三点的化学平衡常数大小关系为________ 。
③q点甲烷的转化率为________ ,该条件下的化学平衡常数
________ (用含有 的表达式表示,
的表达式表示,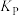 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
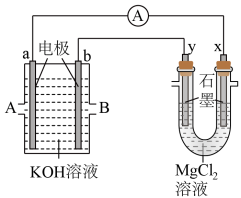
(3)用甲烷和 构成的燃料电池电解
构成的燃料电池电解 溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是________ ,x电极的电极反应式是________ 。
(1)已知
 、
、 、
、 的燃烧热分别为
的燃烧热分别为 ,
,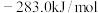 ,
,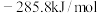 。利用甲烷制备合成气的反应为
。利用甲烷制备合成气的反应为
 。
。根据上述数据能否计算

(2)在某密闭容器中通入

 和
和 ,在不同条件下发生反应:
,在不同条件下发生反应:

测得平衡时
 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
①

 ,
,
②m、n、q三点的化学平衡常数大小关系为
③q点甲烷的转化率为

 的表达式表示,
的表达式表示,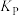 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。(3)用甲烷和
 构成的燃料电池电解
构成的燃料电池电解 溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
您最近一年使用:0次
3 . CoS2催化CO烟气脱硫具有广阔的工业化前景。回答下列问题:
(1)已知:
CoS2(s) +CO(g) CoS(s) +COS(g) ∆H1
CoS(s) +COS(g) ∆H1
2COS(g) +SO2(g) 3S(s) +2CO2(g) ∆H2
3S(s) +2CO2(g) ∆H2
S(s) +CoS(S) CoS2 (s) △H3
CoS2 (s) △H3
则2CO(g)+ SO2(g) 2CO2(g)+S(s) ∆H4=
2CO2(g)+S(s) ∆H4=____ 。 (用∆H1、 ∆H2、∆H3表示)
(2)在恒温、恒压的容器中模拟回收硫,加入SO2起始量均为1mol,测得CO2的平衡体积分数随CO和SO2的投料比变化如图:

①当投料比为2时,t min 时测得SO2转化率为50%,则用S的生成速率表示的反应速率v=______ g·min-1。
②当投料比为3时,CO2 的平衡体积分数对应的点是______________ 。
(3)向体积均为1L的恒温、恒客密闭容器通入2 mol CO和| mol SO2。反应体系总压强随时间的变化如图:
①相对于I,II改变的外界条件是____________________ 。
②SO2的平衡转化率为______ ,平衡常数Kp =________ (用平衡分压代替平衡浓度计算)。
(4)利用电解法处理SO2尾气可制备保险粉 (Na2S2O4).电解装置如图,则a____ b (填“>” “=”或“<”),生成S2O42-的电极反应式为____________________ 。

(1)已知:
CoS2(s) +CO(g)
 CoS(s) +COS(g) ∆H1
CoS(s) +COS(g) ∆H12COS(g) +SO2(g)
 3S(s) +2CO2(g) ∆H2
3S(s) +2CO2(g) ∆H2S(s) +CoS(S)
 CoS2 (s) △H3
CoS2 (s) △H3则2CO(g)+ SO2(g)
 2CO2(g)+S(s) ∆H4=
2CO2(g)+S(s) ∆H4=(2)在恒温、恒压的容器中模拟回收硫,加入SO2起始量均为1mol,测得CO2的平衡体积分数随CO和SO2的投料比变化如图:

①当投料比为2时,t min 时测得SO2转化率为50%,则用S的生成速率表示的反应速率v=
②当投料比为3时,CO2 的平衡体积分数对应的点是
(3)向体积均为1L的恒温、恒客密闭容器通入2 mol CO和| mol SO2。反应体系总压强随时间的变化如图:
①相对于I,II改变的外界条件是
②SO2的平衡转化率为
(4)利用电解法处理SO2尾气可制备保险粉 (Na2S2O4).电解装置如图,则a

您最近一年使用:0次
解题方法
4 . 氮氧化物在含能材料、医药等方面有着广泛应用。请回答:
(1)一定温度下,在恒容密闭容器中 可发生下列反应:
可发生下列反应: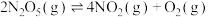

①该反应自发进行的条件是________ 。
②下表为反应在 温度下的部分实验数据:
温度下的部分实验数据:
在500s时,
________ 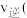 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。若在
。若在 温度下进行实验,1000s时测得反应体系中
温度下进行实验,1000s时测得反应体系中 浓度为
浓度为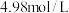 ,则
,则
________ 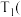 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。
(2)在 与
与 之间存在反应:
之间存在反应: 。将
。将 放入1L恒容密闭容器中,测得其平衡转化率
放入1L恒容密闭容器中,测得其平衡转化率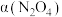 随温度变化如图所示。
随温度变化如图所示。
①337.5K时,反应平衡常数
________ 。
②已知:
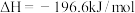


则反应 的
的
________  。
。
(3)某学习小组设想利用A装置电解制备绿色硝化剂 ,装置如下
,装置如下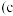 、d为惰性电极
、d为惰性电极 :
:

已知:无水硝酸可在液态 中发生微弱电离。写出生成
中发生微弱电离。写出生成 的电极反应式
的电极反应式________ 。
(1)一定温度下,在恒容密闭容器中
 可发生下列反应:
可发生下列反应: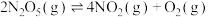

①该反应自发进行的条件是
②下表为反应在
 温度下的部分实验数据:
温度下的部分实验数据: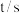 | 0 | 500 | 1000 |
 |  | 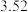 | 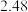 |
在500s时,

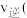 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。若在
。若在 温度下进行实验,1000s时测得反应体系中
温度下进行实验,1000s时测得反应体系中 浓度为
浓度为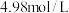 ,则
,则
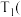 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。(2)在
 与
与 之间存在反应:
之间存在反应: 。将
。将 放入1L恒容密闭容器中,测得其平衡转化率
放入1L恒容密闭容器中,测得其平衡转化率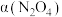 随温度变化如图所示。
随温度变化如图所示。
①337.5K时,反应平衡常数

②已知:

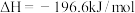


则反应
 的
的
 。
。(3)某学习小组设想利用A装置电解制备绿色硝化剂
 ,装置如下
,装置如下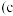 、d为惰性电极
、d为惰性电极 :
:
已知:无水硝酸可在液态
 中发生微弱电离。写出生成
中发生微弱电离。写出生成 的电极反应式
的电极反应式
您最近一年使用:0次
5 . 氮氧化物在含能材料、医药等方面有着广泛应用。请回答:
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>O
4NO2(g)+O2(g);△H>O
①该反应自发进行的条件是______ 。
②下表为反应在T1温度下的部分实验数据:
在500s时,v正______ v逆(填“>”、“<”或“=”)。若在T2温度下进行实验,1000s时测得反应体系中NO2浓度为4.98 mol·L-1,则T2______ T1(填“>”、“<”或“=”)。
(2)在N2O4与NO2之间存在反应:N2O4(g) 2NO2(g)。将1 mol N2O4放入1 L恒容密闭容器中,测得其平衡转化率α(N2O4)随温度变化如图所示。
2NO2(g)。将1 mol N2O4放入1 L恒容密闭容器中,测得其平衡转化率α(N2O4)随温度变化如图所示。

①337.5K时,反应平衡常数K=______
②已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.60 kJ·mol-1
2SO3(g) △H=-196.60 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) △H=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的△H=______ kJ·mol-1
(3)某学习小组设想利用A装置电解制备绿色硝化剂N2O5,装置如下(c,d为情性电极):
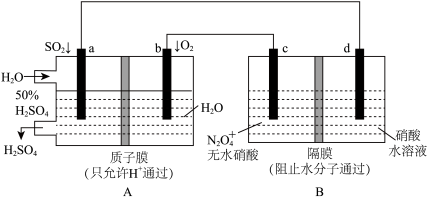
已知:无水硝酸可在液态N2O4中发生微弱电离。写出生成N2O5的电极反应式______ 。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g);△H>O
4NO2(g)+O2(g);△H>O①该反应自发进行的条件是
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
(2)在N2O4与NO2之间存在反应:N2O4(g)
 2NO2(g)。将1 mol N2O4放入1 L恒容密闭容器中,测得其平衡转化率α(N2O4)随温度变化如图所示。
2NO2(g)。将1 mol N2O4放入1 L恒容密闭容器中,测得其平衡转化率α(N2O4)随温度变化如图所示。
①337.5K时,反应平衡常数K=
②已知:2SO2(g)+O2(g)
 2SO3(g) △H=-196.60 kJ·mol-1
2SO3(g) △H=-196.60 kJ·mol-12NO(g)+O2(g)=2NO2(g) △H=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的△H=
(3)某学习小组设想利用A装置电解制备绿色硝化剂N2O5,装置如下(c,d为情性电极):

已知:无水硝酸可在液态N2O4中发生微弱电离。写出生成N2O5的电极反应式
您最近一年使用:0次
6 . 碘及其化合物在人类活动中占有重要地位。已知反应H2(g) + I2(g) 2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:

(1)若反应开始时气体混合物的总压为p kPa,则反应在前20 min内的平均速率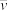 (HI)=
(HI)=_____ kPa·min-1(用含p的式子表示)。
(2)反应达平衡时,H2的转化率α(H2)=____________ 。
(3)上述反应中,正反应速率为v正= k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,
________ (填“增大”“减小”或“不变”)。
(4)降低温度,平衡可能逆向移动的原因是__________ 。
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,下图中的ΔH2=________ kJ∙mol-1

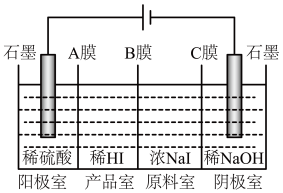
(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如上图所示。
①阳极电极反应式为______________ 。
②阳膜和阴膜分别只允许阳离子、阴离子通过,A膜为阳膜,则B膜为______ 膜,C膜为______ 膜。
 2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
(1)若反应开始时气体混合物的总压为p kPa,则反应在前20 min内的平均速率
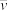 (HI)=
(HI)=(2)反应达平衡时,H2的转化率α(H2)=
(3)上述反应中,正反应速率为v正= k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,

(4)降低温度,平衡可能逆向移动的原因是
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,下图中的ΔH2=


(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如上图所示。
①阳极电极反应式为
②阳膜和阴膜分别只允许阳离子、阴离子通过,A膜为阳膜,则B膜为
您最近一年使用:0次
2020-01-23更新
|
191次组卷
|
4卷引用:福建省宁德市2019-2020学年高三上学期期末质量检测理综化学试题
福建省宁德市2019-2020学年高三上学期期末质量检测理综化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点10-12)(已下线)考点09 化学平衡及反应方向-2020年高考化学命题预测与模拟试题分类精编模拟卷03(必考+选考)——2020年秋高三化学开学摸底考试卷(全国通用)
名校
7 . N2O5是一种新型硝化剂,其性质和制备备受人们的关注。
(1)一定温度下,在2L恒容密闭的容器中充入2.0molN2O5发生反应:2N2O5(g) 4NO2(g)+O2(g)。在三种不同的条件下进行实验,N2O5的浓度随时间的变化如图所示。
4NO2(g)+O2(g)。在三种不同的条件下进行实验,N2O5的浓度随时间的变化如图所示。

①已知:2N2O5(g)===2N2O4(g)+O2(g) △H1=-4.4kJ/mol
2NO2(g)===N2O4(g) △H2=-55.3 kJ/mol
则反应2N2O5(g)===4NO2(g)+O2(g)的△H=________ 。
②下列不能说明该反应已达平衡状态的是___ (填序号)。
A.v正(N2O5)=2v逆(O2)
B.混合气体密度不变
C.混合体平均摩尔质量
D.NO2的体积分数不变
③该反应自发进行的条件是____ (填“高温”或“低温”),实验Ⅲ中:a点v逆(O2)____ (填“<”或“>”)b点v逆(O2)。
④实验Ⅱ从反应开始至平衡时,v(O2)=____ mol/(L·min)。
⑤列式并计算该反应在800℃时的平衡常数K=_______ 。
(2)1840年Devil用干燥的氯气通过干燥的硝酸银,反应得到N2O5。该反应的氧化产物是一种气体,该反应的化学方程式为_______ 。
(3)N2O5也可采用“电解法”制备,装置如图所示。

则N2O5在电解池的____ (填“阴极”或“阳极”)室生成,其电极反应式为_____ 。
(1)一定温度下,在2L恒容密闭的容器中充入2.0molN2O5发生反应:2N2O5(g)
 4NO2(g)+O2(g)。在三种不同的条件下进行实验,N2O5的浓度随时间的变化如图所示。
4NO2(g)+O2(g)。在三种不同的条件下进行实验,N2O5的浓度随时间的变化如图所示。
①已知:2N2O5(g)===2N2O4(g)+O2(g) △H1=-4.4kJ/mol
2NO2(g)===N2O4(g) △H2=-55.3 kJ/mol
则反应2N2O5(g)===4NO2(g)+O2(g)的△H=
②下列不能说明该反应已达平衡状态的是
A.v正(N2O5)=2v逆(O2)
B.混合气体密度不变
C.混合体平均摩尔质量
D.NO2的体积分数不变
③该反应自发进行的条件是
④实验Ⅱ从反应开始至平衡时,v(O2)=
⑤列式并计算该反应在800℃时的平衡常数K=
(2)1840年Devil用干燥的氯气通过干燥的硝酸银,反应得到N2O5。该反应的氧化产物是一种气体,该反应的化学方程式为
(3)N2O5也可采用“电解法”制备,装置如图所示。

则N2O5在电解池的
您最近一年使用:0次
2019-09-16更新
|
464次组卷
|
2卷引用:云南师大附中2020届高三适应性月考(一)理综化学试题
19-20高三上·山东日照·期末
解题方法
8 . 铁镁合金是目前已发现的储氢密度最高的储氢材料之一,前景广阔,由此产生的CO2、SO2等废气处理意义重大。
(1)电解硫酸镁废液可制备氢氧化镁,废液中的其它成分不参与反应。装置如图所示:

①b电极应连接外接电源的____ 极。(填“正”或“负”)
②写出产生氢氧化镁固体的电极反应式:___________________ 。
(2)高炉炼铁是冶炼铁的主要方法。
高炉炼铁的尾气中通常含有较多的SO2气体。为减少污染,分离并回收气体,工业上用碱性工业废渣吸收SO2气体,脱硫效率、尾气中SO2质量浓度和温度的关系如下图所示。依据图中数据分析,合适的温度是______ ℃;选择合适的质量浓度,经测定40min内共处理10m3废气,则40min内平均脱硫速率为______ mg·min-1。

(3)工业上可用炼铁尾气中的CO2与H2制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。某温度下,将1molCO2和3mol H2充入体积不变的2L密闭容器中发生上述反应。测得不同时刻反应前后的压强关系如下表所示:
CH3OH(g)+H2O(g)。某温度下,将1molCO2和3mol H2充入体积不变的2L密闭容器中发生上述反应。测得不同时刻反应前后的压强关系如下表所示:
①若使用催化剂,反应速率加快,2h时H2的转化率______ 上表中2h时H2的转化率。(填“大于”、“小于”或“等于”)
②该温度下,测得反应开始前压强为1.25MPa,则该反应的点KP=_____ (MPa)-2。(结果保留最简分式形式)
(1)电解硫酸镁废液可制备氢氧化镁,废液中的其它成分不参与反应。装置如图所示:

①b电极应连接外接电源的
②写出产生氢氧化镁固体的电极反应式:
(2)高炉炼铁是冶炼铁的主要方法。
高炉炼铁的尾气中通常含有较多的SO2气体。为减少污染,分离并回收气体,工业上用碱性工业废渣吸收SO2气体,脱硫效率、尾气中SO2质量浓度和温度的关系如下图所示。依据图中数据分析,合适的温度是

(3)工业上可用炼铁尾气中的CO2与H2制备甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。某温度下,将1molCO2和3mol H2充入体积不变的2L密闭容器中发生上述反应。测得不同时刻反应前后的压强关系如下表所示:
CH3OH(g)+H2O(g)。某温度下,将1molCO2和3mol H2充入体积不变的2L密闭容器中发生上述反应。测得不同时刻反应前后的压强关系如下表所示:| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①若使用催化剂,反应速率加快,2h时H2的转化率
②该温度下,测得反应开始前压强为1.25MPa,则该反应的点KP=
您最近一年使用:0次
9 . 氮元素有多种氧化物。请回答下列问题:
(1)已知:H2的燃烧热ΔH为-285.8kJ·mol-1。
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
H2O(g)=H2O(1) ΔH=-44kJ·mol-1
则4H2(g) + 2NO2(g) = 4H2O(g) + N2(g) ΔH=__________ 。
(2)一定温度下,向2L恒容密闭容器中充入0.40mol N2O4,发生反应:N2O4(g) 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
①0-40s内,v(NO2)=________ mol·L-1·s-1。
②升高温度时,气体颜色加深,则上述反应是________ (填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数K=________ mol·L-1。
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)________ (填“>”“=”或“<”)0.60mol·L-1。
(3)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O5的装置。写出阳极区生成N2O5的电极反应式(注意 阳极区为无水环境,HNO3亦无法电离):________________________ 。

(4)湿法吸收工业尾气中的NO2,常选用烧碱溶液,产物为两种常见的含氧酸盐。该反应的离子方程式是____________________ 。
(1)已知:H2的燃烧热ΔH为-285.8kJ·mol-1。
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
H2O(g)=H2O(1) ΔH=-44kJ·mol-1
则4H2(g) + 2NO2(g) = 4H2O(g) + N2(g) ΔH=
(2)一定温度下,向2L恒容密闭容器中充入0.40mol N2O4,发生反应:N2O4(g)
 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:| 时间/s | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/(mol·L-1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
②升高温度时,气体颜色加深,则上述反应是
③该温度下反应的化学平衡常数K=
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)
(3)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O5的装置。写出阳极区生成N2O5的电极反应式(

(4)湿法吸收工业尾气中的NO2,常选用烧碱溶液,产物为两种常见的含氧酸盐。该反应的离子方程式是
您最近一年使用:0次
10 . 纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是______________ 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =__________ kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为________________ 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为____________ 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O 2H2(g)+O2(g) ΔH>0
2H2(g)+O2(g) ΔH>0
水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是________ (填字母代号)。
A.实验温度: T12
B.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂效率低
D.T2条件下该反应的化学平衡常数为6.17×10-5mol/L
(6)25℃时,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L盐酸,生成沉淀,若已知Kap(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=______________ 。(体积变化忽略不计)若再向沉淀生成后的溶液中加入100mL 0.01mol/L盐酸,是否继续产生沉淀_______ (填“是”或“否”)。
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O
 2H2(g)+O2(g) ΔH>0
2H2(g)+O2(g) ΔH>0水蒸气的浓度随时间t变化如下表所示。
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是
A.实验温度: T12
B.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂效率低
D.T2条件下该反应的化学平衡常数为6.17×10-5mol/L
(6)25℃时,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L盐酸,生成沉淀,若已知Kap(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=
您最近一年使用:0次



