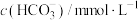解题方法
1 . 将CO、CO2转化为甲烷、甲醇、甲酸等有机物是实现“碳中和”重要途径。
Ⅰ.工业上利用H2与CO反应制甲烷,存在如下反应:
反应i:CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H1=-206.2kJ/mol
反应ii:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41.2kJ/mol
反应iii:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ∆H3
回答下列问题:
(1)∆H3=___________ kJ/mol。
(2)一定温度下,在固定容积的容器中通入H2、CO发生上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随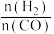 变化的情况如图所示,其中曲线b表示CO的转化率。
变化的情况如图所示,其中曲线b表示CO的转化率。___________ (填“升温”或“降温”)。
②图中表示H2转化率曲线是___________ (填标号)。
Ⅱ.用光电化学法将CO2还原为有机物实现碳资源的再生利用。电解装置和其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率随电解电压的变化如下图所示。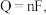 n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
(3)电解时,阴极生成HCOOH的电极反应式为___________ 。通过电解制备HCHO应选择电压为___________ V(填U1或U2)。
(4)当电解电压为U2V时,电解生成的HCOOH和HCHO的物质的量之比为3:2.则生成HCOOH的法拉第效率m为___________ 。
Ⅲ.工业上用CO2和H2催化合成甲醇存在如下反应:
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H<0
CH3OH(g)+H2O(g) ∆H<0
副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H>0
(5)某温度下,在装有催化剂的密闭容器中投入1mol CO2和3mol H2,发生上述反应。达平衡时容器中CH3OH的物质的量为0.6mol,CO的物质的量为0.1mol。则此条件下副反应的平衡常数K=___________ 。(保留两位小数)
(6)已知CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H<0,v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2)(k正、k逆分别为正、逆向反应速率常数)。该反应的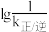 随温度变化的曲线如图所示,则
随温度变化的曲线如图所示,则___________ 表示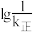 随温度变化的曲线,理由是
随温度变化的曲线,理由是___________ 。
Ⅰ.工业上利用H2与CO反应制甲烷,存在如下反应:
反应i:CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H1=-206.2kJ/mol
反应ii:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41.2kJ/mol
反应iii:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ∆H3
回答下列问题:
(1)∆H3=
(2)一定温度下,在固定容积的容器中通入H2、CO发生上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随
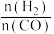 变化的情况如图所示,其中曲线b表示CO的转化率。
变化的情况如图所示,其中曲线b表示CO的转化率。
②图中表示H2转化率曲线是
Ⅱ.用光电化学法将CO2还原为有机物实现碳资源的再生利用。电解装置和其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率随电解电压的变化如下图所示。

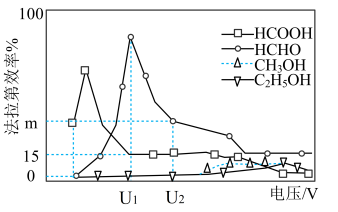
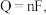 n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。(3)电解时,阴极生成HCOOH的电极反应式为
(4)当电解电压为U2V时,电解生成的HCOOH和HCHO的物质的量之比为3:2.则生成HCOOH的法拉第效率m为
Ⅲ.工业上用CO2和H2催化合成甲醇存在如下反应:
主反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H<0
CH3OH(g)+H2O(g) ∆H<0副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H>0
(5)某温度下,在装有催化剂的密闭容器中投入1mol CO2和3mol H2,发生上述反应。达平衡时容器中CH3OH的物质的量为0.6mol,CO的物质的量为0.1mol。则此条件下副反应的平衡常数K=
(6)已知CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H<0,v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2)(k正、k逆分别为正、逆向反应速率常数)。该反应的
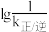 随温度变化的曲线如图所示,则
随温度变化的曲线如图所示,则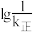 随温度变化的曲线,理由是
随温度变化的曲线,理由是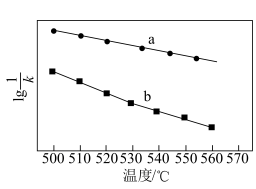
您最近一年使用:0次
解题方法
2 . 在一定条件下的密闭容器中发生反应: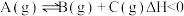 下列措施中,不能提高A的平衡转化率的是
下列措施中,不能提高A的平衡转化率的是
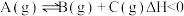 下列措施中,不能提高A的平衡转化率的是
下列措施中,不能提高A的平衡转化率的是| A.恒容条件下通入稀有气体 | B.及时分离出C |
| C.降低反应温度 | D.增大容器的体积 |
您最近一年使用:0次
名校
3 . 甲醇是一种理想的储氢载体,我国科学家研发的全球首套太阳能燃料合成项目被称为“液态阳光”计划,可利用太阳能电解水产生 ,再与
,再与 转化为甲醇,以实现碳中和。
转化为甲醇,以实现碳中和。
已知, 生产甲醇过程中涉及反应:
生产甲醇过程中涉及反应:
(1)向某恒温恒压密闭容器中充入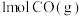 和
和 ,下列能说明反应达到平衡的是___________。
,下列能说明反应达到平衡的是___________。
(2)在 恒温密闭容器中充入
恒温密闭容器中充入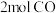 和
和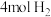 ,在一定条件下经
,在一定条件下经 ,
, 的物质的量为
的物质的量为 。在该条件下,
。在该条件下,
___________  。
。
(3)为了提高CO的转化率,可采取的措施是(写出两条):___________ 。
 ,再与
,再与 转化为甲醇,以实现碳中和。
转化为甲醇,以实现碳中和。已知,
 生产甲醇过程中涉及反应:
生产甲醇过程中涉及反应:
(1)向某恒温恒压密闭容器中充入
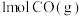 和
和 ,下列能说明反应达到平衡的是___________。
,下列能说明反应达到平衡的是___________。| A.混合气体的密度不再改变 | B.混合气体的平均相对分子质量不再改变 |
| C.两种反应物转化率的比值不再改变 | D.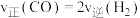 |
 恒温密闭容器中充入
恒温密闭容器中充入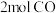 和
和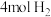 ,在一定条件下经
,在一定条件下经 ,
, 的物质的量为
的物质的量为 。在该条件下,
。在该条件下,
 。
。(3)为了提高CO的转化率,可采取的措施是(写出两条):
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
4 . 黄铁矿[主要成分为二硫化亚铁(FeS2)]、焦炭和适量空气混合加热发生如下反应:
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为___________ mol。
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2.将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g) S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0
iii.SO2(g)+3CO(g) COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0
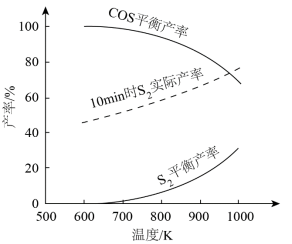
理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。___________ 。
②随温度升高,S2平衡产率上升,推测其原因是___________ 。
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为___________ 。
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2.将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g)
 S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0iii.SO2(g)+3CO(g)
 COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。
②随温度升高,S2平衡产率上升,推测其原因是
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为
您最近一年使用:0次
名校
解题方法
5 . 一定温度下,在容积为 的密闭容器内,通入一定量的
的密闭容器内,通入一定量的 和空气,在给定条件下发生反应生成
和空气,在给定条件下发生反应生成 的物质的量浓度变化如下图所示:
的物质的量浓度变化如下图所示:
2.根据图上信息,从反应开始到第一次达到平衡状态时, 的平均反应速率为
的平均反应速率为___________ 。
3.在 时,可能改变的条件是___________。
时,可能改变的条件是___________。
4.对于该反应,能否通过改变条件使 完全转化为
完全转化为 ?
?___________ (选填“能”或“不能”,原因是___________ 。
 的密闭容器内,通入一定量的
的密闭容器内,通入一定量的 和空气,在给定条件下发生反应生成
和空气,在给定条件下发生反应生成 的物质的量浓度变化如下图所示:
的物质的量浓度变化如下图所示: 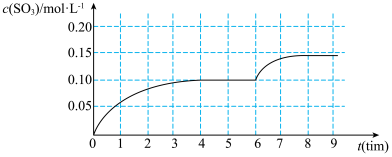
A. | B.压强不变 |
C. 浓度不再发生变化 浓度不再发生变化 | D.密度不变 |
 的平均反应速率为
的平均反应速率为3.在
 时,可能改变的条件是___________。
时,可能改变的条件是___________。| A.降低温度 | B.增加 浓度 浓度 | C.减小压强 | D.增加 浓度 浓度 |
 完全转化为
完全转化为 ?
?
您最近一年使用:0次
6 . 某小组探秘人体血液中的运载氧平衡及酸碱平衡,回答下列问题:
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:
ⅰ.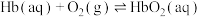

ⅱ.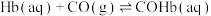

ⅱ.

ⅳ.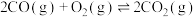

(1)
________ (用含a、b或c的代数式表示)。
(2) 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。
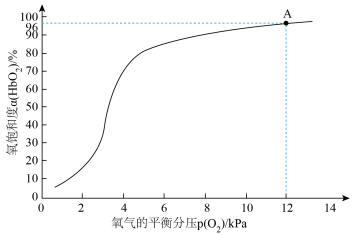
(3)36.5℃时,氧饱和度[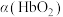 ,
,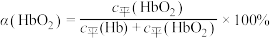 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
____________________ (写出计算过程;氧气的平衡浓度可用氧气的平衡分压代替)。
正常人体血液中主要含有 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
(4)37℃时 的水解常数
的水解常数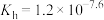 ,
,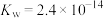 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式___________ ;请判断该同学血液的pH是否正常________ 。(填“是”或“否”)
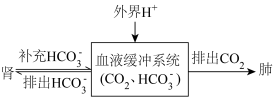
(5)人体酸碱平衡维持机制简要表达如下图: 会
会__________ (选填“增加”或“减少”)。
②对于重度代谢性酸中毒的病人应该采用什么治疗方法__________ 。(选填字母)
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5% 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合
 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:ⅰ.
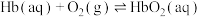

ⅱ.
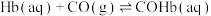

ⅱ.


ⅳ.
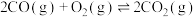

(1)

(2)
 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。A.当 不变时,反应达到平衡 不变时,反应达到平衡 | B.若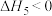 ,则该反应任意温度下能自发 ,则该反应任意温度下能自发 |
C.高氧条件下,血液中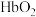 浓度增加 浓度增加 | D.人体代谢酸增加,该反应K值变大 |
(3)36.5℃时,氧饱和度[
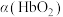 ,
,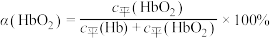 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
正常人体血液中主要含有
 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:项目名称 | 结果浓度 | 参考范围 | |
正常人 | 代谢性酸中毒病人 | ||
| 40 | 50 | 35~45 |
| 24.2 | 19 | 23.3~24.8 |
血液酸碱度(pH) | 7.40 | 7.21 | 7.35~7.45 |
(4)37℃时
 的水解常数
的水解常数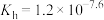 ,
,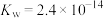 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式(5)人体酸碱平衡维持机制简要表达如下图:
 会
会②对于重度代谢性酸中毒的病人应该采用什么治疗方法
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5%
 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
您最近一年使用:0次
名校
7 . 工业废水中常含有一定量的 和
和 ,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。
,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。
1. 和
和 在溶液中有如下的转化关系:
在溶液中有如下的转化关系: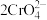 (黄色)
(黄色)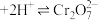 (橙色)
(橙色) 若平衡体系pH较低时,此时溶液显
若平衡体系pH较低时,此时溶液显___________ 色。
2.室温下,初始浓度为1.0 的
的 溶液中
溶液中 的平衡浓度随
的平衡浓度随 的变化如图所示,下列关于该反应的说法错误的是
的变化如图所示,下列关于该反应的说法错误的是___________ 。
B.A点的平衡转化率为50%
C.若向A点溶液中加入少量 固体,达到新平衡后,pH值升高,转化率升高
固体,达到新平衡后,pH值升高,转化率升高
D.若达到A点的时间为5s,则0~5s内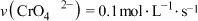
请根据图中A点数据,计算反应的平衡常数为___________ 。
某工厂采取还原沉淀法处理,该法的工艺流程为:
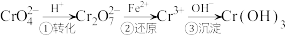
3. 的核外电子排布式是
的核外电子排布式是___________ 。
4.第②步反应的离子方程式为___________ 。
5. 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: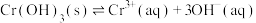 ,常温下,
,常温下, 的溶度积
的溶度积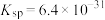 ,要使
,要使 降至
降至 时,溶液的pH应调至
时,溶液的pH应调至___________ 。(写出简单的计算过程)
6.常温下,Cr(Ⅲ)(表示+3价的铬)在水溶液中的存在形态分布如图所示。当pH>12时,溶液中Cr(Ⅲ)去除率下降的原因可用离子方程式表示为___________ 。 ,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是
,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是___________ 。
 和
和 ,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。
,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。1.
 和
和 在溶液中有如下的转化关系:
在溶液中有如下的转化关系: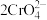 (黄色)
(黄色)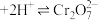 (橙色)
(橙色) 若平衡体系pH较低时,此时溶液显
若平衡体系pH较低时,此时溶液显2.室温下,初始浓度为1.0
 的
的 溶液中
溶液中 的平衡浓度随
的平衡浓度随 的变化如图所示,下列关于该反应的说法错误的是
的变化如图所示,下列关于该反应的说法错误的是
B.A点的平衡转化率为50%
C.若向A点溶液中加入少量
 固体,达到新平衡后,pH值升高,转化率升高
固体,达到新平衡后,pH值升高,转化率升高D.若达到A点的时间为5s,则0~5s内
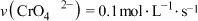
请根据图中A点数据,计算反应的平衡常数为
某工厂采取还原沉淀法处理,该法的工艺流程为:
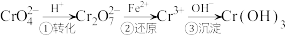
3.
 的核外电子排布式是
的核外电子排布式是4.第②步反应的离子方程式为
5.
 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: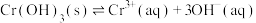 ,常温下,
,常温下, 的溶度积
的溶度积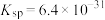 ,要使
,要使 降至
降至 时,溶液的pH应调至
时,溶液的pH应调至6.常温下,Cr(Ⅲ)(表示+3价的铬)在水溶液中的存在形态分布如图所示。当pH>12时,溶液中Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
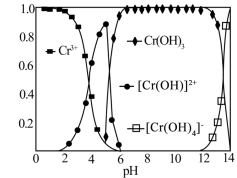
 ,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是
,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是
您最近一年使用:0次
名校
解题方法
8 . 我国力争2030年前完成碳达峰,2060年前实现碳中和,含碳化合物的合成与转化具有重要意义。
(1) 催化加氢可以合成甲醇,该过程主要发生下列反应:
催化加氢可以合成甲醇,该过程主要发生下列反应:
i.
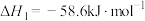
ii.

iii.CO和 也可合成甲醇,其热化学方程式为
也可合成甲醇,其热化学方程式为___________ 。
(2)若在绝热条件下,将 、
、 按体积比1∶2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是___________。
按体积比1∶2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是___________。
(3)若在一定温度下,向2L恒容密闭容器中充入3mol 和5mol
和5mol 同时发生反应i和ii,达到平衡时
同时发生反应i和ii,达到平衡时 的总转化率为80%,体系压强减小了25%,则
的总转化率为80%,体系压强减小了25%,则 的选择性为
的选择性为___________ ( 的选择性
的选择性 ),该温度下,反应i的化学平衡常数数值
),该温度下,反应i的化学平衡常数数值
___________ 。
(4)向容积可变的密闭容器中充入一定量的CO和 发生反应iii,在图中画出在压强
发生反应iii,在图中画出在压强 和
和 下(
下(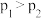 ),CO的平衡转化率随温度的变化图。
),CO的平衡转化率随温度的变化图。___________  转化为甲醇,原理如图所示。若右侧溶液中
转化为甲醇,原理如图所示。若右侧溶液中 溶液浓度不变(忽略体积的变化)且溶液中不产生
溶液浓度不变(忽略体积的变化)且溶液中不产生 ,则①阴极反应为电极
,则①阴极反应为电极___________ 。(填写a或b)(2)电极a上发生的电极反应式为___________ 。
(1)
 催化加氢可以合成甲醇,该过程主要发生下列反应:
催化加氢可以合成甲醇,该过程主要发生下列反应:i.

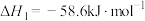
ii.


iii.CO和
 也可合成甲醇,其热化学方程式为
也可合成甲醇,其热化学方程式为(2)若在绝热条件下,将
 、
、 按体积比1∶2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是___________。
按体积比1∶2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是___________。| A.容器内混合气体的密度不变 | B.容器内混合气体的压强不变 |
C.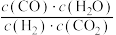 不变 不变 | D. |
(3)若在一定温度下,向2L恒容密闭容器中充入3mol
 和5mol
和5mol 同时发生反应i和ii,达到平衡时
同时发生反应i和ii,达到平衡时 的总转化率为80%,体系压强减小了25%,则
的总转化率为80%,体系压强减小了25%,则 的选择性为
的选择性为 的选择性
的选择性 ),该温度下,反应i的化学平衡常数数值
),该温度下,反应i的化学平衡常数数值
(4)向容积可变的密闭容器中充入一定量的CO和
 发生反应iii,在图中画出在压强
发生反应iii,在图中画出在压强 和
和 下(
下(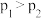 ),CO的平衡转化率随温度的变化图。
),CO的平衡转化率随温度的变化图。 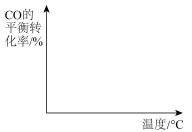
 转化为甲醇,原理如图所示。若右侧溶液中
转化为甲醇,原理如图所示。若右侧溶液中 溶液浓度不变(忽略体积的变化)且溶液中不产生
溶液浓度不变(忽略体积的变化)且溶液中不产生 ,则①阴极反应为电极
,则①阴极反应为电极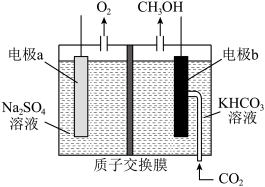
您最近一年使用:0次
名校
9 . 形状记忆陶瓷目前尚处于研究阶段,其中一种形状记忆陶瓷的主要原材料是纳米级ZrO2,用锆石(ZrSiO4,含少量FeO、Al2O3和制备纳米级ZrO2的流程设计如图1:
回答下列问题。
(1)锆石“粉碎过筛”的目的是___________ 。
(2)“酸浸”过程中发生的氧化还原反应的离子方程式为___________ 。滤渣1的主要成分是 ___________ 。若室温下Ksp[Cu(CN)2]=4×10﹣11,则为了使溶液中的c(Cu2+)≤1×10﹣5mol•L﹣1,则溶液中CN﹣的浓度不能低于 ___________ 。
(3)工业生产中常常用无水乙醇洗涤Zr(OH)4,除了可以使纳米级ZrO2纯度更高、颗粒更细外,还可以___________ 。
(4)酸浸时,得到的溶质主要是ZrOCl2,而不是预想中的ZrCl4,说明ZrCl4很容易水解,则ZrCl4水解产生ZrOCl2的化学方程式是___________ 。
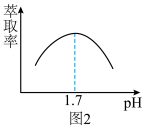
(5)除Fe3+也可以用合适的萃取剂,Fe3+的萃取率与pH的关系如图2所示,pH>1.7后,随pH增大3+萃取率下降的原因是___________ 。

回答下列问题。
(1)锆石“粉碎过筛”的目的是
(2)“酸浸”过程中发生的氧化还原反应的离子方程式为
(3)工业生产中常常用无水乙醇洗涤Zr(OH)4,除了可以使纳米级ZrO2纯度更高、颗粒更细外,还可以
(4)酸浸时,得到的溶质主要是ZrOCl2,而不是预想中的ZrCl4,说明ZrCl4很容易水解,则ZrCl4水解产生ZrOCl2的化学方程式是
(5)除Fe3+也可以用合适的萃取剂,Fe3+的萃取率与pH的关系如图2所示,pH>1.7后,随pH增大3+萃取率下降的原因是
您最近一年使用:0次
10 . 甲醇(CH3OH)在化学工业、农业生产等领域有着广泛应用。回答下列问题:
(1)CH3OH的电子式为___________ 。
(2)工业上可将煤先转化为CO(g)和H2(g),然后在催化剂作用下合成CH3OH(l),该过程称为煤的___________ 。已知相关物质的燃烧热数值如下表,则反应CO(g)+2H2(g) CH3OH(l)的∆H=
CH3OH(l)的∆H=___________ 。
(3)常温下,将一定量CH3OH(1)放入真空的恒容密闭中,发生CH3OH(l) CH3OH(g) ∆H=+1109.0kJ·mol-1。
CH3OH(g) ∆H=+1109.0kJ·mol-1。
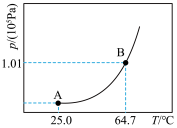
①某温度下,甲醇达到液气平衡状态时的压强称为甲醇在该温度下的饱和蒸气压,记为p*。p*与温度T的关系如图所示,B点蒸气压大于A点蒸气压的原因是___________ 。
i.如图所示,甲烧杯中盛有甲醇,乙烧杯盛有NaOH的甲醇溶液,常温下将两烧杯置于真空密闭容器中,足够长的时间后,可能会观察到___________ (填字母)所示的现象。___________ kPa,馏分中甲醇的物质的量分数为___________ 。
(4)CH3OH可用于制备甲醇燃料电池。
①单位质量燃料所输出电能的多少称为燃料电池的比能量,若某甲醇燃料电池的输出电压为3.60V,其比能量为___________ kW⋅h⋅kg-1(结果保留一位小数)。已知: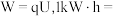 3.6×10⁶J,1mol电子的电量为96500C。
3.6×10⁶J,1mol电子的电量为96500C。
②在实验室中用甲醇燃料电池模拟铝制品在稀硫酸溶液中进行的表面钝化处理,Al电极应与甲醇燃料电池的___________ 极相连,Al电极上发生的电极反应方程式为___________ 。
(1)CH3OH的电子式为
(2)工业上可将煤先转化为CO(g)和H2(g),然后在催化剂作用下合成CH3OH(l),该过程称为煤的
 CH3OH(l)的∆H=
CH3OH(l)的∆H=| 物质 | CO(g) | H2(g) | CH3OH(l) |
| 燃烧热/kJ·mol-1 | -283.0 | -285.8 | -726.5 |
(3)常温下,将一定量CH3OH(1)放入真空的恒容密闭中,发生CH3OH(l)
 CH3OH(g) ∆H=+1109.0kJ·mol-1。
CH3OH(g) ∆H=+1109.0kJ·mol-1。①某温度下,甲醇达到液气平衡状态时的压强称为甲醇在该温度下的饱和蒸气压,记为p*。p*与温度T的关系如图所示,B点蒸气压大于A点蒸气压的原因是
i.如图所示,甲烧杯中盛有甲醇,乙烧杯盛有NaOH的甲醇溶液,常温下将两烧杯置于真空密闭容器中,足够长的时间后,可能会观察到

| 物质 | CH3OH(l) | H2O(1) |
| p*(64.7℃)/kPa | 101.30 | 23.90 |
(4)CH3OH可用于制备甲醇燃料电池。
①单位质量燃料所输出电能的多少称为燃料电池的比能量,若某甲醇燃料电池的输出电压为3.60V,其比能量为
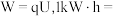 3.6×10⁶J,1mol电子的电量为96500C。
3.6×10⁶J,1mol电子的电量为96500C。②在实验室中用甲醇燃料电池模拟铝制品在稀硫酸溶液中进行的表面钝化处理,Al电极应与甲醇燃料电池的
您最近一年使用:0次