1 . 完成下列问题。
(1)某温度下,纯水中的c(OH-)=1×10-6 mol/L,则此时c(H+)为_____ mol/L。若在温度不变时,往其中滴加盐酸使 c(H+)=1×10-4mol/L,则溶液中c(OH-)为_____ mol/L。若将此盐酸稀释 1 000 倍,则溶液的c(H+)约为______ mol/L。
(2)已知:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),Ksp=2×10-20。
Cu2+(aq)+2OH-(aq),Ksp=2×10-20。
①某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要使其生成 Cu(OH)2沉淀,应调整溶液的pH,使之大于_____ 。
②要使0.2 mol·L-1CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为_____ 。
(3)重金属离子会对河流和海洋造成严重污染。某化工厂废水(pH=2.0)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01 mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
①你认为往废水中加入_____ (填字母),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8,处理后废水中c(Pb2+)=_____ 。
(1)某温度下,纯水中的c(OH-)=1×10-6 mol/L,则此时c(H+)为
(2)已知:Cu(OH)2(s)
 Cu2+(aq)+2OH-(aq),Ksp=2×10-20。
Cu2+(aq)+2OH-(aq),Ksp=2×10-20。①某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要使其生成 Cu(OH)2沉淀,应调整溶液的pH,使之大于
②要使0.2 mol·L-1CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为
(3)重金属离子会对河流和海洋造成严重污染。某化工厂废水(pH=2.0)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01 mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 |
| 难溶电解质 | PbI2 | Pb(OH)2 | PbS |
| Ksp | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8,处理后废水中c(Pb2+)=
您最近一年使用:0次
2 . 完成下列问题。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(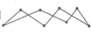 ),则Q=
),则Q=______ 。
(2)已知反应aA(g)+bB(g) cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。_____ 。
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为______ 。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ 。
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
(4)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
①下列操作中,能提高CH4(g)平衡转化率的是____ (填标号)。
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=____ [写出含有α、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=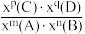 ,x为物质的量分数]。
,x为物质的量分数]。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(
 ),则Q=
),则Q=(2)已知反应aA(g)+bB(g)
 cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。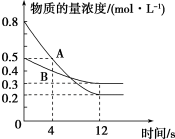
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g)
 N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。| A.升高温度,混合气体的颜色变浅 |
| B.通入NO2,化学平衡常数增大 |
| C.通入NO2,重新达到平衡后混合气体的平均相对分子质量增大 |
| D.增大压强,平衡向正反应方向移动,混合气体的颜色变浅 |
Ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)①下列操作中,能提高CH4(g)平衡转化率的是
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=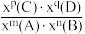 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
3 . 我国主要以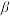 型锂辉石(主要成分
型锂辉石(主要成分 、
、 、
、 ,含有
,含有 、
、 等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂
等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂 并制备锂离子电池的正极材料
并制备锂离子电池的正极材料 。流程如下:
。流程如下: 不溶于水,能溶于强酸。
不溶于水,能溶于强酸。
②部分金属氢氧化物的 如下表。
如下表。
③ 和
和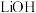 的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。
的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。
(1)“球磨”操作的目的是_______ 。
(2)加入石灰石中和残酸,调节pH使铁、铝等杂质完全沉淀,则pH至少为_______ 。(保留一位小数。通常认为溶液中离子浓度小于 为沉淀完全)
为沉淀完全)
(3)滤渣2的成分是_______ 。
(4)获得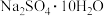 时,通常“冷冻至0℃”,原因是
时,通常“冷冻至0℃”,原因是_______ 。
(5)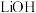 溶液与
溶液与 和
和 混合溶液制备
混合溶液制备 的化学方程式为
的化学方程式为_______ ;两种溶液相互滴加的方式不同会影响产率和纯度,有同学认为应该将 和
和 混合液滴加到
混合液滴加到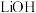 溶液中,你认为是否合理
溶液中,你认为是否合理_______ (填“是”或“否”),说明理由:_______ 。
(6) 需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是
需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是_______ (任写一点)。
 型锂辉石(主要成分
型锂辉石(主要成分 、
、 、
、 ,含有
,含有 、
、 等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂
等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂 并制备锂离子电池的正极材料
并制备锂离子电池的正极材料 。流程如下:
。流程如下: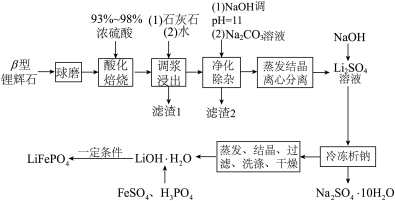
 不溶于水,能溶于强酸。
不溶于水,能溶于强酸。②部分金属氢氧化物的
 如下表。
如下表。| 物质 |  |  |  |
 | 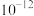 | 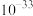 | 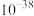 |
 和
和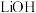 的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。
的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。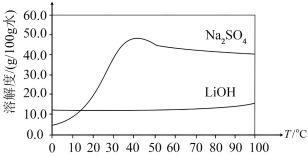
(1)“球磨”操作的目的是
(2)加入石灰石中和残酸,调节pH使铁、铝等杂质完全沉淀,则pH至少为
 为沉淀完全)
为沉淀完全)(3)滤渣2的成分是
(4)获得
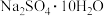 时,通常“冷冻至0℃”,原因是
时,通常“冷冻至0℃”,原因是(5)
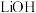 溶液与
溶液与 和
和 混合溶液制备
混合溶液制备 的化学方程式为
的化学方程式为 和
和 混合液滴加到
混合液滴加到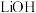 溶液中,你认为是否合理
溶液中,你认为是否合理(6)
 需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是
需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是
您最近一年使用:0次
2024-02-25更新
|
1237次组卷
|
6卷引用:化学(全国卷旧教材)-2024年高考押题预测卷
(已下线)化学(全国卷旧教材)-2024年高考押题预测卷广西柳州高中、南宁三中名校联盟2023-2024学年高三一轮复习诊断联考化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届陕西省西安市第一中学高三下学期第十六次模拟考试理综试题-高中化学广西来宾市忻城县高级中2023-2024学年高二下学期期中考试化学试卷
4 . 已知:A(g)+3B(g) 2C(g) ΔH<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是
2C(g) ΔH<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是
 2C(g) ΔH<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是
2C(g) ΔH<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是| A.甲中达平衡时,用B的浓度变化表示5min内的平均反应速率为0.15 mol・L-1・min-1 |
B.乙中的热化学方程式为2C(g) A(g)+3B(g):ΔH= A(g)+3B(g):ΔH=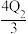 kJ/mol kJ/mol |
| C.乙中达到平衡后,再加入0.25molA、0.75molB、1.5molC,平衡不移动 |
| D.乙中平衡时C的转化率为75% |
您最近一年使用:0次
5 . NaBiO3(铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉[主要成分是Bi2S3,含少量SiO2、Cu2S、FeS2 等杂质]为原料制备铋酸钠的流程如下:

请回答下列问题:
(1)浸渣的主要成分___________ ;Cu在周期表中的位置是第四周期,___________ 族;基态Cu+的电子排布式是___________ 。
(2)检验“酸浸”液中是否含Fe2+,可选择K3[Fe(CN)6]溶液。能证明不存在Fe2+的实验现象是___________ 。
(3)“除铁”时需调节溶液的pH为3.7,这时溶液中的Fe3+已沉淀完全。从平衡原理解释加入CuO如何除去Fe3+___________ ;从沉淀溶解平衡角度计算Fe(OH)3的溶度积常数Ksp[Fe(OH)3]=___________
(4)已知Ksp[Cu(OH)2]=2.0×10-20,Cu2+(aq)+4NH3·H2O(aq) [Cu(NH3)4]2+(aq)+4H2O(l)的平衡常数K1=2.0×1013。Cu(OH)2(s)+4 NH3·H2O(aq)
[Cu(NH3)4]2+(aq)+4H2O(l)的平衡常数K1=2.0×1013。Cu(OH)2(s)+4 NH3·H2O(aq) [Cu(NH3)4]+(ag)+2OH-(aq)+ 4H2O(l)的平衡常数K2=
[Cu(NH3)4]+(ag)+2OH-(aq)+ 4H2O(l)的平衡常数K2=___________ 。
(5)写出“氧化”步骤对应的离子方程式:___________
(6)探究NaBiO3的性质:
结合上述实验及所学知识,在酸性条件下,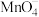 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是___________ (填化学式),这些物质中元素基态原子中未成对电子数最多的是___________ (填元素名称)。

请回答下列问题:
(1)浸渣的主要成分
(2)检验“酸浸”液中是否含Fe2+,可选择K3[Fe(CN)6]溶液。能证明不存在Fe2+的实验现象是
(3)“除铁”时需调节溶液的pH为3.7,这时溶液中的Fe3+已沉淀完全。从平衡原理解释加入CuO如何除去Fe3+
(4)已知Ksp[Cu(OH)2]=2.0×10-20,Cu2+(aq)+4NH3·H2O(aq)
 [Cu(NH3)4]2+(aq)+4H2O(l)的平衡常数K1=2.0×1013。Cu(OH)2(s)+4 NH3·H2O(aq)
[Cu(NH3)4]2+(aq)+4H2O(l)的平衡常数K1=2.0×1013。Cu(OH)2(s)+4 NH3·H2O(aq) [Cu(NH3)4]+(ag)+2OH-(aq)+ 4H2O(l)的平衡常数K2=
[Cu(NH3)4]+(ag)+2OH-(aq)+ 4H2O(l)的平衡常数K2=(5)写出“氧化”步骤对应的离子方程式:
(6)探究NaBiO3的性质:
| 实验 | 操作 | 现象 |
| Ⅰ | 取少量NaBiO3粉末于试管中,加入浓盐酸,振荡;用镊子夹一块湿润的淀粉KI试纸放置在试管口上方 | 浅黄色固体溶解,产生黄绿色气体,试纸变蓝 |
| Ⅱ | 在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末,振荡 | 无色溶液变紫红色溶液 |
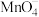 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是
您最近一年使用:0次
名校
6 . 由于存在同种电解质溶液的浓度差而产生电动势的电池称为浓差电池。利用浓差电池电解硫酸钠溶液可以制得氧气、氢气、硫酸和氢氧化钠,其装置如图所示(a、b电极均为石墨电极,已知:溶液A为1L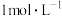
 溶液;溶液B为1L
溶液;溶液B为1L 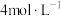
 溶液)。下列说法不正确的是
溶液)。下列说法不正确的是

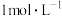
 溶液;溶液B为1L
溶液;溶液B为1L 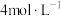
 溶液)。下列说法不正确的是
溶液)。下列说法不正确的是
A.电池放电过程中Ag(2)为正极,电极反应为 |
B.b电极为电解池阴极,电极反应式为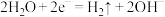 |
| C.c、d离子交换膜依次为阴离子交换膜、阳离子交换膜 |
D.电池从开始工作到停止放电,电解池理论上可制得80g  |
您最近一年使用:0次
2024-01-21更新
|
646次组卷
|
2卷引用:宁夏回族自治区石嘴山市第三中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
7 . 现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶解的物质。(设溶液体积不变,且不考虑金属离子水解)。请回答下列问题:
(1)充分反应后,溶液中存在4.8g不溶物的成分为___________ (用化学式表示)。
(2)充分反应后溶液中一定不存在的金属离子为___________ 。
(3)比较 、
、 、
、 的氧化性大小:
的氧化性大小:___________ 。
(4)试计算最后溶液中 离子的物质的量浓度
离子的物质的量浓度___________ mol/L。
(1)充分反应后,溶液中存在4.8g不溶物的成分为
(2)充分反应后溶液中一定不存在的金属离子为
(3)比较
 、
、 、
、 的氧化性大小:
的氧化性大小:(4)试计算最后溶液中
 离子的物质的量浓度
离子的物质的量浓度
您最近一年使用:0次
名校
8 . 室温下,将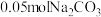 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
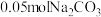 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是| 加入的物质 | 结论 | |
| A. | 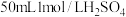 | 反应结束后, |
| B. | 0.05molCaO | 溶液中 增大 增大 |
| C. | 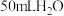 | 由水电离出的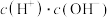 的乘积不变 的乘积不变 |
| D. | 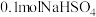 固体 固体 | 反应完全后,溶液pH减小,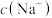 不变 不变 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . NaHSO4是一种酸式盐,请回答下列问题:
(1)NaHSO4在熔融状态下的电离方程式为___________ 。
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为___________ 。
(3)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出该反应的离子方程式:___________ 。
②下列三种情况下,离子方程式与上述①相同的是___________ (填字母,下同)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示,下列分析不 正确的是___________。

(1)NaHSO4在熔融状态下的电离方程式为
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为
(3)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出该反应的离子方程式:
②下列三种情况下,离子方程式与上述①相同的是
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至
 恰好完全沉淀
恰好完全沉淀C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示,下列分析

| A.①代表滴加H2SO4溶液的变化曲线 |
| B.b点,溶液中大量存在的离子是Na+、OH- |
| C.c点,两溶液中含有相同量的OH- |
| D.a、d两点对应的溶液均呈中性 |
您最近一年使用:0次
10 . 25℃时,向20 mL 0.1 mol·L−1 Na2CO3溶液中逐滴加入40 mL 0.1 mol·L−1 HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是
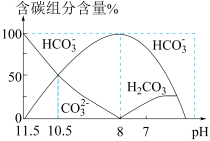
| A.pH = 8时,溶液中水的电离程度最大 |
B.当溶液中c(HCO ):c(CO ):c(CO ) = 2:1时,溶液的pH = 10.2(已知lg2取0.3) ) = 2:1时,溶液的pH = 10.2(已知lg2取0.3) |
C.在同一溶液中,H2CO3、HCO 、CO 、CO 能大量共存 能大量共存 |
D.pH = 7时,溶液中离子浓度大小关系为:c(Na+) > c(HCO ) > c(Cl−) ) > c(Cl−) |
您最近一年使用:0次
2023-12-31更新
|
885次组卷
|
6卷引用:宁夏开元学校2023-2024学年高二上学期期末考试化学试题
宁夏开元学校2023-2024学年高二上学期期末考试化学试题2024届四川省双流棠湖中学高三上学期第一次联考理科综合能力测试试题四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)黑龙江省哈尔滨市第九中学2023-2024学年高二下学期开学考试化学试卷



