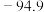解题方法
1 . 宏观辨识与微观探析是化学学科核心素养之一。常温下,下列各组粒子在指定溶液中能大量共存的是
A.0.1 mol⋅L 碳酸钠溶液( 碳酸钠溶液( )中: )中: 、 、 、 、 |
B.加入苯酚显紫色的溶液中能大量共存的离子: 、 、 、 、 、 、 |
C.0.1 mol⋅L 酸性 酸性 溶液中: 溶液中: 、 、 、 、 、 、 |
D.常温下 mol⋅L mol⋅L 的溶液中: 的溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
名校
2 . 苯甲酸是一种重要原料。实验室可以用甲苯与高锰酸钾反应制得苯甲酸,反应装置图和有关数据如下:
合成步骤如下:
①在三颈烧瓶中加入5.4mL甲苯和30mL稀硫酸,放入碎瓷片,加热至沸腾时再迅速加入12.8g高锰酸钾固体,继续加热到甲苯层消失,过滤;
②反应后的溶液仍呈紫色,在容器中加入适量亚硫酸氢钠溶液,振荡,直到溶液变为无色,搅拌下向容器中加入足量浓盐酸;待反应完全后,将反应容器放在冰水浴中冷却,析出晶体,过滤,洗涤,干燥,称量。
(1)仪器A的名称是____________ ,它的作用是____________ 。
(2)加入碎瓷片的作用是____________ 。
(3)加入亚硫酸氢钠溶液使紫色褪去时发生反应的离子方程式为________________________ 。
(4)若得到的苯甲酸晶体产品不纯,则采用____________ 方法可得到纯度更高的产品。
(5)下列有关苯甲酸重结晶实验的说法正确的是_________ (填字母)。
A.粗苯甲酸溶解过程中,加热、玻璃棒搅拌均能提高苯甲酸的溶解度
B.在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还需加少量蒸馏水
C.冷却结晶时,温度过低将析出杂质,故此时温度不是越低越好
(6)若最后得到纯净的苯甲酸质量为4.0g,则该反应的产率是____________ (保留一位小数)。
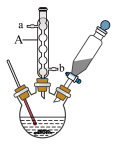
物质 | 熔点/℃ | 沸点/℃ | 水中溶解度/g(25℃) | 相对分子质量 | 密度/( |
甲苯 |
| 110.6 | 难溶 | 92 | 0.85 |
苯甲酸 | 122.13 | 249 | 0.344 | 122 | 1.27 |
①在三颈烧瓶中加入5.4mL甲苯和30mL稀硫酸,放入碎瓷片,加热至沸腾时再迅速加入12.8g高锰酸钾固体,继续加热到甲苯层消失,过滤;
②反应后的溶液仍呈紫色,在容器中加入适量亚硫酸氢钠溶液,振荡,直到溶液变为无色,搅拌下向容器中加入足量浓盐酸;待反应完全后,将反应容器放在冰水浴中冷却,析出晶体,过滤,洗涤,干燥,称量。
已知: 。
。
(1)仪器A的名称是
(2)加入碎瓷片的作用是
(3)加入亚硫酸氢钠溶液使紫色褪去时发生反应的离子方程式为
(4)若得到的苯甲酸晶体产品不纯,则采用
(5)下列有关苯甲酸重结晶实验的说法正确的是
A.粗苯甲酸溶解过程中,加热、玻璃棒搅拌均能提高苯甲酸的溶解度
B.在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还需加少量蒸馏水
C.冷却结晶时,温度过低将析出杂质,故此时温度不是越低越好
(6)若最后得到纯净的苯甲酸质量为4.0g,则该反应的产率是
您最近一年使用:0次
名校
3 . 氮化铍可用于新型的耐火陶瓷材料和反应堆材料,可由铍粉和干燥氮气在无氧气氛中于700~1400℃的温度下加热制得。以绿柱石(主要组成是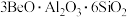 ,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。 如表所示。
如表所示。
回答下列问题:
(1)“酸浸”时绿柱石要进行粉碎,其目的是_______ 。
(2)“转化”时加入 的目的是
的目的是_______ (用离子方程式表示)。
(3)“调 ”时加入适量
”时加入适量 细粉除去
细粉除去 和
和 ,调节溶液
,调节溶液 的范围是
的范围是_______ ,其中沉淀 的离子方程式为
的离子方程式为_______ ,“滤渣2”的主要成分是_______ (填化学式)。
(4)“沉铍”时所加试剂 是
是_______ (填“氨水”或“ 溶液”)。
溶液”)。
(5)生成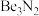 的化学方程式为
的化学方程式为_______ 。
 ,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
 如表所示。
如表所示。| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 6.3 | 1.8 | 3.1 | 5.6 | 12.4 |
| 沉淀完全pH | 8.3 | 3.2 | 4.8 | 8.5 | 13.8 |
(1)“酸浸”时绿柱石要进行粉碎,其目的是
(2)“转化”时加入
 的目的是
的目的是(3)“调
 ”时加入适量
”时加入适量 细粉除去
细粉除去 和
和 ,调节溶液
,调节溶液 的范围是
的范围是 的离子方程式为
的离子方程式为(4)“沉铍”时所加试剂
 是
是 溶液”)。
溶液”)。(5)生成
 的化学方程式为
的化学方程式为
您最近一年使用:0次
2024-05-16更新
|
27次组卷
|
2卷引用:2024年甘肃省张掖市第一中学模拟化学试题
名校
4 . 黄铁矿( )在酸性条件下发生催化氧化的反应历程如图所示。下列说法错误的是
)在酸性条件下发生催化氧化的反应历程如图所示。下列说法错误的是
 )在酸性条件下发生催化氧化的反应历程如图所示。下列说法错误的是
)在酸性条件下发生催化氧化的反应历程如图所示。下列说法错误的是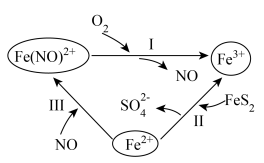
| A.反应Ⅰ、Ⅱ、Ⅲ均发生氧化还原反应 |
B.反应Ⅰ中氧化剂与还原剂的物质的量之比为 |
C.反应Ⅱ的离子方程式为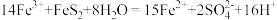 |
D.该过程的总反应为 |
您最近一年使用:0次
2024-05-16更新
|
216次组卷
|
3卷引用:2024年甘肃省张掖市第一中学模拟化学试题
解题方法
5 . 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图中方式插入 相同浓度的稀硫酸中一段时间,回答下列问题:
相同浓度的稀硫酸中一段时间,回答下列问题:___________ 。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的 均增大
均增大
②相同时间内,甲、乙中产生气泡的速度:甲___________ 乙(填“ ”“
”“ ”或“
”或“ ”)。
”)。
③请写出图中构成原电池的负极电极反应式:___________ 。 构成原电池的装置工作时,溶液中 向
向 ___________ 极移动。
④当乙中产生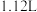 (标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至
(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至 ,测得溶液中
,测得溶液中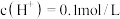 (设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为
(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为___________ 。
(2)当甲中产生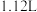 (标准状况)气体时,理论上通过导线的电子数目为
(标准状况)气体时,理论上通过导线的电子数目为___________ 。
(3)若将反应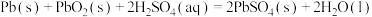 设计成原电池。用导线连接金属
设计成原电池。用导线连接金属 和
和 ,电解质为稀硫酸。
,电解质为稀硫酸。
①正极为___________ (填“ ”或“
”或“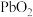 ”)极。
”)极。
(1)将纯锌片和纯铜片按图中方式插入
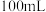 相同浓度的稀硫酸中一段时间,回答下列问题:
相同浓度的稀硫酸中一段时间,回答下列问题: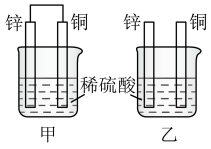
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的
 均增大
均增大②相同时间内,甲、乙中产生气泡的速度:甲
 ”“
”“ ”或“
”或“ ”)。
”)。③请写出图中构成原电池的负极电极反应式:
 向
向 ④当乙中产生
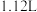 (标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至
(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至 ,测得溶液中
,测得溶液中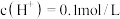 (设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为
(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为(2)当甲中产生
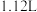 (标准状况)气体时,理论上通过导线的电子数目为
(标准状况)气体时,理论上通过导线的电子数目为(3)若将反应
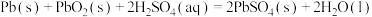 设计成原电池。用导线连接金属
设计成原电池。用导线连接金属 和
和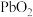 ,电解质为稀硫酸。
,电解质为稀硫酸。①正极为
 ”或“
”或“ ”)极。
”)极。
您最近一年使用:0次
6 . 氢能是一种绿色能源,工业上采用多种途径制备 。
。
Ⅰ.甲醇( )是潜在储氢材料。甲醇制氢的反应历程如下:
)是潜在储氢材料。甲醇制氢的反应历程如下: (g)分解制氢的热化学方程式:
(g)分解制氢的热化学方程式:_______ 。
(2)上述反应历程中,控速步骤的方程式为_______ 。
Ⅱ.天然气制备 。反应原理如下:
。反应原理如下:
反应1:

反应2:
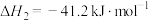
(3)工业制 中,将混合气体通入KOH溶液吸收
中,将混合气体通入KOH溶液吸收 ,便于提高
,便于提高 纯度和产率。
纯度和产率。

 ,宜选择的条件是_______(填字母)。
,宜选择的条件是_______(填字母)。
(4)研究表明, 的反应速率方程为
的反应速率方程为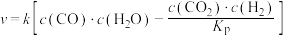 ,其中,
,其中, 为压强平衡常数,k为反应速率常数且随温度升高而增大。在气体组成和催化剂一定条件下,反应速率与温度关系如图2所示。温度高于
为压强平衡常数,k为反应速率常数且随温度升高而增大。在气体组成和催化剂一定条件下,反应速率与温度关系如图2所示。温度高于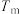 时,v逐渐减小的原因是
时,v逐渐减小的原因是_______ 。 (g)和
(g)和 (g)初始投料比一定,在某催化剂作用下发生反应1和2,经过相同时间测得如下数据(反应未达到平衡状态):
(g)初始投料比一定,在某催化剂作用下发生反应1和2,经过相同时间测得如下数据(反应未达到平衡状态):
已知: 的选择性
的选择性 。
。
数据表明,升高温度, 的转化率增大,而
的转化率增大,而 的选择性降低,可能的原因是
的选择性降低,可能的原因是_______ 。
(6)在1.0L恒容密闭容器中投入1mol (g)和1mol
(g)和1mol  (g)发生反应1和2,实验测得
(g)发生反应1和2,实验测得 平衡转化率与温度、压强关系如图3,540℃、
平衡转化率与温度、压强关系如图3,540℃、 下,Q点
下,Q点
_______  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
_______  。T点,CO选择性为80%,对应温度下反应1的化学平衡常数K为
。T点,CO选择性为80%,对应温度下反应1的化学平衡常数K为_______  (结果保留1位小数)。
(结果保留1位小数)。
 。
。Ⅰ.甲醇(
 )是潜在储氢材料。甲醇制氢的反应历程如下:
)是潜在储氢材料。甲醇制氢的反应历程如下:
 (g)分解制氢的热化学方程式:
(g)分解制氢的热化学方程式:(2)上述反应历程中,控速步骤的方程式为
Ⅱ.天然气制备
 。反应原理如下:
。反应原理如下:反应1:


反应2:

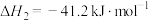
(3)工业制
 中,将混合气体通入KOH溶液吸收
中,将混合气体通入KOH溶液吸收 ,便于提高
,便于提高 纯度和产率。
纯度和产率。

 ,宜选择的条件是_______(填字母)。
,宜选择的条件是_______(填字母)。| A.高温、高压 | B.低温、低压 | C.低温、高压 | D.高温、低压 |
(4)研究表明,
 的反应速率方程为
的反应速率方程为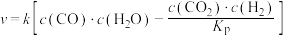 ,其中,
,其中, 为压强平衡常数,k为反应速率常数且随温度升高而增大。在气体组成和催化剂一定条件下,反应速率与温度关系如图2所示。温度高于
为压强平衡常数,k为反应速率常数且随温度升高而增大。在气体组成和催化剂一定条件下,反应速率与温度关系如图2所示。温度高于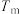 时,v逐渐减小的原因是
时,v逐渐减小的原因是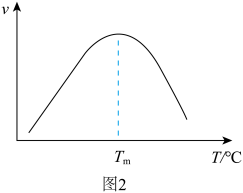
 (g)和
(g)和 (g)初始投料比一定,在某催化剂作用下发生反应1和2,经过相同时间测得如下数据(反应未达到平衡状态):
(g)初始投料比一定,在某催化剂作用下发生反应1和2,经过相同时间测得如下数据(反应未达到平衡状态):| T/K |  的转化率/% 的转化率/% |  的选择性/% 的选择性/% |
| 543 | 12.3 | 23.1 |
| 553 | 15.6 | 18.5 |
 的选择性
的选择性 。
。数据表明,升高温度,
 的转化率增大,而
的转化率增大,而 的选择性降低,可能的原因是
的选择性降低,可能的原因是(6)在1.0L恒容密闭容器中投入1mol
 (g)和1mol
(g)和1mol  (g)发生反应1和2,实验测得
(g)发生反应1和2,实验测得 平衡转化率与温度、压强关系如图3,540℃、
平衡转化率与温度、压强关系如图3,540℃、 下,Q点
下,Q点
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
 。T点,CO选择性为80%,对应温度下反应1的化学平衡常数K为
。T点,CO选择性为80%,对应温度下反应1的化学平衡常数K为 (结果保留1位小数)。
(结果保留1位小数)。
您最近一年使用:0次
2024-05-06更新
|
76次组卷
|
3卷引用:甘肃省张掖市某校2023-2024学年高三下学期模拟考试化学试题
7 . 我国主要以 型锂辉石(主要成分
型锂辉石(主要成分 、
、 、
、 ,含有
,含有 、
、 等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂
等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂 并制备锂离子电池的正极材料
并制备锂离子电池的正极材料 。流程如下:
。流程如下: 不溶于水,能溶于强酸。
不溶于水,能溶于强酸。
②部分金属氢氧化物的 如下表。
如下表。
③ 和
和 的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。
的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。
(1)“球磨”操作的目的是_______ 。
(2)加入石灰石中和残酸,调节pH使铁、铝等杂质完全沉淀,则pH至少为_______ 。(保留一位小数。通常认为溶液中离子浓度小于 为沉淀完全)
为沉淀完全)
(3)滤渣2的成分是_______ 。
(4)获得 时,通常“冷冻至0℃”,原因是
时,通常“冷冻至0℃”,原因是_______ 。
(5) 溶液与
溶液与 和
和 混合溶液制备
混合溶液制备 的化学方程式为
的化学方程式为_______ ;两种溶液相互滴加的方式不同会影响产率和纯度,有同学认为应该将 和
和 混合液滴加到
混合液滴加到 溶液中,你认为是否合理
溶液中,你认为是否合理_______ (填“是”或“否”),说明理由:_______ 。
(6) 需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是
需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是_______ (任写一点)。
 型锂辉石(主要成分
型锂辉石(主要成分 、
、 、
、 ,含有
,含有 、
、 等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂
等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂 并制备锂离子电池的正极材料
并制备锂离子电池的正极材料 。流程如下:
。流程如下: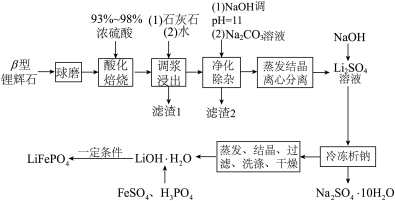
 不溶于水,能溶于强酸。
不溶于水,能溶于强酸。②部分金属氢氧化物的
 如下表。
如下表。| 物质 |  |  |  |
 | 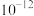 | 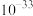 | 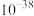 |
 和
和 的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。
的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。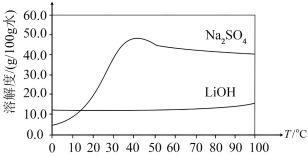
(1)“球磨”操作的目的是
(2)加入石灰石中和残酸,调节pH使铁、铝等杂质完全沉淀,则pH至少为
 为沉淀完全)
为沉淀完全)(3)滤渣2的成分是
(4)获得
 时,通常“冷冻至0℃”,原因是
时,通常“冷冻至0℃”,原因是(5)
 溶液与
溶液与 和
和 混合溶液制备
混合溶液制备 的化学方程式为
的化学方程式为 和
和 混合液滴加到
混合液滴加到 溶液中,你认为是否合理
溶液中,你认为是否合理(6)
 需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是
需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是
您最近一年使用:0次
2024-02-25更新
|
1237次组卷
|
6卷引用:专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)广西柳州高中、南宁三中名校联盟2023-2024学年高三一轮复习诊断联考化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)化学(全国卷旧教材)-2024年高考押题预测卷2024届陕西省西安市第一中学高三下学期第十六次模拟考试理综试题-高中化学广西来宾市忻城县高级中2023-2024学年高二下学期期中考试化学试卷
名校
8 . 常温下,向 的
的 溶液中滴加
溶液中滴加 的
的 溶液,溶液中
溶液,溶液中 随pH的变化关系如图所示(
随pH的变化关系如图所示(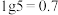 )。下列说法错误的是
)。下列说法错误的是
 的
的 溶液中滴加
溶液中滴加 的
的 溶液,溶液中
溶液,溶液中 随pH的变化关系如图所示(
随pH的变化关系如图所示(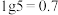 )。下列说法错误的是
)。下列说法错误的是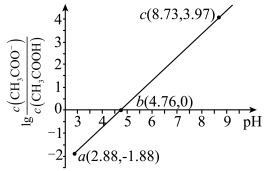
A.常温下, 的电离平衡常数为 的电离平衡常数为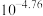 |
B.当溶液的 时,消耗 时,消耗 溶液体积小于 溶液体积小于 |
C.c点溶液中: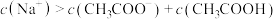 |
D.溶液中水的电离程度大小: |
您最近一年使用:0次
2023-12-05更新
|
1327次组卷
|
7卷引用:专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)吉林省长春市2024届高三上学期质量监测(一)化学试题福建省厦门双十中学2023-2024学年高三上学期12月月考化学试题安徽省合肥市第一中学2023-2024学年高二上学期12月月考化学试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)江西省宜春市丰城中学东校区(九中)2023-2024学年高二下学期开学考试化学试卷2024届吉林省通化市梅河口市第五中学高三下学期二模化学试题
名校
9 . 钙元素以多种形式广泛存在于自然界中,鸡蛋壳中钙的存在形式为CaCO3。为测定鸡蛋壳中钙的含量,课外小组做如下实验:
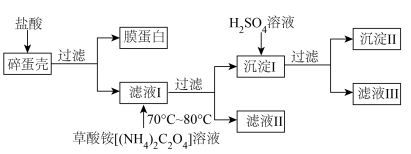
回答下列问题。
(1)滤液I与草酸铵反应采用水浴加热的优点是_______ 。
(2)为保证实验精确度,判断沉淀I是否洗涤干净的方法是_______ 。
(3)向沉淀 中加入
中加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。
(4)用 标准溶液滴定滤液III的过程中,
标准溶液滴定滤液III的过程中, (VII)被还原为
(VII)被还原为 (II),C(III)被氧化为
(II),C(III)被氧化为 。现将滤液III稀释至
。现将滤液III稀释至 ,再取其中的
,再取其中的 溶液,用
溶液,用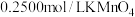 标准溶液滴定。
标准溶液滴定。
①以上操作过程中一定需要下列哪些仪器:_______ (填字母)。
②达到滴定终点时,溶液的颜色变化是_______ 。
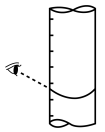
③滴定到终点,静置后如图读取KMnO4标准溶液的体积数值,则测定钙元素含量将_______ (填“偏高”“偏低”或“无影响”)。
④若实验测得数据如下表,蛋壳中含钙的质量分数为_______ (保留两位小数)。
(5)如果采用由碳酸钙直接转化为草酸钙进行测定,25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmol/L的草酸铵溶液20mL,若有草酸钙沉淀生成,则c的取值范围为_______ (草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9)。

回答下列问题。
(1)滤液I与草酸铵反应采用水浴加热的优点是
(2)为保证实验精确度,判断沉淀I是否洗涤干净的方法是
(3)向沉淀
 中加入
中加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为(4)用
 标准溶液滴定滤液III的过程中,
标准溶液滴定滤液III的过程中, (VII)被还原为
(VII)被还原为 (II),C(III)被氧化为
(II),C(III)被氧化为 。现将滤液III稀释至
。现将滤液III稀释至 ,再取其中的
,再取其中的 溶液,用
溶液,用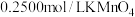 标准溶液滴定。
标准溶液滴定。①以上操作过程中一定需要下列哪些仪器:

②达到滴定终点时,溶液的颜色变化是
③滴定到终点,静置后如图读取KMnO4标准溶液的体积数值,则测定钙元素含量将

④若实验测得数据如下表,蛋壳中含钙的质量分数为
| 编号 | 1 | 2 | 3 |
| 蛋壳质量/g | 10.19 | 11.12 | 11.13 |
| KMnO4溶液/mL | 15.28 | 16.72 | 17.72 |
(5)如果采用由碳酸钙直接转化为草酸钙进行测定,25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmol/L的草酸铵溶液20mL,若有草酸钙沉淀生成,则c的取值范围为
您最近一年使用:0次
2023-11-26更新
|
213次组卷
|
5卷引用:化学(九省联考考后提升卷,甘肃卷)-2024年1月“九省联考”真题完全解读与考后提升
(已下线)化学(九省联考考后提升卷,甘肃卷)-2024年1月“九省联考”真题完全解读与考后提升河北省承德市双滦区实验中学2023-2024学年高三上学期一轮复习联考(三) 化学试题 (已下线)T27-实验综合题河北省沧州市泊头市第一中学2023-2024学年高二上学期12月月考化学试题(已下线)热点22 定量分析型实验综合题
名校
解题方法
10 . 某温度下,恒容密闭容器内发生反应:H2(g)+I2 g)  2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是
2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是
 2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是
2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是| A.混合气体颜色变深 | B.混合气体密度变大 |
| C.容器内压强变小 | D.氢气的体积分数变小 |
您最近一年使用:0次
2023-10-21更新
|
689次组卷
|
25卷引用:甘肃省兰州第一中学2022-2023学年高二上学期期末考试化学试题
甘肃省兰州第一中学2022-2023学年高二上学期期末考试化学试题北京市海淀区2020届高三上学期期末考试化学试题天津市河北区2020届高三年级“停课不停学”期间线上测试化学试题北京市海淀区2021~2022学年高二上学期期末化学试题(已下线)第04练 化学平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)安徽省舒城中学2021-2022学年高二下学期第一次月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期末检测化学试题吉林省汪清县汪清四中2021-2022学年高二上学期第一次阶段考试化学试题四川省南充市2021-2022学年高二下学期期末考试化学试题 陕西省咸阳市武功县2021--2022学年高二上学期质量调研化学试题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题湖北省宜昌英杰学校2022-2023学年高二上学期10月测试化学试题北京市第三十五中学2022-2023学年高二上学期10月月考化学试题天津市南开区2023届高三下学期质量监测 ( 二 ) 化学试题陕西省洛南中学2022-2023学年高二上学期10月月考化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)天津市第一中学2023-2024学年高二上学期10月月考化学试题北京市海淀区2023-2024学年高二上学期期中考试化学试题北京市和平街第一中学2023-2024学年高二上学期10月阶段性练习化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市第一六一中学2023-2024学年高二上学期10月月考化学试题安徽省合肥卓越中学2023-2024学年高二上学期期中考试化学试题北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题天津市南开中学2023-2024学年高三下学期第四次月考化学试卷

 )
)