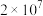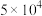名校
解题方法
1 . 铁被誉为“工业之母”,铁也是人体必须的痕量元素之一。
(1)基态Fe原子的核外电子中有_______ 对成对电子。其重要化合物 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为_______ ,其中Fe的配位数为_______ 。
(2)血红素(含 )是吡咯(
)是吡咯(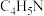 )的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:_______ ,请描述原因:_______ 。
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为。1mol吡咯分子中所含的σ键总数为_______ 个(设 为阿伏伽德罗常数的值)。分子中的大π键可用
为阿伏伽德罗常数的值)。分子中的大π键可用 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______ 。
③CO中毒是由于CO与血红蛋白(Hb)发生配位反应: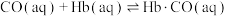 K。
K。
已知CO、 与血红素(Hb)的配位常数K如表所示。
与血红素(Hb)的配位常数K如表所示。
则反应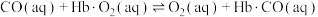 的平衡常数
的平衡常数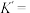
_______ 。
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。 ,B点原子的分数坐标为
,B点原子的分数坐标为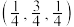 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_______ 。
②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的 ,则该晶体的化学式为
,则该晶体的化学式为_______ ,晶胞密度为_______  (列出计算式即可,设阿伏加德罗常数的值为
(列出计算式即可,设阿伏加德罗常数的值为 )。
)。
(1)基态Fe原子的核外电子中有
 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为(2)血红素(含
 )是吡咯(
)是吡咯(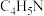 )的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图: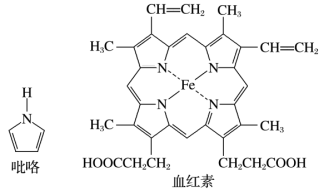
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为。1mol吡咯分子中所含的σ键总数为
 为阿伏伽德罗常数的值)。分子中的大π键可用
为阿伏伽德罗常数的值)。分子中的大π键可用 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为③CO中毒是由于CO与血红蛋白(Hb)发生配位反应:
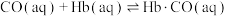 K。
K。已知CO、
 与血红素(Hb)的配位常数K如表所示。
与血红素(Hb)的配位常数K如表所示。CO |
| |
配位常数K |
|
|
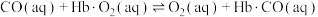 的平衡常数
的平衡常数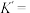
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。
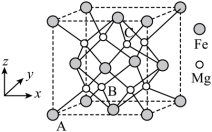
 ,B点原子的分数坐标为
,B点原子的分数坐标为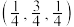 ,则C点原子的分数坐标为
,则C点原子的分数坐标为②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的
 ,则该晶体的化学式为
,则该晶体的化学式为 (列出计算式即可,设阿伏加德罗常数的值为
(列出计算式即可,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
2 . X为乙二胺,Y为乙二胺四乙酸(EDTA),均易与金属离子形成配合物。Z为乙二胺与 形成的配离子,W为EDTA阴离子与
形成的配离子,W为EDTA阴离子与 形成的整合物。下列叙述正确的是
形成的整合物。下列叙述正确的是
 形成的配离子,W为EDTA阴离子与
形成的配离子,W为EDTA阴离子与 形成的整合物。下列叙述正确的是
形成的整合物。下列叙述正确的是
| A.X和Y中均含有手性碳原子 | B.Z和W均带两个单位的正电荷 |
| C.Z和W中金属离子的配位数均为4 | D.Z和W中均含普通共价键和配位键 |
您最近一年使用:0次
名校
解题方法
3 . 一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。下列说法正确的是
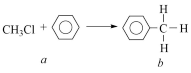
| A.该反应属于化合反应 | B.b的二氯代物有6种结构 |
| C.b分子中共平面的原子最多有8个 | D.C5H11Cl的结构有8种 |
您最近一年使用:0次
名校
4 . 二氯化二硫( )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。
(1)有关 的下列说法正确的是 。
的下列说法正确的是 。
(2)选用以下装置制取少量 (加热及夹持装置略):
(加热及夹持装置略):_____________________ 。
②装置连接顺序:A→__________ →D。
③B中玻璃纤维的作用是______________________ 。
④D中的最佳试剂是__________ (选填序号)。
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3) 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。_________ (填标号);
a. 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
 )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。(1)有关
 的下列说法正确的是 。
的下列说法正确的是 。A. 中S-Cl键的键能大于S-S键的键能 中S-Cl键的键能大于S-S键的键能 | B.固态时 属于原子晶体 属于原子晶体 |
| C.第一电离能、电负性均为:Cl>S | D. 中既有极性键又有非极性键 中既有极性键又有非极性键 |
(2)选用以下装置制取少量
 (加热及夹持装置略):
(加热及夹持装置略):
②装置连接顺序:A→
③B中玻璃纤维的作用是
④D中的最佳试剂是
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3)
 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
a.
 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
您最近一年使用:0次
名校
解题方法
5 . 下列表述中正确的有
③符合通式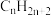 的不同烃一定互为同系物
的不同烃一定互为同系物
④石墨晶体中碳原子个数与碳碳键数之比为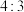
⑤可燃冰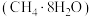 中甲烷与水分子间存在氢键
中甲烷与水分子间存在氢键
⑥最简式相同的两种有机物,可能既不互为同分异构体,也不互为同系物
⑦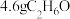 中含有的羟基数目一定为
中含有的羟基数目一定为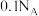
①蒸汽状态下以双聚分子存在的 的结构式为
的结构式为 ,其中
,其中 的配位数为4
的配位数为4
③符合通式
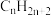 的不同烃一定互为同系物
的不同烃一定互为同系物④石墨晶体中碳原子个数与碳碳键数之比为
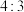
⑤可燃冰
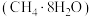 中甲烷与水分子间存在氢键
中甲烷与水分子间存在氢键⑥最简式相同的两种有机物,可能既不互为同分异构体,也不互为同系物
⑦
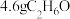 中含有的羟基数目一定为
中含有的羟基数目一定为
| A.2个 | B.3个 | C.4个 | D.5个 |
您最近一年使用:0次
6 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第___________ 周期第___________ 族,Co位于元素周期表___________ 区。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因___________ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是___________ 。
(4)已知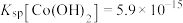 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为___________  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为___________ 。
(5)导致 比
比 易水解的因素有
易水解的因素有___________ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
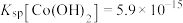 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
名校
解题方法
7 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题:
(1)基态Fe原子的价电子排布式为___________ 。橄榄石中,各元素电负性大小顺序为___________ ,铁的化合价为___________ 。
(2)已知一些物质的熔点数据如下表:
①Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是___________ 。
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因___________ 。
③SiCl4的空间结构为___________ ,其中Si的轨道杂化形式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,________ 个Mg,该物质化学式为_________ ,B-B最近距离为___________ 。
(1)基态Fe原子的价电子排布式为
(2)已知一些物质的熔点数据如下表:
| 物质 | NaCl | SiCl4 | GeCl4 | SnCl4 |
| 熔点/℃ | 800.7 | -68.8 | -51.5 | -34.1 |
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因
③SiCl4的空间结构为
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,
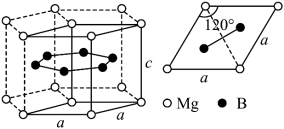
您最近一年使用:0次
名校
8 . 4-溴甲基肉桂酸甲酯是合成抗肿瘤药物帕比司他的重要中间体,其结构简式如图。关于该有机物的说法错误的是
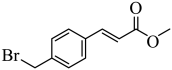
| A.能发生加成反应、氧化反应、聚合反应 |
| B.含有3种官能团 |
| C.其苯环上的二氯代物有四种(不考虑立体异构) |
| D.最多有18个原子共平面 |
您最近一年使用:0次
7日内更新
|
443次组卷
|
2卷引用:2024届四川省成都石室中学高三下学期5月高考适应性考试(一)理科综合试卷-高中化学
名校
9 . Ⅰ. 的有效利用可以缓解温室效应和能源短缺问题。我国科研人员在
的有效利用可以缓解温室效应和能源短缺问题。我国科研人员在 和
和 的表面将
的表面将 转化为烷烃,其过程如图所示:
转化为烷烃,其过程如图所示:
(2)写出 的所有同分异构体(不包括
的所有同分异构体(不包括 本身)的结构简式:
本身)的结构简式:______ 。
(3)下列关于 和
和 的说法正确的是______。
的说法正确的是______。
(4)在同温同压下,蒸气密度是 的15倍的气态烷烃
的15倍的气态烷烃 的结构简式为
的结构简式为______ 。 是分子中只有1个碳碳双键的烯烃与氢气加成的产物,则该烯烃可能有
是分子中只有1个碳碳双键的烯烃与氢气加成的产物,则该烯烃可能有______ 种结构;
(6)若 的一种同分异构体只能由一种炔烃加氢得到,且该炔烃是一个高度对称的结构,写出一种符合题意的
的一种同分异构体只能由一种炔烃加氢得到,且该炔烃是一个高度对称的结构,写出一种符合题意的 的同分异构体的系统命名
的同分异构体的系统命名______ 。
(7)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,十六烷烃发生反应: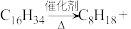 甲,甲
甲,甲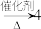 乙,则甲的分子式为
乙,则甲的分子式为______ 工业制乙烯的过程称为石油的______ 。
(8)甲烷是最简单的烷烃,四根C-H键完全相同,用一例事实证明其空间构型是正四面体而非平面正方形:______ 。
 的有效利用可以缓解温室效应和能源短缺问题。我国科研人员在
的有效利用可以缓解温室效应和能源短缺问题。我国科研人员在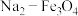 和
和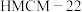 的表面将
的表面将 转化为烷烃,其过程如图所示:
转化为烷烃,其过程如图所示: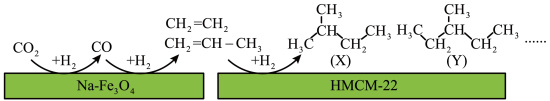
| A.烷烃中的碳原子均以共价单键与碳原子或氢原子相连 |
B.凡是化学式符合通式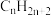 的烃一定是烷烃 的烃一定是烷烃 |
| C.甲烷、乙烷及丙烷均无同分异构体 |
| D.碳原子数相同的烷烃的同分异构体中,支链越多沸点越高 |
 的所有同分异构体(不包括
的所有同分异构体(不包括 本身)的结构简式:
本身)的结构简式:(3)下列关于
 和
和 的说法正确的是______。
的说法正确的是______。A.常温常压下, 为气体, 为气体, 为液体 为液体 | B.都有4种一氯代物 |
C.都能使酸性 溶液褪色 溶液褪色 | D.互为同分异构体 |
 的15倍的气态烷烃
的15倍的气态烷烃 的结构简式为
的结构简式为Ⅱ.有机物 的结构简式为
的结构简式为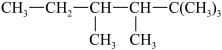
 是分子中只有1个碳碳双键的烯烃与氢气加成的产物,则该烯烃可能有
是分子中只有1个碳碳双键的烯烃与氢气加成的产物,则该烯烃可能有(6)若
 的一种同分异构体只能由一种炔烃加氢得到,且该炔烃是一个高度对称的结构,写出一种符合题意的
的一种同分异构体只能由一种炔烃加氢得到,且该炔烃是一个高度对称的结构,写出一种符合题意的 的同分异构体的系统命名
的同分异构体的系统命名(7)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,十六烷烃发生反应:
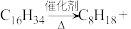 甲,甲
甲,甲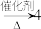 乙,则甲的分子式为
乙,则甲的分子式为(8)甲烷是最简单的烷烃,四根C-H键完全相同,用一例事实证明其空间构型是正四面体而非平面正方形:
您最近一年使用:0次
名校
解题方法
10 . 硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下, 回答下列问题:_______ 。
(2)Na2B4O7易溶于水,也易发生水解: (硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:
(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:_______ 。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式_______ 。加入MgO的目的是_______ 。
(4)已知MgSO4、CaSO4的溶解度(g/100g)如下表:
“操作A”是除去MgSO4和CaSO4混合溶液中的CaSO4,根据上表数据,简要说明“操作A”步骤为_______ 。
(5)NaBH4被称为有机化学中的“万能还原剂”,工业上可由硼砂制取,其晶胞结构及晶胞参数如图所示:_______ 。
②若选定A为坐标原点,则B的分数坐标为_______ 。
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为_______ g•cm-3(用含a、NA的式子表示)。

(2)Na2B4O7易溶于水,也易发生水解:
 (硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:
(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式
(4)已知MgSO4、CaSO4的溶解度(g/100g)如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)NaBH4被称为有机化学中的“万能还原剂”,工业上可由硼砂制取,其晶胞结构及晶胞参数如图所示:

②若选定A为坐标原点,则B的分数坐标为
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为
您最近一年使用:0次