名校
解题方法
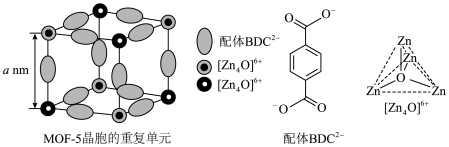
1 . 金属有机框架(MOFs)是一类由金属离子与有机配体通过配位键自组装形成的多孔晶体材料。MOF-5是其中最具代表性的材料之一、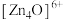 (如图)和有机配体
(如图)和有机配体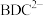 (如图)构成,其中与同一配体相连的两个
(如图)构成,其中与同一配体相连的两个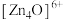 的取向不同。
的取向不同。
①Zn元素在周期表中的位置是第四周期第___________ 族。
②基态O原子的电子排布式为___________ 。
③比较C和O的电负性大小,并从原子结构角度说明理由:___________ 。
(2)MOF-5晶体内部的空腔可以吸附小分子。若要增强MOF-5与 之间的吸附作用,可在配体上引入
之间的吸附作用,可在配体上引入___________ 。(假设MOF-5晶胞形状不变)
A. B.
B. C.
C.
(3)MOF-5晶体属于立方晶系,其晶胞由8个结构相似的重复单元(如图)构成。
①每个重复单元中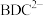 的个数为
的个数为___________ 。
②已知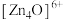 与
与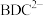 的摩尔质量分别为
的摩尔质量分别为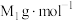 和
和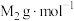 ,阿伏加德罗常数为
,阿伏加德罗常数为 。MOF-5晶体的密度为
。MOF-5晶体的密度为___________  。(
。(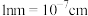 )
)
(4)除 外,下列也可以作为有机配体用于构成金属有机框架的是
外,下列也可以作为有机配体用于构成金属有机框架的是___________ 。
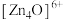 (如图)和有机配体
(如图)和有机配体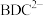 (如图)构成,其中与同一配体相连的两个
(如图)构成,其中与同一配体相连的两个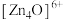 的取向不同。
的取向不同。①Zn元素在周期表中的位置是第四周期第
②基态O原子的电子排布式为
③比较C和O的电负性大小,并从原子结构角度说明理由:
(2)MOF-5晶体内部的空腔可以吸附小分子。若要增强MOF-5与
 之间的吸附作用,可在配体上引入
之间的吸附作用,可在配体上引入A.
 B.
B. C.
C.
(3)MOF-5晶体属于立方晶系,其晶胞由8个结构相似的重复单元(如图)构成。
①每个重复单元中
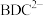 的个数为
的个数为②已知
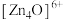 与
与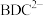 的摩尔质量分别为
的摩尔质量分别为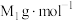 和
和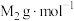 ,阿伏加德罗常数为
,阿伏加德罗常数为 。MOF-5晶体的密度为
。MOF-5晶体的密度为 。(
。(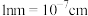 )
)(4)除
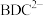 外,下列也可以作为有机配体用于构成金属有机框架的是
外,下列也可以作为有机配体用于构成金属有机框架的是A. 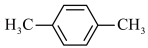 B.
B.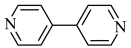 C.
C.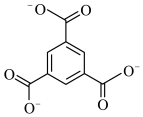
您最近一年使用:0次
名校
解题方法
2 . H、C、N、O、Na、Mg、Cl、Cu是8种中学化学中常见的元素。
(1)原子结构与元素性质
① 5种元素H、C、N、O、Na中,电负性最大的是___________ 。
② 3种元素Na、Mg、Cl中,原子半径最大的是___________ 。
③ 基态Cu的价电子排布式为___________ 。
(2)微粒间相互作用与物质性质
① 下列物质的分子中同时存在σ键和π键的是___________ (填字母)。
a.H2 b.N2 c.Cl2 d.NH3
② NH3分子与酸反应形成NH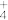 的原因是
的原因是___________ 。
③ 相同条件下,SO2在水中的溶解度大于CO2的,理由是___________ 。
(3)不同聚集状态的物质与性质___________ 。
②金属钠能导电的原因是___________ 。
③NaCl、NaBr、NaI中,熔点最高的是___________ 。
④ 金刚石和石墨是碳的两种常见单质,下列叙述正确的是___________ (填字母)。
a.金刚石和石墨都是共价晶体
b.晶体中共价键的键角:金刚石>石墨
c.金刚石中碳原子杂化类型为sp3杂化,石墨中碳原子杂化类型为sp2杂化
(1)原子结构与元素性质
① 5种元素H、C、N、O、Na中,电负性最大的是
② 3种元素Na、Mg、Cl中,原子半径最大的是
③ 基态Cu的价电子排布式为
(2)微粒间相互作用与物质性质
① 下列物质的分子中同时存在σ键和π键的是
a.H2 b.N2 c.Cl2 d.NH3
② NH3分子与酸反应形成NH
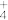 的原因是
的原因是③ 相同条件下,SO2在水中的溶解度大于CO2的,理由是
(3)不同聚集状态的物质与性质
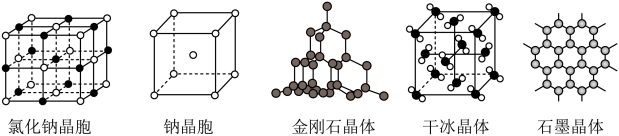
②金属钠能导电的原因是
③NaCl、NaBr、NaI中,熔点最高的是
④ 金刚石和石墨是碳的两种常见单质,下列叙述正确的是
a.金刚石和石墨都是共价晶体
b.晶体中共价键的键角:金刚石>石墨
c.金刚石中碳原子杂化类型为sp3杂化,石墨中碳原子杂化类型为sp2杂化
您最近一年使用:0次
名校
3 . KCN易溶于水,水溶液呈碱性,虽有剧毒,却因其较强的配位能力被广泛使用,如用于从低品位的金矿砂(含单质金)中提取金。
(1)基态N价层电子排布式为_______ 。
(2) 的所有原子均满足8电子稳定结构,其电子式为
的所有原子均满足8电子稳定结构,其电子式为_______ 。
(3) 中N为-3价,从结构与性质关系的角度解释其原因:
中N为-3价,从结构与性质关系的角度解释其原因:_______ 。
(4)下图为KCN的晶胞示意图。已知晶胞边长为anm,阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  。(已知:
。(已知: )
)
ⅰ.将金矿砂溶于pH为10.5~11的KCN溶液,过滤,得含 的滤液;
的滤液;
ⅱ.向滤液中加入足量金属锌,得单质金。
已知Au与Cu同族,则Au属于_______ 区元素。
②ⅰ中反应的离子方程式为_______ 。
铝和硅均处于第三周期金属与非金属的交界处。
(6)比较Al和Si的原子半径:Al_______ Si。
(7)硅的一种化合物 可发生水解反应,机理如下:
可发生水解反应,机理如下: 、②
、② 、③
、③ ,中间体
,中间体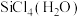 中Si采取的杂化类型为
中Si采取的杂化类型为_______ (填标号)。
(8)氯化铝常以二聚体的形式存在( )具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头
)具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头_______ 。
(1)基态N价层电子排布式为
(2)
 的所有原子均满足8电子稳定结构,其电子式为
的所有原子均满足8电子稳定结构,其电子式为(3)
 中N为-3价,从结构与性质关系的角度解释其原因:
中N为-3价,从结构与性质关系的角度解释其原因:(4)下图为KCN的晶胞示意图。已知晶胞边长为anm,阿伏加德罗常数的值为
 ,该晶体的密度为
,该晶体的密度为 。(已知:
。(已知: )
)
ⅰ.将金矿砂溶于pH为10.5~11的KCN溶液,过滤,得含
 的滤液;
的滤液;ⅱ.向滤液中加入足量金属锌,得单质金。
已知Au与Cu同族,则Au属于
②ⅰ中反应的离子方程式为
铝和硅均处于第三周期金属与非金属的交界处。
(6)比较Al和Si的原子半径:Al
(7)硅的一种化合物
 可发生水解反应,机理如下:
可发生水解反应,机理如下:
 、②
、② 、③
、③ ,中间体
,中间体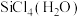 中Si采取的杂化类型为
中Si采取的杂化类型为(8)氯化铝常以二聚体的形式存在(
 )具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头
)具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头
您最近一年使用:0次
名校
4 . 药物“肉桂硫胺”的部分合成路线如图所示(部分反应条件已略去):___________ ,A→B的化学方程式是___________ 。
(2)有机物D中所含的官能团的名称是___________ 。
(3)B→D的化学反应类型是___________ 。
(4)下列关于A的说法正确的是___________ (填字母)。
a.能使酸性高锰酸钾溶液褪色
b.分子中所有原子位于同一平面
c.一氯代物有4种
(5)D→E的化学方程式是___________ 。
(6)有机物F为反式结构,其结构简式是___________ 。
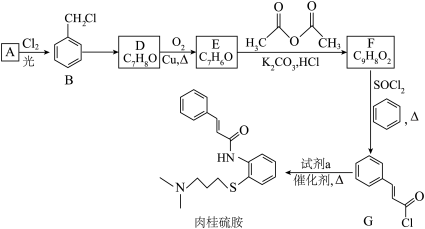
已知:
(2)有机物D中所含的官能团的名称是
(3)B→D的化学反应类型是
(4)下列关于A的说法正确的是
a.能使酸性高锰酸钾溶液褪色
b.分子中所有原子位于同一平面
c.一氯代物有4种
(5)D→E的化学方程式是
(6)有机物F为反式结构,其结构简式是
您最近一年使用:0次
5 . 下列说法不正确的是
| A.p轨道形状为哑铃形,有三种空间取向 |
| B.BF3是由极性共价键构成的极性分子 |
| C.金属良好的导电性与金属键有关 |
| D.NH4Cl中含有离子键、共价键和配位键 |
您最近一年使用:0次
名校
解题方法
6 . 我国科学家发现催化剂 可高效活化
可高效活化 ,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意图如下。
,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意图如下。___________ 。
(2)污染物X在电极a上的反应式是___________ 。
(3)科研团队研究了X分别为 、
、 和
和 [也可以写作
[也可以写作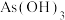 ]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
①基态As原子的价层电子排布式是___________ 。
② 中的键
中的键___________ (填“>”“<”或“=”) 中的键角。
中的键角。
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
 可高效活化
可高效活化 ,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意图如下。
,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意图如下。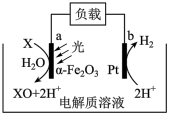
(2)污染物X在电极a上的反应式是
(3)科研团队研究了X分别为
 、
、 和
和 [也可以写作
[也可以写作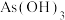 ]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
]的反应能力,发现中心原子含有孤电子对的物质易被氧化。①基态As原子的价层电子排布式是
②
 中的键
中的键 中的键角。
中的键角。③ 的结构是
的结构是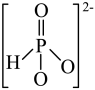 ,P原子的杂化轨道类型是
,P原子的杂化轨道类型是

 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是
您最近一年使用:0次
7 . 我校某同学为探究不同金属阳离子与碘离子的反应进行了如下实验:分别取2ml0.1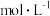 硫酸铜,氯化铁,硝酸银溶液于试管,各试管中分别滴加2ml0.1
硫酸铜,氯化铁,硝酸银溶液于试管,各试管中分别滴加2ml0.1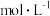 碘化钾溶液。
碘化钾溶液。
观察到现象如下:
硝酸银溶液中出现黄色沉淀,硫酸铜溶液中出现白色沉淀,溶液呈现棕黄色,氯化铁溶液中无沉淀生成,溶液呈棕红色。
为进一步探究产物,继续分别向三支试管中加入1ml四氯化碳,充分振荡后静止,
实验现象如下:
原硝酸银溶液的试管中溶液分层,下层为无色,原硫酸铜试管中溶液分层,下层为紫红色,原氯化铁溶液试管中溶液分层,下层为紫红色。
(1)请根据以上实验现象,依次写出硝酸银溶液,硫酸铜溶液,氯化铁溶液中滴加碘化钾的离子反应方程式:_______________ ,_________________ ,_______________ 。
资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。已知:I2易溶于KI溶液,发生反应I2+I-
 (红棕色);I2和
(红棕色);I2和 氧化性几乎相同。
氧化性几乎相同。
将等体积的KI溶液加入到m mol铜粉和nmol I2(n>m)的固体混合物中,振荡。实验记录如下:
①初始阶段,Cu被氧化的反应速率:实验I______ 实验Ⅱ(填“>”、“<”或“=”)。
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。
i.步骤a的目的是_______________ 。
ii.查阅资料,[Cu(NH3)2]+(无色)容易被空气氧化。
结合资料和前面同学所做实验中硫酸铜和碘化钾的反应方程式,用离子方程式释步骤b的溶液中发生的变化:______________ 。
③结合实验Ⅲ,推测实验I和Ⅱ中的白色沉淀可能是CuI,实验I中铜被氧化的化学方程式是____________ 。分别取实验I和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液,_____________ (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是___________ 。
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是________________ 。
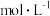 硫酸铜,氯化铁,硝酸银溶液于试管,各试管中分别滴加2ml0.1
硫酸铜,氯化铁,硝酸银溶液于试管,各试管中分别滴加2ml0.1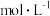 碘化钾溶液。
碘化钾溶液。观察到现象如下:
硝酸银溶液中出现黄色沉淀,硫酸铜溶液中出现白色沉淀,溶液呈现棕黄色,氯化铁溶液中无沉淀生成,溶液呈棕红色。
为进一步探究产物,继续分别向三支试管中加入1ml四氯化碳,充分振荡后静止,
实验现象如下:
原硝酸银溶液的试管中溶液分层,下层为无色,原硫酸铜试管中溶液分层,下层为紫红色,原氯化铁溶液试管中溶液分层,下层为紫红色。
(1)请根据以上实验现象,依次写出硝酸银溶液,硫酸铜溶液,氯化铁溶液中滴加碘化钾的离子反应方程式:
资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。已知:I2易溶于KI溶液,发生反应I2+I-

 (红棕色);I2和
(红棕色);I2和 氧化性几乎相同。
氧化性几乎相同。将等体积的KI溶液加入到m mol铜粉和nmol I2(n>m)的固体混合物中,振荡。实验记录如下:
c(KI) | 实验现象 | |
| 实验I | 0.01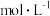 | 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色。 |
| 实验Ⅱ | 0.1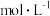 | 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色。 |
| 实验Ⅲ | 4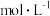 | I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色。 |
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。
i.步骤a的目的是
ii.查阅资料,[Cu(NH3)2]+(无色)容易被空气氧化。
结合资料和前面同学所做实验中硫酸铜和碘化钾的反应方程式,用离子方程式释步骤b的溶液中发生的变化:
③结合实验Ⅲ,推测实验I和Ⅱ中的白色沉淀可能是CuI,实验I中铜被氧化的化学方程式是
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是

您最近一年使用:0次
8 . 我国科学家从中国特有的喜树中分离得到具有肿瘤抑制作用的喜树碱,结构如图。不正确 的是

| A.能发生加成反应 |
| B.含有六种官能团 |
| C.羟基中O—H的极性强于乙基中C—H的极性 |
| D.带*的氮原子有孤电子对,能与含空轨道的H+以配位键结合 |
您最近一年使用:0次
名校
解题方法
9 . 胆矾(CuSO4·5H2O)的结构示意图如下所示。下列说法不正确 的是

A.基态Cu2+的价层电子轨道表示式是  |
| B.H2O中氧原子的VSEPR的价层电子对数是4 |
C.SO 中的O-S-O的键角小于H2O中的H-O-H的键角 中的O-S-O的键角小于H2O中的H-O-H的键角 |
D.胆矾中的H2O与Cu2+、H2O与SO 的作用力分别为配位键和氢键 的作用力分别为配位键和氢键 |
您最近一年使用:0次
名校
10 . 对烟气高效的脱硫、脱硝是防治空气污染的重要方式。
Ⅰ.尿素液相脱硫脱硝
(1)尿素[ ]中碳元素的化合价是
]中碳元素的化合价是___________ 。
(2)尿素溶液吸收烟气中的 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是___________ 。
(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是___________ 。
Ⅱ. 气相脱硫脱硝
气相脱硫脱硝
一定温度下,将模拟烟气通入气相氧化反应器中。NO和 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:
基元反应1:

基元反应2:
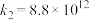
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:
基元反应3:
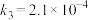
基元反应4:
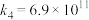
(4) 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是___________ 。
(5)将 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是___________ 。
(6)当体系中有水蒸气时, 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是___________ 。
Ⅰ.尿素液相脱硫脱硝
(1)尿素[
 ]中碳元素的化合价是
]中碳元素的化合价是(2)尿素溶液吸收烟气中的
 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若
 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是Ⅱ.
 气相脱硫脱硝
气相脱硫脱硝一定温度下,将模拟烟气通入气相氧化反应器中。NO和
 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。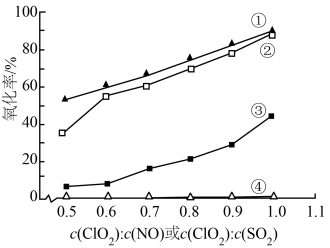
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:基元反应1:


基元反应2:

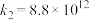
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:基元反应3:

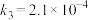
基元反应4:

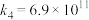
(4)
 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是(5)将
 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是(6)当体系中有水蒸气时,
 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
您最近一年使用:0次



