1 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、P、Ni、Fe、Mn等元素。回答下列问题:
(1)下列不同状态的硼中,用光谱仪可捕捉到发射光谱的是_______ 。(填标号)
(2)镍能形成多种配合物,其中Ni(CO)4是无色挥发性液体,K2[Ni(CN)4]是红黄色单斜晶体。K2[Ni(CN)4]的熔点高于Ni(CO)4的原因是_______ 。
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。_______ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为_______ 。
(4)FeSO4•7H2O的结构如图所示,FeSO4•7H2O中∠1、∠2、∠3由大到小的顺序是_______ 。_______ 。
②该锰的硅化物的化学式为_______ 。
(1)下列不同状态的硼中,用光谱仪可捕捉到发射光谱的是
A. |
B. |
C. |
D. |
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
(4)FeSO4•7H2O的结构如图所示,FeSO4•7H2O中∠1、∠2、∠3由大到小的顺序是


②该锰的硅化物的化学式为
您最近一年使用:0次
名校
解题方法
2 . 钴广泛应用于机械制造、电子电器、航空航天、电池制造等行业,是国家重要的战略资源。用含钴废料(主要成分为 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题:
① 具有强氧化性。
具有强氧化性。
② ,
, 。
。
(1)为提高含钴废料的浸出效率,可采取的措施是___________ (任写一条)。
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ ;浸出渣的主要成分为___________ (填化学式)。
(3)向“浸出液”中加入适量的 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)①“除钙镁”后,滤液中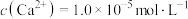 时,
时,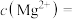
___________  。
。
②若“调pH”时溶液的pH偏低,将会导致 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是___________ 。
(5)将 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: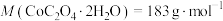 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物] ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为___________ 。
 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题: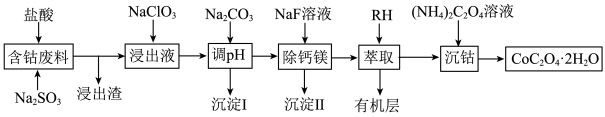
①
 具有强氧化性。
具有强氧化性。②
 ,
, 。
。(1)为提高含钴废料的浸出效率,可采取的措施是
(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)向“浸出液”中加入适量的
 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为(4)①“除钙镁”后,滤液中
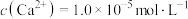 时,
时,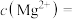
 。
。②若“调pH”时溶液的pH偏低,将会导致
 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是(5)将
 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: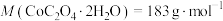 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物]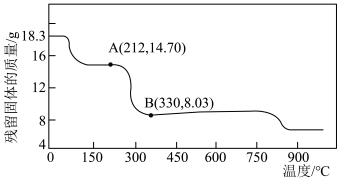
 ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为
您最近一年使用:0次
7日内更新
|
208次组卷
|
5卷引用:2024届青海省西宁市大通县高三下学期高考四模理科综合试卷-高中化学
名校
解题方法
3 . 自由基因为化学性质不稳定往往不能稳定存在,羟基自由基(·OH)有极强的氧化性,其氧化性仅次于氟单质。我国科学家设计的一种能将苯酚( )氧化为
)氧化为 和
和 的原电池—电解池组合装置如图所示,该装置能实现发电、环保二位一体。下列说法错误的是
的原电池—电解池组合装置如图所示,该装置能实现发电、环保二位一体。下列说法错误的是
 )氧化为
)氧化为 和
和 的原电池—电解池组合装置如图所示,该装置能实现发电、环保二位一体。下列说法错误的是
的原电池—电解池组合装置如图所示,该装置能实现发电、环保二位一体。下列说法错误的是
| A.该装置工作时,电流方向为电极b→Ⅲ室→Ⅱ室→Ⅰ室→电极a |
B.当电极a上有1mol  生成时,c极区溶液仍为中性 生成时,c极区溶液仍为中性 |
C.电极d的电极反应为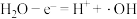 |
D.当电极b上有0.3mol  生成时,电极c、d两极共产生气体11.2L(标准状况) 生成时,电极c、d两极共产生气体11.2L(标准状况) |
您最近一年使用:0次
2024-03-22更新
|
720次组卷
|
7卷引用:2024届青海省百所名校高三下学期二模理科综合试题-高中化学
2024届青海省百所名校高三下学期二模理科综合试题-高中化学河南省新乡市2024届高三第二次模拟考试理综-化学试题吉林省部分名校2023-2024学年高二下学期期中联考化学试题湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题(已下线)压轴题06?电化学原理综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)【名校联盟】南充高中高2021级高三第十三次月考理科综合物化生(附答案)-高中化学四川省达州外国语学校2023-2024学年高二下学期期中考试化学试题
4 . 由A(C2H2)和E(C7H6O)制备聚乙烯醇缩苯丙醛(M)的合成路线如图所示: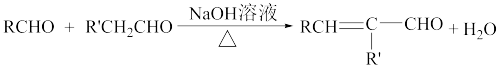 (R、R′代表氢原子或烃基)。
(R、R′代表氢原子或烃基)。
回答下列问题:
(1)反应①②的反应类型分别是___________ 、___________ 。
(2)E的化学名称是___________ ,F中官能团名称是___________ 。
(3)H的结构简式是___________ ;反应③的化学方程式是___________ 。
(4)写出一种满足下列条件的B的同分异构体的结构简式:___________ 。
①有3种氢原子;②能发生银镜反应与水解反应。
(5)参照上述合成路线和信息,写出以乙醇为原料合成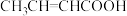 的合成路线:
的合成路线:___________ (无机试剂任选)。
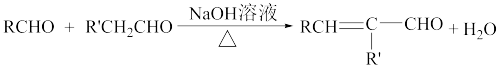 (R、R′代表氢原子或烃基)。
(R、R′代表氢原子或烃基)。回答下列问题:
(1)反应①②的反应类型分别是
(2)E的化学名称是
(3)H的结构简式是
(4)写出一种满足下列条件的B的同分异构体的结构简式:
①有3种氢原子;②能发生银镜反应与水解反应。
(5)参照上述合成路线和信息,写出以乙醇为原料合成
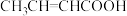 的合成路线:
的合成路线:
您最近一年使用:0次
2023-07-05更新
|
55次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2022-2023学年高二下学期期末考试化学试题
名校
5 . H2S的转化是资源利用和环境保护的重要研究课题。回答下列问题:
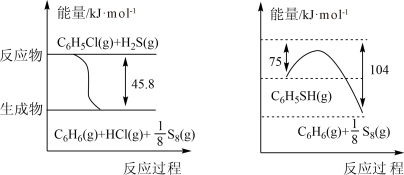
(1)苯硫酚(C6H5SH)是一种重要的有机合成中间体,工业上常用氯苯(C6H5Cl)和硫化氢(H2S)来制备苯硫酚。已知下列两个反应的能量关系如图所示,则C6H5Cl与H2S反应生成C6H5SH的热化学方程式为_______ 。
(2)H2S与CO2在高温下反应制得的羰基硫(COS)可用于合成除草剂。在610K时,将0.40molH2S与0.10molCO2充入2.5L的空钢瓶中,发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)ΔH=+35kJ/mol,反应达平衡后水蒸气的物质的量分数为0.02。
①在610K时,反应经2min达到平衡,则0~2min的平均反应速率v(H2S)=_______ 。
②实验测得上述反应的速率方程为:v正=k正·c(H2S)·c(CO2),v逆=k逆·c(COS)·c(H2O),k正、k逆分别为正、逆反应速率常数,速率常数k随温度升高而增大。则达到平衡后,仅升高温度,k正增大的倍数_______ (填“>”“<”或“=”)k逆增大的倍数。
③该条件下,容器中反应达到化学平衡状态的依据是_______ (填字母)。
A.容器内混合气体密度不再变化 B.v正(H2S)=v逆(COS)
C.容器内的压强不再变化 D.H2S与CO2的质量之比不变
(3)工业上可以通过硫化氢分解制得H2和硫蒸气。在密闭容器中充入一定量H2S气体,反应原理:2H2S(g)⇌2H2(g)+S2(g),H2S气体的平衡转化率与温度、压强的关系如图所示。
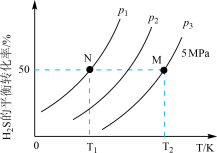
①图中压强(P1、P2、P3)的大小顺序为_______ ,理由是_______ 。
②如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有_______ 。
③在温度T2、P3=5MPa条件下,该反应的平衡常数Kp=_______ MPa(已知:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)苯硫酚(C6H5SH)是一种重要的有机合成中间体,工业上常用氯苯(C6H5Cl)和硫化氢(H2S)来制备苯硫酚。已知下列两个反应的能量关系如图所示,则C6H5Cl与H2S反应生成C6H5SH的热化学方程式为

(2)H2S与CO2在高温下反应制得的羰基硫(COS)可用于合成除草剂。在610K时,将0.40molH2S与0.10molCO2充入2.5L的空钢瓶中,发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)ΔH=+35kJ/mol,反应达平衡后水蒸气的物质的量分数为0.02。
①在610K时,反应经2min达到平衡,则0~2min的平均反应速率v(H2S)=
②实验测得上述反应的速率方程为:v正=k正·c(H2S)·c(CO2),v逆=k逆·c(COS)·c(H2O),k正、k逆分别为正、逆反应速率常数,速率常数k随温度升高而增大。则达到平衡后,仅升高温度,k正增大的倍数
③该条件下,容器中反应达到化学平衡状态的依据是
A.容器内混合气体密度不再变化 B.v正(H2S)=v逆(COS)
C.容器内的压强不再变化 D.H2S与CO2的质量之比不变
(3)工业上可以通过硫化氢分解制得H2和硫蒸气。在密闭容器中充入一定量H2S气体,反应原理:2H2S(g)⇌2H2(g)+S2(g),H2S气体的平衡转化率与温度、压强的关系如图所示。

①图中压强(P1、P2、P3)的大小顺序为
②如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有
③在温度T2、P3=5MPa条件下,该反应的平衡常数Kp=
您最近一年使用:0次
2023-06-19更新
|
342次组卷
|
4卷引用:青海省西宁市大通回族土族自治县2023-2024学年高三上学期期中考试理综试题
名校
解题方法
6 . 布洛芬(图丁)是一种非甾体抗炎药,下面是其一条高产率的合成路线。下列说法正确的是
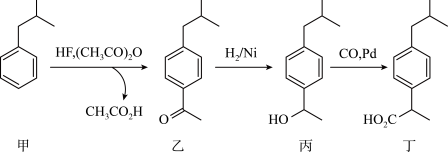

| A.甲中最多有8个碳原子共平面 | B.乙转化为丙为加成反应或还原反应 |
| C.与丙有相同官能团的同分异构体只有6种 | D.丁与乙酸互为同系物 |
您最近一年使用:0次
2023-01-13更新
|
3430次组卷
|
10卷引用:青海省西宁市2023届高三下学期复习检测(二)理科综合化学试题
青海省西宁市2023届高三下学期复习检测(二)理科综合化学试题四川省成都市2023届高三第一次诊断性检测理科综合化学试题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(选择题6-10)(已下线)【知识图鉴】单元讲练测选择性必修3第2单元03巩固练江西省上饶市2023届高三第一次高考模拟考试理综化学试题湖南省永州市第一中学2022-2023学年高三下学期3月月考化学试题(已下线)专题09 有机化学基础(已下线)素养卷06 微型有机合成路线分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)江西省九江市德安县第一中学2022-2023学年高二下学期5月期中考试化学试题2023届宁夏石嘴山市第三中学高三一模考试理科综合试题
名校
解题方法
7 . 向1000 mL某稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出11.2 L(标准状况下)NO气体,同时溶液质量增加18.6 g。下列判断正确的是
| A.反应后的溶液中还可溶解19.2 g Fe |
B.原稀硝酸的物质的量浓度为2.0  |
| C.原溶液中投入铁粉的物质的量是0.5 mol |
D.反应后的溶液中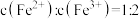 |
您最近一年使用:0次
2021-11-16更新
|
968次组卷
|
6卷引用:青海省西宁市大通回族土族自治县2021-2022学年高三上学期期中考试化学试题
青海省西宁市大通回族土族自治县2021-2022学年高三上学期期中考试化学试题河北省石家庄市第二中学2021-2022学年高一下学期3月月考化学试题河北省保定市部分重点高中2021-2022学年高一下学期期中联考化学试题黑龙江省双鸭山市第一中学2022-2023学年高一下学期4月月考化学试题黑龙江省哈尔滨市第三中学校2023-2024学年高一下学期寒假验收考试 化学试卷(已下线)第04讲 氧化还原反应的基本概念和规律(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
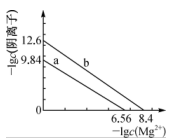
8 .  、
、 都是造成水体污染的因素,可以利用沉淀法除去.如图a、b分别是
都是造成水体污染的因素,可以利用沉淀法除去.如图a、b分别是 、
、 的沉淀溶解平衡曲线。下列说法错误的是
的沉淀溶解平衡曲线。下列说法错误的是
 、
、 都是造成水体污染的因素,可以利用沉淀法除去.如图a、b分别是
都是造成水体污染的因素,可以利用沉淀法除去.如图a、b分别是 、
、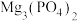 的沉淀溶解平衡曲线。下列说法错误的是
的沉淀溶解平衡曲线。下列说法错误的是
A. |
B.向浓度相等的 、 、 的废水中同时滴加相同浓度的 的废水中同时滴加相同浓度的 溶液, 溶液, 先沉淀 先沉淀 |
C.要使废水中 、 、 离子浓度不大于 离子浓度不大于 ,则 ,则 浓度至少为 浓度至少为 |
D.若 成立,则平衡常数 成立,则平衡常数 |
您最近一年使用:0次
2021-09-24更新
|
766次组卷
|
7卷引用:青海省西宁市大通回族土族自治县2022届高三开学摸底考试化学试题
青海省西宁市大通回族土族自治县2022届高三开学摸底考试化学试题(已下线)章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)安徽省六安市第一中学2021-2022学年高二下学期开学考试化学试题江西省丰城市第九中学2021-2022学年高三上学期第一次月考(日新部)化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第三次月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第53练 沉淀溶解平衡图像的分析重庆市万州第二高级中学2023届高三下学期第四次质量检测化学试题
10-11高二上·湖南·阶段练习
名校
解题方法
9 . 已知 溶液呈酸性,
溶液呈酸性, 溶液呈碱性。对于浓度均为
溶液呈碱性。对于浓度均为 的
的 溶液和
溶液和 溶液,溶液中各微粒的物质的量浓度关系正确的是(R表示S或C)
溶液,溶液中各微粒的物质的量浓度关系正确的是(R表示S或C)
 溶液呈酸性,
溶液呈酸性, 溶液呈碱性。对于浓度均为
溶液呈碱性。对于浓度均为 的
的 溶液和
溶液和 溶液,溶液中各微粒的物质的量浓度关系正确的是(R表示S或C)
溶液,溶液中各微粒的物质的量浓度关系正确的是(R表示S或C)A.两溶液中均有 |
B.两溶液中均有c(Na+)+c(H+)═c(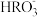 )+c( )+c(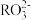 )+c(OH−) )+c(OH−) |
C.两溶液中均有c(H+)+c(H2RO3)=c(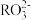 )+c(OH-) )+c(OH-) |
D.两溶液中c(Na+)、c(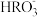 )、 )、 分别对应相等 分别对应相等 |
您最近一年使用:0次
2021-08-01更新
|
1275次组卷
|
17卷引用:青海省西宁市第十四中学2019-2020学年高二上学期期末考试化学试题
青海省西宁市第十四中学2019-2020学年高二上学期期末考试化学试题(已下线)2010年海南省嘉积中学高二上学期第二次月考化学试卷(已下线)2010—2011学年浙江省温州市十校联合高二下学期期末联考化学试卷(已下线)2012届浙江省五校高三第一次联考化学试卷(已下线)2012-2013学年陕西省汉中市中学高三上学期模拟考试化学试卷2016-2017学年陕西西安一中高二上月考二化学卷陕西省西安市长安区第一中学2017-2018学年高二上学期期末考试化学(理)试题(已下线)解密12 盐类的水解——备战2018年高考化学之高频考点解密鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时3 溶液中粒子浓度的大小关系鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 易错疑难集训(二)人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 易错疑难集训(三)选择性必修1(SJ)专题3易错疑难集训(二)(已下线)课时43 粒子浓度大小比较-2022年高考化学一轮复习小题多维练(全国通用)(已下线)必考点07 盐类的水解-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)3.3.1 盐溶液的酸碱性及其原因(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)辽宁省沈阳市东北育才学校2022-2023学年高三高考适应性测试(二)化学试题
名校
解题方法
10 .  、
、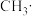 、
、 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是
 、
、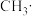 、
、 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是A.碳原子均采取sp2杂化,且 中所有原子均共面 中所有原子均共面 |
B.CH 与NH3、H3O+互为等电子体,几何构型均为三角锥形 与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
C. 与OH-形成离子化合物 与OH-形成离子化合物 |
D.两个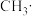 或一个 或一个 和一个 和一个 结合可得到不同化合物 结合可得到不同化合物 |
您最近一年使用:0次
2021-03-18更新
|
1782次组卷
|
8卷引用:青海省湟川中学2019-2020学年高二下学期期中考试化学试题



