名校
解题方法
1 . 钴广泛应用于机械制造、电子电器、航空航天、电池制造等行业,是国家重要的战略资源。用含钴废料(主要成分为 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题:
① 具有强氧化性。
具有强氧化性。
② ,
, 。
。
(1)为提高含钴废料的浸出效率,可采取的措施是___________ (任写一条)。
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ ;浸出渣的主要成分为___________ (填化学式)。
(3)向“浸出液”中加入适量的 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)①“除钙镁”后,滤液中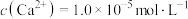 时,
时,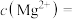
___________  。
。
②若“调pH”时溶液的pH偏低,将会导致 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是___________ 。
(5)将 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: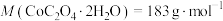 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物] ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为___________ 。
 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题: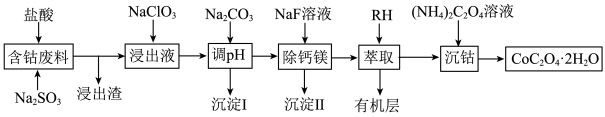
①
 具有强氧化性。
具有强氧化性。②
 ,
, 。
。(1)为提高含钴废料的浸出效率,可采取的措施是
(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)向“浸出液”中加入适量的
 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为(4)①“除钙镁”后,滤液中
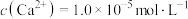 时,
时,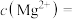
 。
。②若“调pH”时溶液的pH偏低,将会导致
 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是(5)将
 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: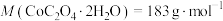 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物]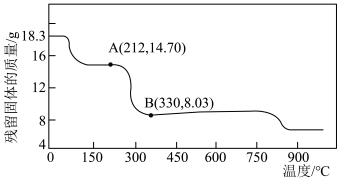
 ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为
您最近一年使用:0次
7日内更新
|
207次组卷
|
5卷引用:2024届内蒙古自治区名校联盟高三下学期联合质量检测(三模)理科综合试题-高中化学
名校
解题方法
2 . 氮化锂是一种快离子导体,其电导率比其他无机锂盐都高,用于制造性能优越的全固态电池。某兴趣小组利用下列装置制备少量氮化锂,请回答下列问题: 和
和 ,约
,约 时
时 与
与 反应生成
反应生成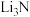 。
。
②氮化锂遇水剧烈反应,在空气中加热能剧烈燃烧。
(1)装置A的名称为___________ ;装置C的作用为___________ 。
(2)装置D中加入药品之前需要进行的操作是___________ 。
(3)按照气流的方向,装置的连接顺序为d接__,__接__,__接__,__接c;________ (填接口小写字母)。
(4)装置E中发生反应的化学方程式为___________ 。
(5)装置F的作用为___________ 。
(6)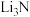 的电子式为
的电子式为_______________ ;
实验测得装置B反应前后的质量如表所示:
则生成氮化锂的质量为_______________ g。

 和
和 ,约
,约 时
时 与
与 反应生成
反应生成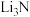 。
。②氮化锂遇水剧烈反应,在空气中加热能剧烈燃烧。
(1)装置A的名称为
(2)装置D中加入药品之前需要进行的操作是
(3)按照气流的方向,装置的连接顺序为d接__,__接__,__接__,__接c;
(4)装置E中发生反应的化学方程式为
(5)装置F的作用为
(6)
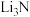 的电子式为
的电子式为实验测得装置B反应前后的质量如表所示:
| 反应前 | 反应后 | |
| 装置B的质量/g | 19.2 | 28.3 |
您最近一年使用:0次
名校
3 . 硫铁矿(含 )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
(1)硫铁矿 中
中 元素的化合价为
元素的化合价为_______________ 。
(2)为了使反应Ⅰ燃烧得更充分,可以采用的措施是_______________ 。(任写一条)
(3)将 通入新制碘水中,发现溶液褪色,发生反应的离子方程式为
通入新制碘水中,发现溶液褪色,发生反应的离子方程式为_______________ 。
(4)下列关于 的说法不正确的是_______________。
的说法不正确的是_______________。
(5)工业上为了防止污染,可以利用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,该过程如图所示: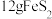 ,转移的电子的物质的量为
,转移的电子的物质的量为_______________ 。
②脱硫过程中产生的 在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式
在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式_______________ 。
③在 和
和 的混合液中,可用于检验
的混合液中,可用于检验 的试剂是
的试剂是_______________ 。
a.酸性高锰酸钾溶液 b.硫氰化钾溶液
c.先加入硫氰化钾溶液,再加入过氧化氢 d.氢氧化钠溶液
 )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
(1)硫铁矿
 中
中 元素的化合价为
元素的化合价为(2)为了使反应Ⅰ燃烧得更充分,可以采用的措施是
(3)将
 通入新制碘水中,发现溶液褪色,发生反应的离子方程式为
通入新制碘水中,发现溶液褪色,发生反应的离子方程式为(4)下列关于
 的说法不正确的是_______________。
的说法不正确的是_______________。| A.浓硫酸有强氧化性,稀硫酸没有氧化性 |
| B.常温下,浓硫酸与铁不反应,故可用铁罐车储运浓硫酸 |
C.浓硫酸具有吸水性,可用于干燥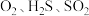 等气体 等气体 |
| D.蔗糖中滴入浓硫酸,可观察到蔗糖由白变黑、体积膨胀并有刺激性气味气体产生,该过程中浓硫酸体现了脱水性和强氧化性 |
(5)工业上为了防止污染,可以利用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,该过程如图所示:
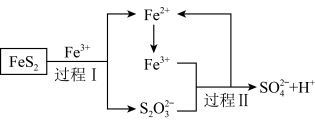
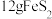 ,转移的电子的物质的量为
,转移的电子的物质的量为②脱硫过程中产生的
 在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式
在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式③在
 和
和 的混合液中,可用于检验
的混合液中,可用于检验 的试剂是
的试剂是a.酸性高锰酸钾溶液 b.硫氰化钾溶液
c.先加入硫氰化钾溶液,再加入过氧化氢 d.氢氧化钠溶液
您最近一年使用:0次
名校
4 . 乙炔是一种重要的化工原料中间体,可以合成众多的化工产品。根据下列流程图,回答问题
(1)写出实验室制备A化学方程式_______ ;为除去 中的杂质,需将气体通入装有
中的杂质,需将气体通入装有_______ (填化学式)溶液的洗气瓶。
(2)化合物 能发生加聚反应,写出其中按1,4加聚反应的化学方程式
能发生加聚反应,写出其中按1,4加聚反应的化学方程式_______ 。
(3)③的反应类型为_______ 反应。
(4) 的结构简式为
的结构简式为_______ ,F的同分异构体中除 外含六元环的还有
外含六元环的还有_______ 种。
(5)已知有一样品 为
为 ,在足量
,在足量 中充分燃烧,将生成的混合气体依次通过无水
中充分燃烧,将生成的混合气体依次通过无水 和碱石灰,分别增重
和碱石灰,分别增重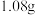 和
和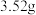 。质谱测得该有机物的相对分子量为118,其分子式为
。质谱测得该有机物的相对分子量为118,其分子式为_______ 。
(6)有机物 是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等。由元素分析可知,有机物
是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等。由元素分析可知,有机物 的分子式为
的分子式为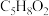 ,经红外光谱测定,有机物
,经红外光谱测定,有机物 中含有醛基;有机物
中含有醛基;有机物 的核磁共振氢谱图上有2组吸收峰,峰面积之比为
的核磁共振氢谱图上有2组吸收峰,峰面积之比为 。由此,可以推断有机物
。由此,可以推断有机物 的结构简式为
的结构简式为_______ 。
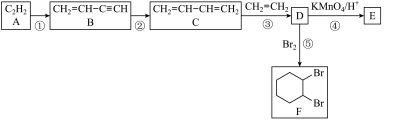
已知:①

(1)写出实验室制备A化学方程式
 中的杂质,需将气体通入装有
中的杂质,需将气体通入装有(2)化合物
 能发生加聚反应,写出其中按1,4加聚反应的化学方程式
能发生加聚反应,写出其中按1,4加聚反应的化学方程式(3)③的反应类型为
(4)
 的结构简式为
的结构简式为 外含六元环的还有
外含六元环的还有(5)已知有一样品
 为
为 ,在足量
,在足量 中充分燃烧,将生成的混合气体依次通过无水
中充分燃烧,将生成的混合气体依次通过无水 和碱石灰,分别增重
和碱石灰,分别增重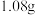 和
和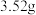 。质谱测得该有机物的相对分子量为118,其分子式为
。质谱测得该有机物的相对分子量为118,其分子式为(6)有机物
 是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等。由元素分析可知,有机物
是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等。由元素分析可知,有机物 的分子式为
的分子式为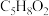 ,经红外光谱测定,有机物
,经红外光谱测定,有机物 中含有醛基;有机物
中含有醛基;有机物 的核磁共振氢谱图上有2组吸收峰,峰面积之比为
的核磁共振氢谱图上有2组吸收峰,峰面积之比为 。由此,可以推断有机物
。由此,可以推断有机物 的结构简式为
的结构简式为
您最近一年使用:0次
解题方法
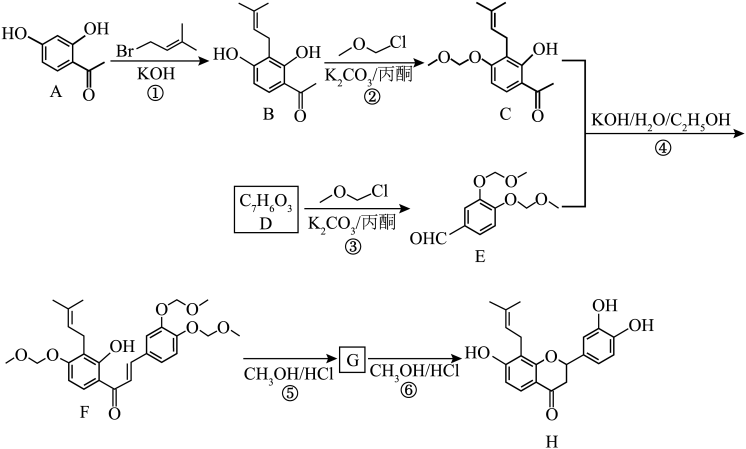
5 . 黄烷酮作为一类重要的天然物质,其大部分具有广泛的生理和药理活性。其中一种新型的黄烷酮类 化合物(H)的合成路线如下图所示。
(1)A→B 的反应类型为___________ 。
(2)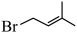 中官能团名称为
中官能团名称为___________ 。
(3)步骤②③的作用为___________ 。
(4)B→C 的反应中B 的 2 位羟基未被取代的原因是___________ 。
(5)步骤④⑤⑥的产率分别为 89%、79%、54%,则从 C、E 到 H 的产率为___________ (保留 1 位小数)。
(6)D 的结构简式为___________ 。
(7)已知 G 和 H 互为同分异构体,且结构内含有两个六元环,则 G 的结构简式为___________ 。
(8) 有多种同分异构体,同时满足下列条件的同分异构体有
有多种同分异构体,同时满足下列条件的同分异构体有___________ 种(不考虑立体异构)。
①苯环上有2 个取代基;
②能够发生银镜反应;
③与FeCl3 溶液发生显色发应。
(1)A→B 的反应类型为
(2)
 中官能团名称为
中官能团名称为(3)步骤②③的作用为
(4)B→C 的反应中B 的 2 位羟基未被取代的原因是
(5)步骤④⑤⑥的产率分别为 89%、79%、54%,则从 C、E 到 H 的产率为
(6)D 的结构简式为
(7)已知 G 和 H 互为同分异构体,且结构内含有两个六元环,则 G 的结构简式为
(8)
 有多种同分异构体,同时满足下列条件的同分异构体有
有多种同分异构体,同时满足下列条件的同分异构体有①苯环上有2 个取代基;
②能够发生银镜反应;
③与FeCl3 溶液发生显色发应。
您最近一年使用:0次
23-24高三下·陕西西安·阶段练习
6 . 醋酸亚铜(CH3COOCu)为透明叶状晶体,难溶于乙醚,遇空气易水解或被氧化,可由氧化亚铜与醋酸酐的冰醋酸溶液在索氏提取器中制得。实验室利用Cu2O制备醋酸亚铜的装置如图所示(加热和夹持装置省略)。
已知:醋酸酐可吸水生成醋酸。
回答下列问题:
(1)仪器c的名称是_______ ,仪器d中的试剂和作用分别是_______ 。
(2)在氢气的氛围下,Cu2O和冰醋酸反应逐渐转化为醋酸亚铜,该过程中发生反应的化学方程式为_______ 。制备过程中醋酸酐的作用是_______ 。
(3)制备过程中不可选用明火直接加热,原因是_______ 。
(4)冷却三颈烧瓶中的提取液,有白色醋酸亚铜析出,经抽滤、无水乙醚迅速洗涤、_______ ,最终得到醋酸亚铜固体。
(5)产品纯度的测定:准确称取醋酸亚铜产品mg,迅速溶于过量的FeCl3溶液中得到V1mL待测液,从中量取V2mL溶液于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用amol·L-1硫酸铈[Ce(SO4)2]标准溶液滴定至终点,消耗Ce(SO4)2标准溶液bmL(已知: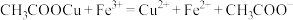 ,
, )。
)。
①产品中CH3COOCu的质量分数为_______ %(用代数式表示)。
②下列有关滴定的说法错误的是_______ (填标号)。
A.未用标准溶液润洗滴定管会使测定结果偏低
B.滴定时要适当控制滴定速度
C.在接近滴定终点时,使用“半滴操作”可提高滴定的准确度
D.滴定前滴定管尖嘴部分有气泡,滴定后无气泡,会使测定结果偏低
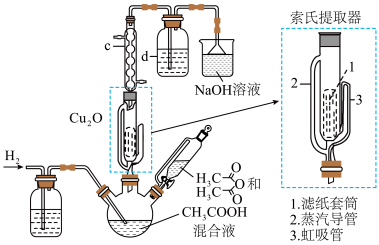
已知:醋酸酐可吸水生成醋酸。
回答下列问题:
(1)仪器c的名称是
(2)在氢气的氛围下,Cu2O和冰醋酸反应逐渐转化为醋酸亚铜,该过程中发生反应的化学方程式为
(3)制备过程中不可选用明火直接加热,原因是
(4)冷却三颈烧瓶中的提取液,有白色醋酸亚铜析出,经抽滤、无水乙醚迅速洗涤、
(5)产品纯度的测定:准确称取醋酸亚铜产品mg,迅速溶于过量的FeCl3溶液中得到V1mL待测液,从中量取V2mL溶液于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用amol·L-1硫酸铈[Ce(SO4)2]标准溶液滴定至终点,消耗Ce(SO4)2标准溶液bmL(已知:
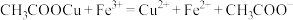 ,
, )。
)。①产品中CH3COOCu的质量分数为
②下列有关滴定的说法错误的是
A.未用标准溶液润洗滴定管会使测定结果偏低
B.滴定时要适当控制滴定速度
C.在接近滴定终点时,使用“半滴操作”可提高滴定的准确度
D.滴定前滴定管尖嘴部分有气泡,滴定后无气泡,会使测定结果偏低
您最近一年使用:0次
名校
解题方法
7 . 能源的合理开发和利用,低碳减排是人类正在努力解决的大问题。2023年2月21日,中国气候变化特使谢振华获得首届诺贝尔可持续发展特别贡献奖,以表彰他在全球生态保护中做出的贡献。
I.在 、
、 时,已知:
时,已知:
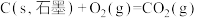
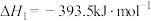 ;
;
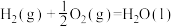
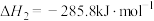 ;
;

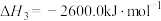
 时写出
时写出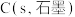 和
和 反应生成
反应生成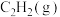 的热化学方程式:_______。
的热化学方程式:_______。
II.向密闭容器中充入一定量的 和
和 ,保持总压为
,保持总压为 ,发生反应:
,发生反应: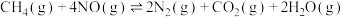
 。
。
(1)能表示此反应已经达到平衡的是_______(填字母)。
(2)当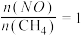 时,
时, 的平衡转化率
的平衡转化率 ;
; 时
时 平衡转化率
平衡转化率 的关系如图:
的关系如图:
_______  (填“>”或“<”)
(填“>”或“<”)
②表示当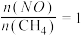 时,
时, 的平衡转化率
的平衡转化率 的关系是
的关系是_______ (填“I”或“II”),根据所选曲线写出判断依据_______ 。
③当 、
、 时,反应达平衡时,
时,反应达平衡时, 的分压为
的分压为_______ ,此温度下该反应的分压平衡常数
_______ (保留2位有效数字)(分压=总压×物质的量分数)。
I.在
 、
、 时,已知:
时,已知: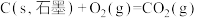
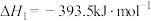 ;
;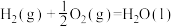
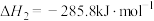 ;
;
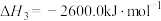
 时写出
时写出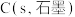 和
和 反应生成
反应生成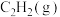 的热化学方程式:_______。
的热化学方程式:_______。II.向密闭容器中充入一定量的
 和
和 ,保持总压为
,保持总压为 ,发生反应:
,发生反应: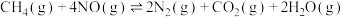
 。
。(1)能表示此反应已经达到平衡的是_______(填字母)。
| A.气体总体积保持不变 | B.混合气体的平均相对分子质量保持不变 |
C. 不再变化 不再变化 | D.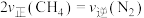 |
(2)当
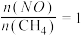 时,
时, 的平衡转化率
的平衡转化率 ;
; 时
时 平衡转化率
平衡转化率 的关系如图:
的关系如图:

 (填“>”或“<”)
(填“>”或“<”)②表示当
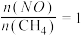 时,
时, 的平衡转化率
的平衡转化率 的关系是
的关系是③当
 、
、 时,反应达平衡时,
时,反应达平衡时, 的分压为
的分压为
您最近一年使用:0次
2024-04-02更新
|
157次组卷
|
2卷引用:内蒙古自治区通辽市第一中学等校2023-2024学年高二下学期5月期中联考化学试题
名校
解题方法
8 . 某研究小组模拟工业湿法制备新型绿色消毒剂高铁酸钾,按如下流程开展实验。
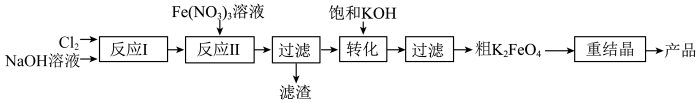
用如图装置可以完成上述反应Ⅰ和反应Ⅱ。

信息:① 易溶于水,微溶于
易溶于水,微溶于 溶液,难溶于乙醇;具有强氧化性,在酸性或中性溶液口快速产生
溶液,难溶于乙醇;具有强氧化性,在酸性或中性溶液口快速产生 ;在
;在 碱性溶液中较稳定。②
碱性溶液中较稳定。② 易挥发,且在溶液中有反应
易挥发,且在溶液中有反应 。
。
③部分物质在水中的溶解度见下表:
(1)仪器 的名称是
的名称是_________ ,反应Ⅰ中为了减少因反应过热而产生 ,可以采取的操作是
,可以采取的操作是______ 。
(2)下列说法正确的是________。
(3)写出反应Ⅱ中主要反应的离子方程式:_______ 。
(4)测定产品的纯度( 的相对分子质量为
的相对分子质量为 )
)
称取 左右碘化钾于碘量瓶中,加入
左右碘化钾于碘量瓶中,加入 溶液和
溶液和 左右的固体氟化钠,待溶解完毕;准确称取
左右的固体氟化钠,待溶解完毕;准确称取 样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用
样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用 标准溶液进行滴定,消耗标准液体积为
标准溶液进行滴定,消耗标准液体积为 。
。
已知: ,
, (方程式未配平)
(方程式未配平)
①本次实验测得 纯度为
纯度为_______ ,然后重复上述过程,平行测试3次。
②实验过程中往往需要加入过量且比理论计算所需量过量2~3倍左右的 ,理由是
,理由是_______ 。

用如图装置可以完成上述反应Ⅰ和反应Ⅱ。

信息:①
 易溶于水,微溶于
易溶于水,微溶于 溶液,难溶于乙醇;具有强氧化性,在酸性或中性溶液口快速产生
溶液,难溶于乙醇;具有强氧化性,在酸性或中性溶液口快速产生 ;在
;在 碱性溶液中较稳定。②
碱性溶液中较稳定。② 易挥发,且在溶液中有反应
易挥发,且在溶液中有反应 。
。③部分物质在水中的溶解度见下表:
| 物质 | 溶解度/g | |||
 |  |  |  | |
 | 35.8 | 36.0 | 36.3 | 38.4 |
 | 80.0 | 88.0 | 96.0 | 148.0 |
(1)仪器
 的名称是
的名称是 ,可以采取的操作是
,可以采取的操作是(2)下列说法正确的是________。
| A.反应Ⅱ中为了加快反应速率,可进行搅拌与加热 |
| B.反应Ⅱ结束后应通一段时间氮气,然后再拆下装置进行后续实验 |
C.加入饱和 溶液发生的是复分解反应 溶液发生的是复分解反应 |
D.若用 溶液代替 溶液代替 溶液作铁源, 溶液作铁源, 的产率和纯度都会降低 的产率和纯度都会降低 |
(3)写出反应Ⅱ中主要反应的离子方程式:
(4)测定产品的纯度(
 的相对分子质量为
的相对分子质量为 )
)称取
 左右碘化钾于碘量瓶中,加入
左右碘化钾于碘量瓶中,加入 溶液和
溶液和 左右的固体氟化钠,待溶解完毕;准确称取
左右的固体氟化钠,待溶解完毕;准确称取 样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用
样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用 标准溶液进行滴定,消耗标准液体积为
标准溶液进行滴定,消耗标准液体积为 。
。已知:
 ,
, (方程式未配平)
(方程式未配平)①本次实验测得
 纯度为
纯度为②实验过程中往往需要加入过量且比理论计算所需量过量2~3倍左右的
 ,理由是
,理由是
您最近一年使用:0次
名校
解题方法
9 . 38.4gCu与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到 和
和 的混合溶液,反应过程及有关数据如图所示
的混合溶液,反应过程及有关数据如图所示
 和
和 的混合溶液,反应过程及有关数据如图所示
的混合溶液,反应过程及有关数据如图所示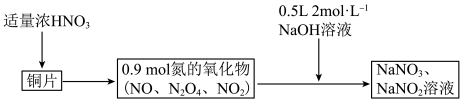
| A.硝酸在反应中既体现氧化性又体现酸性 |
| B.氮的氧化物和NaOH溶液反应时,NO作还原剂 |
C.混合气体中 的物质的量是0.2mol 的物质的量是0.2mol |
| D.若浓硝酸体积为200mL,则其物质的量浓度为11mol/L |
您最近一年使用:0次
2024-02-17更新
|
1392次组卷
|
14卷引用:内蒙古自治区乌兰浩特第一中学2023-2024学年高一下学期第一次月考化学试题
内蒙古自治区乌兰浩特第一中学2023-2024学年高一下学期第一次月考化学试题陕西省西安铁一中学2023-2024学年高一上学期期末考试化学试题重庆市第七中学校2023-2024学年高一下学期第一次月考化学试卷广东省佛山市顺德区容山中学2023-2024学年高一下学期3月月考化学试题(已下线)安徽省皖北县中联盟2023-2024学年高一下学期3月月考化学试题山东省临沂第四中学2023-2024学年高一下学期3月月考化学试题江西省抚州市金溪县第一中学2023-2024学年高一下学期第一次月考化学试卷江西省宜春市丰城中学2023-2024学年高一下学期3月月考化学试题陕西省商洛市商州区高级中学2023-2024学年高一下学期3月月考化学试题安徽省淮南市第二中2023-2024学年高一下学期第一次月考化学试题四川省射洪中学校强基班2023-2024学年高一下学期4月第一次月考化学试题黑龙江省哈尔滨市第六中学校2023-2024学年高一下学期4月测试化学试卷山东省淄博第十一中学2023-2024学年高一下学期4月阶段性考试化学试卷江西省宜春市上高二中2023-2024学年高一下学期3月月考化学试题
23-24高一上·全国·期末
名校
10 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,以下为制备两种消毒剂的方法,请回答下列问题:
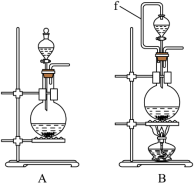
(1)实验室沿用舍勒的方法制取 时选用图中装置
时选用图中装置_______ (填“A”或“B”),反应的离子方程式为_______ ,装置B中管f的作用是_______ 。
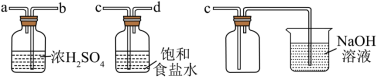
(2)实验室制取干燥、纯净的 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→_______ (填字母)。
(3)反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
【提出猜想】
猜想1: 降低,氧化剂
降低,氧化剂_______ (填化学式)氧化性减弱。
猜想2:_______ 减弱。
猜想3: 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
【实验拓展】经过探究,小组同学认为硫酸、 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式:_______ 。
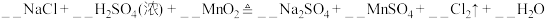
(1)实验室沿用舍勒的方法制取
 时选用图中装置
时选用图中装置
(2)实验室制取干燥、纯净的
 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→
(3)反应停止后,实验小组检验烧瓶中还有
 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。【提出猜想】
猜想1:
 降低,氧化剂
降低,氧化剂猜想2:
猜想3:
 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸,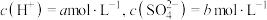 | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使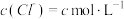 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 固体,使 固体,使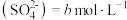 | 猜想3正确 |
 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式: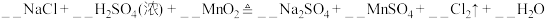
您最近一年使用:0次
2024-01-07更新
|
667次组卷
|
4卷引用: 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)
2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)(已下线)期末测试卷01-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题河南省新乡市原阳县第一高级中学2023-2024学年高一上学期1月月考化学试题



