1 .  可用于制备除虫剂、发光材料等。某课题小组拟用硫酸钙和焦炭在高温条件下反应制备硫化钙并检验气体产物。回答下列问题:
可用于制备除虫剂、发光材料等。某课题小组拟用硫酸钙和焦炭在高温条件下反应制备硫化钙并检验气体产物。回答下列问题:
(1)甲同学设计如图所示的实验装置检验气体产物。___________ 。
②装置D中能证明产物中有 的实验现象为
的实验现象为___________ ,D中发生反应的化学方程式为___________ 。
(2)乙同学提出,根据氧化还原反应原理,装置A中的气体产物可能还有 、
、 ,为了验证具体的气体产物,请结合上述装置并选择下列仪器设计实验方案(有些仪器可重复使用)。
,为了验证具体的气体产物,请结合上述装置并选择下列仪器设计实验方案(有些仪器可重复使用)。___________ (填字母)。
A、F、___________、___________、I、H、I、M
②能证明有 生成的实验现象是
生成的实验现象是___________ 。
③若 中混有
中混有 ,除上述试剂外,还可以将气体通入饱和
,除上述试剂外,还可以将气体通入饱和___________ (填化学式)溶液中,以除去 。
。
(3)经实验检验反应的气体产物有 、
、 、
、 且气体体积之比为
且气体体积之比为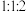 ,写出装置A中发生反应的化学方程式:
,写出装置A中发生反应的化学方程式:___________ 。
(4)利用重量法测定固体产物中各成分的质量之比。将少量固体产物溶于足量的饱和碳酸钠溶液中,再进行过滤、洗涤、干燥等操作,需要测定的物理量有固体产物的质量和生成___________ 沉淀的质量(填化学式)。[已知 与
与 反应生成
反应生成 和
和 ]
]
 可用于制备除虫剂、发光材料等。某课题小组拟用硫酸钙和焦炭在高温条件下反应制备硫化钙并检验气体产物。回答下列问题:
可用于制备除虫剂、发光材料等。某课题小组拟用硫酸钙和焦炭在高温条件下反应制备硫化钙并检验气体产物。回答下列问题:(1)甲同学设计如图所示的实验装置检验气体产物。
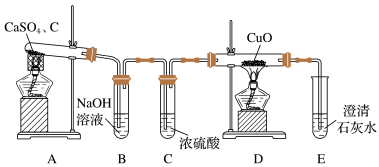
②装置D中能证明产物中有
 的实验现象为
的实验现象为(2)乙同学提出,根据氧化还原反应原理,装置A中的气体产物可能还有
 、
、 ,为了验证具体的气体产物,请结合上述装置并选择下列仪器设计实验方案(有些仪器可重复使用)。
,为了验证具体的气体产物,请结合上述装置并选择下列仪器设计实验方案(有些仪器可重复使用)。 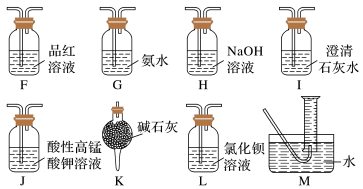
A、F、___________、___________、I、H、I、M
②能证明有
 生成的实验现象是
生成的实验现象是③若
 中混有
中混有 ,除上述试剂外,还可以将气体通入饱和
,除上述试剂外,还可以将气体通入饱和 。
。(3)经实验检验反应的气体产物有
 、
、 、
、 且气体体积之比为
且气体体积之比为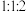 ,写出装置A中发生反应的化学方程式:
,写出装置A中发生反应的化学方程式:(4)利用重量法测定固体产物中各成分的质量之比。将少量固体产物溶于足量的饱和碳酸钠溶液中,再进行过滤、洗涤、干燥等操作,需要测定的物理量有固体产物的质量和生成
 与
与 反应生成
反应生成 和
和 ]
]
您最近一年使用:0次
2 . 利用氢气作为能源的前提是安全有效地解决储存氢气的问题。化学家已研究出多种储存氢气的方法。回答下列问题:
(1)某金属R的储氢材料可以通过化学反应将氢吸附和排放,已知R为短周期金属元素,其部分电离能数据如表所示:
该金属元素R是___________ (填元素符号),其位于元素周期表___________ 区。
(2)NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
氨硼烷(NH3BH3)中N、B都达到稳定结构,NH3BH3存在配位键,提供空轨道的是___________ (填元素符号),用化学键表示出(NH3BH3)分子的结构式:___________ 。
(3)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进到由Cu原子与Ag原子构成的全部四面体空隙中。该晶体储氢后的化学式为___________ 。
(4)过渡金属Q与镧(La)形成的合金是一种储氢材料,其中基态Q原子的价层电子排布式为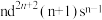 ,该合金的晶胞结构和z轴方向的投影图如图所示:
,该合金的晶胞结构和z轴方向的投影图如图所示:___________ ,该合金的密度为___________ g·cm-3(用含a,c的代数式表示,NA为阿伏加德罗常数的值)。
(1)某金属R的储氢材料可以通过化学反应将氢吸附和排放,已知R为短周期金属元素,其部分电离能数据如表所示:
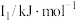 | 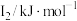 |  |  |  |
| 578 | 1817 | 2745 | 11577 | 14842 |
(2)NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
氨硼烷(NH3BH3)中N、B都达到稳定结构,NH3BH3存在配位键,提供空轨道的是
(3)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进到由Cu原子与Ag原子构成的全部四面体空隙中。该晶体储氢后的化学式为
(4)过渡金属Q与镧(La)形成的合金是一种储氢材料,其中基态Q原子的价层电子排布式为
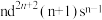 ,该合金的晶胞结构和z轴方向的投影图如图所示:
,该合金的晶胞结构和z轴方向的投影图如图所示:
您最近一年使用:0次
7日内更新
|
37次组卷
|
2卷引用:山西省部分学校2023-2024学年高二下学期5月质量检测化学试题
名校
3 . 设 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.标准状况下,0.5 mol  的体积为11.2 L 的体积为11.2 L |
B.1 mol  与1 mol 与1 mol  在光照下充分反应生成的 在光照下充分反应生成的 分子数目为 分子数目为 |
C.一定条件下,密闭容器中1 mol  与足量 与足量 充分反应时转移 充分反应时转移 个电子 个电子 |
D.标准状况下,22.4 L 中含有 中含有 键的数目为 键的数目为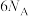 |
您最近一年使用:0次
7日内更新
|
113次组卷
|
3卷引用:山西省名校联考2023-2024学年高一下学期5月月考化学试题
名校
解题方法
4 . 二氧化碳催化加氢制甲醇的反应为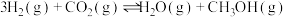 ,已知该反应为放热反应,在恒容密闭容器中充入
,已知该反应为放热反应,在恒容密闭容器中充入 和
和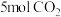 进行反应,下列说法正确的是
进行反应,下列说法正确的是
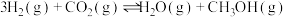 ,已知该反应为放热反应,在恒容密闭容器中充入
,已知该反应为放热反应,在恒容密闭容器中充入 和
和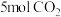 进行反应,下列说法正确的是
进行反应,下列说法正确的是A.反应过程中,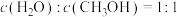 |
| B.气体密度不变可说明反应已达到平衡状态 |
| C.断键吸收的总能量大于形成化学键放出的总能量 |
D.反应达到平衡时 的转化率可能为 的转化率可能为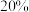 |
您最近一年使用:0次
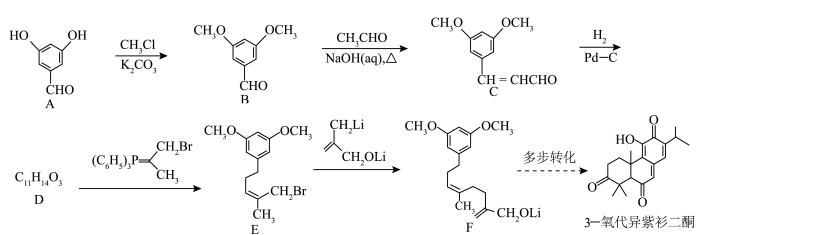
5 . 3-氧代异紫杉二酮是从台湾杉中提取的具有抗癌活性的天然产物。最近科学家完成了该物质的全合成,其关键中间体(F)的合成路线如下:
(1)A的化学名称为_______ (用系统命名法命名), 的反应中
的反应中 的作用为
的作用为_______ 。
(2)C→D反应的化学方程式为_______ 。
(3)E的分子式为_______ 。
(4)3-氧代异紫杉二酮中所含官能团的名称为羰基、_______ 。
(5)化合物R是B的同分异构体,满足以下条件的R有_______ 种(不考虑立体异构);
①含有苯环且苯环上有两个取代基
②能与银氨溶液发生银镜反应,并且能发生水解反应
③能与金属钠反应放出氢气
其中一种分子的核磁共振氢谱有6组峰,峰面积之比为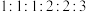 ,且遇
,且遇 溶液显紫色,该分子的结构简式为
溶液显紫色,该分子的结构简式为_______ (任写一种)。
已知:
(1)A的化学名称为
 的反应中
的反应中 的作用为
的作用为(2)C→D反应的化学方程式为
(3)E的分子式为
(4)3-氧代异紫杉二酮中所含官能团的名称为羰基、
(5)化合物R是B的同分异构体,满足以下条件的R有
①含有苯环且苯环上有两个取代基
②能与银氨溶液发生银镜反应,并且能发生水解反应
③能与金属钠反应放出氢气
其中一种分子的核磁共振氢谱有6组峰,峰面积之比为
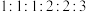 ,且遇
,且遇 溶液显紫色,该分子的结构简式为
溶液显紫色,该分子的结构简式为
您最近一年使用:0次
6 . 水煤气变换反应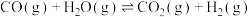
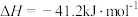 可用于制氢,该反应可分两步完成:
可用于制氢,该反应可分两步完成:
①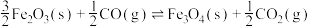
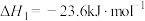
②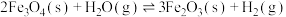
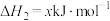
请回答下列问题:
(1)x=___________ 。
(2)下列有利于提高H2的平衡产率的措施是___________(填字母)。
(3)总反应的催化剂是___________ (填化学式),测定其属于晶体的方法是___________ ,在其活性温度范围内,反应历程包含吸附(快速的过程)、反应及脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因与___________ 因素有关(填一条)。
(4)保持压强为1.7MPa,按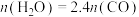 进行投料,曲线a、b分别表示不同条件下反应达到平衡,相应物质的分压[如
进行投料,曲线a、b分别表示不同条件下反应达到平衡,相应物质的分压[如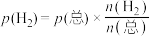 ]如图所示。
]如图所示。___________ ,平衡常数
___________ 。
②根据图中信息,曲线a中H2的产率比曲线b低的主要原因可能是___________ (用化学方程式表示,不考虑 )。
)。
(5)整个反应过程都是“气-固”反应,有利于气固接触的措施是___________ (填一条)。
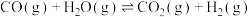
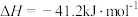 可用于制氢,该反应可分两步完成:
可用于制氢,该反应可分两步完成:①
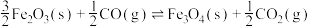
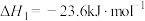
②
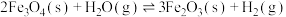
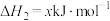
请回答下列问题:
(1)x=
(2)下列有利于提高H2的平衡产率的措施是___________(填字母)。
| A.升高温度 | B.保持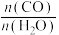 一定,增大体系总压 一定,增大体系总压 |
| C.向体系中投入一定量的纳米CaO | D.增大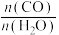 |
(3)总反应的催化剂是
(4)保持压强为1.7MPa,按
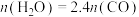 进行投料,曲线a、b分别表示不同条件下反应达到平衡,相应物质的分压[如
进行投料,曲线a、b分别表示不同条件下反应达到平衡,相应物质的分压[如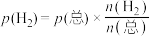 ]如图所示。
]如图所示。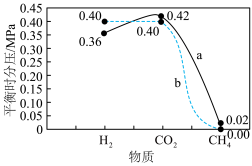

②根据图中信息,曲线a中H2的产率比曲线b低的主要原因可能是
 )。
)。(5)整个反应过程都是“气-固”反应,有利于气固接触的措施是
您最近一年使用:0次
解题方法
7 . 近年来,随着新能源汽车行业高速发展,市场对磷酸铁锂( )的需求量也随之增加。以硫铁矿(主要成分是
)的需求量也随之增加。以硫铁矿(主要成分是 ,含少量
,含少量 、
、 和
和 为原料制备)
为原料制备) 的流程如图所示:
的流程如图所示:
请回答下列问题:
(1)写出磷酸铁锂中相应价态基态铁离子的电子排布式:___________ 。
(2)“焙烧”生成 的化学方程式为
的化学方程式为___________ 。
(3)“还原”选用足量FeS的优点是___________ ;“除铝”时,溶液的pH应控制的范围是___________ 。
(4)“氧化”加入 的目的除了可以增强H2O2的氧化性外,还可以
的目的除了可以增强H2O2的氧化性外,还可以___________ 。
(5)“沉铁”后的滤液中阴离子除了 外,还检验出
外,还检验出 和
和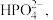 写出“沉铁”反应的离子方程式:
写出“沉铁”反应的离子方程式:___________ 。
(6)“高温煅烧”条件下,由 制备
制备 ,理论上
,理论上 和
和 的投料比为
的投料比为
___________ 。
(7) 的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时
的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时 脱出部分Li⁺形成
脱出部分Li⁺形成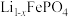 ,结构如图b所示,则
,结构如图b所示,则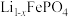 中
中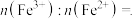
___________ (填最简整数比)。
 )的需求量也随之增加。以硫铁矿(主要成分是
)的需求量也随之增加。以硫铁矿(主要成分是 ,含少量
,含少量 、
、 和
和 为原料制备)
为原料制备) 的流程如图所示:
的流程如图所示:
| 金属氢氧化物 |  |  |  |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 |
(1)写出磷酸铁锂中相应价态基态铁离子的电子排布式:
(2)“焙烧”生成
 的化学方程式为
的化学方程式为(3)“还原”选用足量FeS的优点是
(4)“氧化”加入
 的目的除了可以增强H2O2的氧化性外,还可以
的目的除了可以增强H2O2的氧化性外,还可以(5)“沉铁”后的滤液中阴离子除了
 外,还检验出
外,还检验出 和
和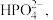 写出“沉铁”反应的离子方程式:
写出“沉铁”反应的离子方程式:(6)“高温煅烧”条件下,由
 制备
制备 ,理论上
,理论上 和
和 的投料比为
的投料比为
(7)
 的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时
的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时 脱出部分Li⁺形成
脱出部分Li⁺形成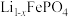 ,结构如图b所示,则
,结构如图b所示,则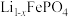 中
中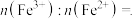

您最近一年使用:0次
8 . 环氧乙烷(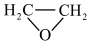 ,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:
,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:

副反应:

(1)已知
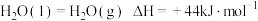 ,则EO的燃烧热
,则EO的燃烧热 为
为(2)在温度为T,压强为P0的环境下,欲提高乙烯的平衡转化率,需
(3)向温度为T,刚性容器中加入投料比为2∶3∶3的乙烯、氧气、氮气。已知平衡后:
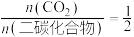 ,
,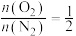 (其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为
(其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为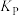 为
为(4)以Ag为催化剂的反应机理如下:
反应Ⅰ:
 慢
慢反应Ⅱ:
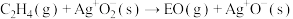 快
快反应Ⅲ:
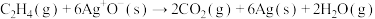 快
快①一定能够提高主反应反应速率的措施有
A.降低温度 B.通入氦气 C.增大CO2浓度 D.增大
 浓度
浓度②加入1,2-二氯乙烷会发生
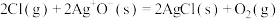 。一定条件下,反应经过一定时间后,EO产率及选择性与1,2—二氯乙烷浓度关系如图。1,2—二氯乙烷能使EO产率先增加后降低的原因是
。一定条件下,反应经过一定时间后,EO产率及选择性与1,2—二氯乙烷浓度关系如图。1,2—二氯乙烷能使EO产率先增加后降低的原因是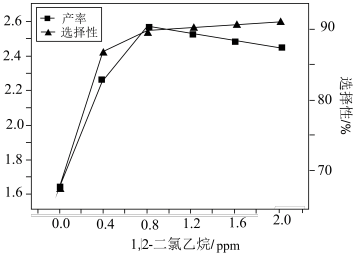
您最近一年使用:0次
2024-05-11更新
|
126次组卷
|
3卷引用:2024届山西省晋城市第一中学校高三下学期模拟预测理综试题-高中化学
名校
9 . 以银精矿(主要成分为Ag2S、FeS2、ZnS)为原料采用“预氧化湿法提银”工艺流程如下: 有较强的氧化性,被还原为Cl-。
有较强的氧化性,被还原为Cl-。
(1)“分离转化”时,为提高 的转化率可采取的措施是
的转化率可采取的措施是___________ ; 转化为AgCl和S的化学方程式为
转化为AgCl和S的化学方程式为___________ 。
(2)已知: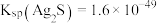 ,
, ,若不加KClO3,直接加氯化物,依据反应
,若不加KClO3,直接加氯化物,依据反应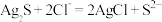 ,能否实现此反应较完全转化?并说明理由:
,能否实现此反应较完全转化?并说明理由:___________ 。
(3)滤液1中的金属阳离子有___________ 。在整个工艺中可循环利用的物质是___________ 。
(4)“浸银”时,发生反应的离子方程式为___________ 。
(5)“分离转化”时,除上述方法外也可以使用过量FeCl3、HCl和 的混合液作为浸出剂,将Ag2S中的银以
的混合液作为浸出剂,将Ag2S中的银以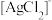 形式浸出,建立化学平衡状态。请解释浸出剂中
形式浸出,建立化学平衡状态。请解释浸出剂中 、H⁺的作用
、H⁺的作用___________ 。
(6)还原过程中所用的N2H4,分子可能有两种不同的构象——顺式和反式,沿N—N键轴方向的投影如下图所示,其中(a)为反式,(b)为顺式。测得 分子极性很大,说明它具有
分子极性很大,说明它具有___________ 构象(填“反式”或“顺式”)。
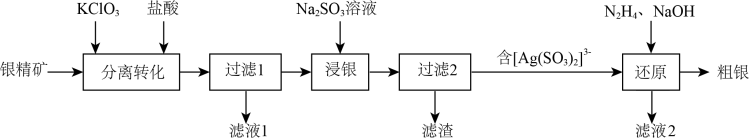
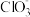 有较强的氧化性,被还原为Cl-。
有较强的氧化性,被还原为Cl-。(1)“分离转化”时,为提高
 的转化率可采取的措施是
的转化率可采取的措施是 转化为AgCl和S的化学方程式为
转化为AgCl和S的化学方程式为(2)已知:
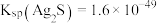 ,
, ,若不加KClO3,直接加氯化物,依据反应
,若不加KClO3,直接加氯化物,依据反应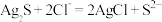 ,能否实现此反应较完全转化?并说明理由:
,能否实现此反应较完全转化?并说明理由:(3)滤液1中的金属阳离子有
(4)“浸银”时,发生反应的离子方程式为
(5)“分离转化”时,除上述方法外也可以使用过量FeCl3、HCl和
 的混合液作为浸出剂,将Ag2S中的银以
的混合液作为浸出剂,将Ag2S中的银以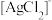 形式浸出,建立化学平衡状态。请解释浸出剂中
形式浸出,建立化学平衡状态。请解释浸出剂中 、H⁺的作用
、H⁺的作用(6)还原过程中所用的N2H4,分子可能有两种不同的构象——顺式和反式,沿N—N键轴方向的投影如下图所示,其中(a)为反式,(b)为顺式。测得
 分子极性很大,说明它具有
分子极性很大,说明它具有
您最近一年使用:0次
2024-05-11更新
|
133次组卷
|
3卷引用:2024届山西省晋城市第一中学校高三下学期模拟预测理综试题-高中化学
解题方法
10 . 2-甲氧基-2-甲基丁烷(用TAME表示)常用作汽油添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如下反应: 分别为
分别为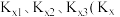 是以物质的量分数代替物质的量浓度表示的平衡常数)与温度
是以物质的量分数代替物质的量浓度表示的平衡常数)与温度 变化关系如下图所示。
变化关系如下图所示。
(1)
____  (填“>”“<”或“=”);烯烃A和B中相对稳定的是
(填“>”“<”或“=”);烯烃A和B中相对稳定的是_____ (填“A”或“B”)。
(2)向某密闭反应容器中加入 TAME,控制温度为
TAME,控制温度为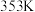 ,反应
,反应 后达到平衡状态。
后达到平衡状态。
①能说明反应已达平衡状态的是_______ (填序号)。
a. 的物质的量分数不再发生变化
的物质的量分数不再发生变化
b. 和
和 的物质的量相等
的物质的量相等
c. 不再发生变化
不再发生变化
d.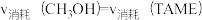
②达到平衡时,容器中 与
与 的物质的量之比为
的物质的量之比为_______ 。
③若测得TAME的平衡转化率为 ,反应II的
,反应II的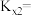
_______ (保留2位有效数字)。
④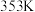 下,向该容器中注入惰性溶剂稀释,反应I的平衡将
下,向该容器中注入惰性溶剂稀释,反应I的平衡将_______ 移动(填“正向”、“逆向”或“不”)。
(3)为研究反应体系的动力学行为,向盛有惰性溶剂的另一容器中加入一定量A、B和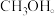 控制温度为
控制温度为 物质的量浓度
物质的量浓度 随反应时间
随反应时间 的变化如下图所示。
的变化如下图所示。 时,反应Ⅲ的
时,反应Ⅲ的
_______  填“>”、“<”或“=”),理由是
填“>”、“<”或“=”),理由是_______ 。
反应I:
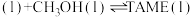

反应II:
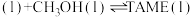

反应III: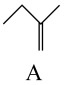
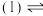

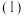

 分别为
分别为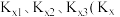 是以物质的量分数代替物质的量浓度表示的平衡常数)与温度
是以物质的量分数代替物质的量浓度表示的平衡常数)与温度 变化关系如下图所示。
变化关系如下图所示。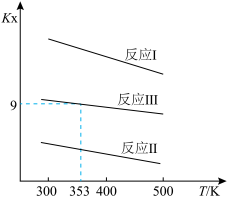
(1)

 (填“>”“<”或“=”);烯烃A和B中相对稳定的是
(填“>”“<”或“=”);烯烃A和B中相对稳定的是(2)向某密闭反应容器中加入
 TAME,控制温度为
TAME,控制温度为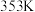 ,反应
,反应 后达到平衡状态。
后达到平衡状态。①能说明反应已达平衡状态的是
a.
 的物质的量分数不再发生变化
的物质的量分数不再发生变化 b.
 和
和 的物质的量相等
的物质的量相等c.
 不再发生变化
不再发生变化 d.
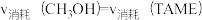
②达到平衡时,容器中
 与
与 的物质的量之比为
的物质的量之比为③若测得TAME的平衡转化率为
 ,反应II的
,反应II的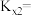
④
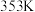 下,向该容器中注入惰性溶剂稀释,反应I的平衡将
下,向该容器中注入惰性溶剂稀释,反应I的平衡将(3)为研究反应体系的动力学行为,向盛有惰性溶剂的另一容器中加入一定量A、B和
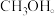 控制温度为
控制温度为 物质的量浓度
物质的量浓度 随反应时间
随反应时间 的变化如下图所示。
的变化如下图所示。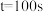 时,反应Ⅲ的
时,反应Ⅲ的
 填“>”、“<”或“=”),理由是
填“>”、“<”或“=”),理由是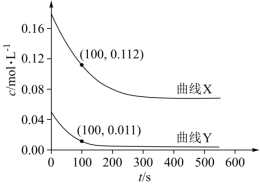
您最近一年使用:0次



