名校
1 . X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、组成蛋白质的重要元素;Z的基态原子核外9个原子轨道上都填充了电子且有2个未成对电子;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1)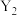 分子中存在的σ键和π键个数之比为
分子中存在的σ键和π键个数之比为___________ 。
(2)X的第一电离能比Y的___________ (填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液加热会反应会生成可以使品红溶液褪色的物质,写出化学方程式:___________ 。
(4)W的基态原子的价层电子排布式为___________ 。
(5)X、Y的最简单氢化物的VSEPR模型分别为___________ 、___________ 。
(1)
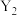 分子中存在的σ键和π键个数之比为
分子中存在的σ键和π键个数之比为(2)X的第一电离能比Y的
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液加热会反应会生成可以使品红溶液褪色的物质,写出化学方程式:
(4)W的基态原子的价层电子排布式为
(5)X、Y的最简单氢化物的VSEPR模型分别为
您最近一年使用:0次
名校
2 . 用 粒子轰击
粒子轰击 可得到一个中子和一种放射性核素
可得到一个中子和一种放射性核素 ,即
,即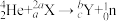 。已知基态X原子中s能级电子总数是p能级电子总数的4倍。下列说法错误的是
。已知基态X原子中s能级电子总数是p能级电子总数的4倍。下列说法错误的是
 粒子轰击
粒子轰击 可得到一个中子和一种放射性核素
可得到一个中子和一种放射性核素 ,即
,即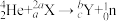 。已知基态X原子中s能级电子总数是p能级电子总数的4倍。下列说法错误的是
。已知基态X原子中s能级电子总数是p能级电子总数的4倍。下列说法错误的是| A.b=13 | B.最高价含氧酸的酸性:X<Y |
| C.XF3与YF3中X与Y的杂化方式相同 | D.Y的某种氢化物中含非极性键 |
您最近一年使用:0次
名校
3 . 下列说法正确的是
| A.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 |
| B.p轨道电子能量一定高于s轨道电子能量 |
| C.杂化轨道既可以形成σ键,也可以形成π键 |
| D.根据原子核外电子排布的特点,Zn在元素周期表中位于d区 |
您最近一年使用:0次
名校
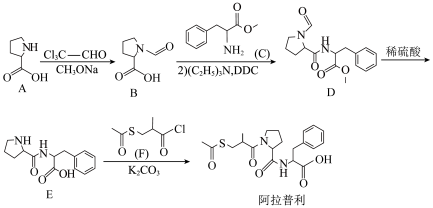
4 . 阿拉普利是治疗高血压的长效药,合成路线如图:
(1)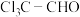 中官能团的名称为
中官能团的名称为_______ 。
(2)写出A→B的化学方程式:_______ ;制备E的过程中,设计A→B的目的是_______ 。
(3)E和F反应生成阿拉普利的反应类型是_______ ; 的作用是
的作用是_______ 。
(4)阿拉普利分子中含有_______ 个手性碳原子。
(5)C的芳香族同分异构体中,同时具备下列条件的结构有_______ 种(不包括立体异构体)。
①既能发生银镜反应,又能发生水解反应
②苯环上只有两种取代基,且其中一个为
其中核磁共振氢谱显示有五组峰,且峰面积比为6:2:2:2:1的结构简式为_______ 。
(1)
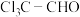 中官能团的名称为
中官能团的名称为(2)写出A→B的化学方程式:
(3)E和F反应生成阿拉普利的反应类型是
 的作用是
的作用是(4)阿拉普利分子中含有
(5)C的芳香族同分异构体中,同时具备下列条件的结构有
①既能发生银镜反应,又能发生水解反应
②苯环上只有两种取代基,且其中一个为

其中核磁共振氢谱显示有五组峰,且峰面积比为6:2:2:2:1的结构简式为
您最近一年使用:0次
昨日更新
|
374次组卷
|
4卷引用:2024届青海省海南藏族自治州高三下学期二模理综试题-高中化学
5 . 40Zr与22Ti同族,ZrO2有3种常见晶胞结构,最为常见的是立方ZrO2(晶胞为立方体)、四方ZrO2(晶胞为长方体,其底面为正方形),立方ZrO2性质与钻石接近,可加工为璀璨夺目的饰品。_______ 。
(2)如图所示立方ZrO2的晶胞中,位于顶点的原子是_______ 。
(3)如图所示四方ZrO2的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为207pm或246pm,其余Zr原子距离明显远于300pm,距离每个O原子“最近”的Zr原子共_______ 个。

(2)如图所示立方ZrO2的晶胞中,位于顶点的原子是
(3)如图所示四方ZrO2的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为207pm或246pm,其余Zr原子距离明显远于300pm,距离每个O原子“最近”的Zr原子共
您最近一年使用:0次
名校
6 . 氮气可以作食品包装、灯泡等的填充气,也是合成纤维、合成橡胶的重要原料。实验室制备氮气的反应式:NH4Cl+NaNO2 NaCl+N2↑+2H2O。下列说法正确的是
NaCl+N2↑+2H2O。下列说法正确的是
 NaCl+N2↑+2H2O。下列说法正确的是
NaCl+N2↑+2H2O。下列说法正确的是| A.离子半径:r(Na+)>r(N3-)>r(O2-) |
| B.氮元素基态原子核外未成对电子数为1 |
C.钠电离最外层一个电子所需要的能量:① >② >② |
| D.水中的氢键可以表示为:O-H…O,其中H…O之间的距离即为该氢键的键长 |
您最近一年使用:0次
名校
解题方法
7 . 研究化学能与热能、电能的转化具有重要价值。回答下列问题:
电能是现代社会中应用最广泛的二次能源。
(1)下列装置中能够实现化学能转化为电能的是_______(填字母)。
(2)(1)中的原电池装置中,正极反应方程是_______ 。
(3)若装置中转移了0.2mol电子,负极减少的质量是_______ 。
(4)有甲、乙两位同学均想利用原电池反应检测金属的活动性强弱,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示:_______ 。
②乙中作负极材料是_______ ,总反应的离子方程式:_______ 。
③如果甲同学与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验得出的结论中,正确的是_______ (填标号)。
A.镁的金属性不一定比铝的金属性强
B.该实验说明金属活动性顺序表已过时,没有实用价值了
C.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质溶液
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析
(5)下列化学反应过程中的能量变化符合图示的是_______ (填序号)。
③金属钠与水反应 ④酒精燃烧
⑤灼热的碳与二氧化碳反应 ⑥ 与
与 反应
反应
(6)已知键能是表征化学键强度的物理量,可以用键断裂时所需的能量大小来衡量,键能越大,化学键越牢固,含有该键的分子越稳定。某些化学键的键能如下表所示( ):
):
①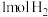 在
在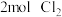 中燃烧,
中燃烧,_______ (填吸收或放出)的热量为_______  。
。
②表中所列化学键形成的单质分子中,最稳定的是_______ (填化学式)。
电能是现代社会中应用最广泛的二次能源。
(1)下列装置中能够实现化学能转化为电能的是_______(填字母)。
A.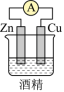 | B. | C.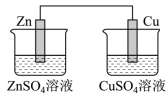 | D.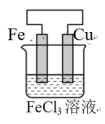 |
(3)若装置中转移了0.2mol电子,负极减少的质量是
(4)有甲、乙两位同学均想利用原电池反应检测金属的活动性强弱,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示:
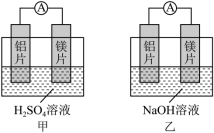
②乙中作负极材料是
③如果甲同学与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验得出的结论中,正确的是
A.镁的金属性不一定比铝的金属性强
B.该实验说明金属活动性顺序表已过时,没有实用价值了
C.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质溶液
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析
(5)下列化学反应过程中的能量变化符合图示的是
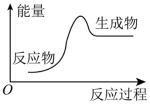
③金属钠与水反应 ④酒精燃烧
⑤灼热的碳与二氧化碳反应 ⑥
 与
与 反应
反应(6)已知键能是表征化学键强度的物理量,可以用键断裂时所需的能量大小来衡量,键能越大,化学键越牢固,含有该键的分子越稳定。某些化学键的键能如下表所示(
 ):
):| 共价键 |  |  |  |
| 键能 | 247 | 431 | 436 |
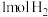 在
在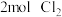 中燃烧,
中燃烧, 。
。②表中所列化学键形成的单质分子中,最稳定的是
您最近一年使用:0次
名校
解题方法
8 . 下列化学反应对应的离子方程式表示正确的是
A.氢氟酸与 反应: 反应: |
B.向氯化铝溶液中滴入过量的氨水: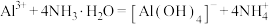 |
C.向 溶液中通入过量 溶液中通入过量 : :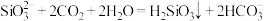 |
D.铁丝插入CuSO4溶液中: |
您最近一年使用:0次
名校
解题方法
9 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.常温常压下,18g重水( )中所含的中子数为 )中所含的中子数为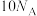 |
B.标准状况下,14g氮气含有的核外电子数为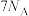 |
C.标准状况下,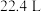 的 的 和 和 组成的混合气体中,含氧原子数为 组成的混合气体中,含氧原子数为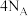 |
D.1mol 与足量 与足量 充分反应,生成的 充分反应,生成的 分子数为 分子数为 |
您最近一年使用:0次
名校
解题方法
10 . 化学实验操作是进行科学实验的基础。下列操作合理的是
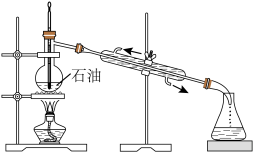
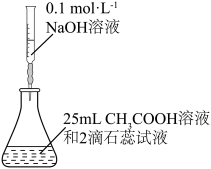
|
|
| A.石油分馏 | B.用NaOH标准溶液滴定未知浓度的 溶液 溶液 |
|
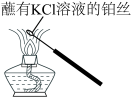
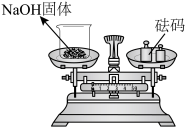
|
| C.观察K元素的焰色 | D.称量NaOH固体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-06-12更新
|
177次组卷
|
7卷引用:2024届青海省西宁市大通县高三下学期高考四模理科综合试卷-高中化学