1 . 氢燃料电池汽车是未来汽车发展的重要方向之一。二甲醚重整制氢技术是一种理想制氢方案。
(1)1mol二甲醚CH3OCH3(g)与水蒸气发生可逆反应,生成CO2(g)和H2(g)的化学方程式为________________ 。
(2)根据下列两个热化学方程式,计算上述反应的反应热∆H=__________ kJ·mol-1。
反应I:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) ∆H1=+37 kJ·mol-1
反应Ⅱ:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ∆H2=+49 kJ·mol-1
升高温度,反应速率_______ (填“变大”、“变小”或“不变”);根据以上反应判断,可采取_____________ (合理措施)来提高二甲醚的转化率(写一条)。
(3)在一个恒压 (起始体积为3 L)的密闭容器中充入2 mol CH3OH(g)和1 mol H2O(g),仅研究反应Ⅱ。CH3OH的平衡含量随温度、压强的变化如图所示。_______ P2(填“>”、“<”);B、C两点平衡常数KB_______ KC(填“>”、“<”或“=”);A点体积变为______ L,此时平衡常数KA的计算表达式为____________ (列式即可)。
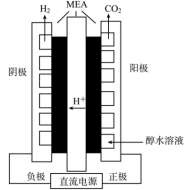
(4)我国科学家开发了一种运用质子交换膜的电解甲醇制氢装置(见图),甲醇的电解电压相对于水可降低近2/3,降低了制氢的能耗。写出阳极电极反应式______________ 。
(1)1mol二甲醚CH3OCH3(g)与水蒸气发生可逆反应,生成CO2(g)和H2(g)的化学方程式为
(2)根据下列两个热化学方程式,计算上述反应的反应热∆H=
反应I:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) ∆H1=+37 kJ·mol-1
反应Ⅱ:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ∆H2=+49 kJ·mol-1
升高温度,反应速率
(3)在一个

(4)我国科学家开发了一种运用质子交换膜的电解甲醇制氢装置(见图),甲醇的电解电压相对于水可降低近2/3,降低了制氢的能耗。写出阳极电极反应式
您最近一年使用:0次
2 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.标准状况下,2.24L  含有的分子数为0.1 含有的分子数为0.1 |
B.2.8g由乙烯和丙烯组成的混合物中,所含的原子总数为0.6 |
C.0.3mol 2-甲基丁烷中含有的碳碳单键数为1.5 |
D.常温常压下,60g  中含有的分子数为 中含有的分子数为 |
您最近一年使用:0次
名校
3 . 2022年诺贝尔化学奖授予了研究“点击化学和生物正交化学”的三位科学家。已知“点击化学”中的一个经典反应如下:
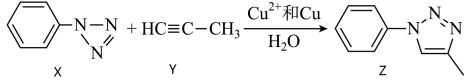
| A.该反应类型为加成反应 |
| B.上述反应物和产物均属于不饱和烃 |
C.化合物Y能使溴的 溶液、酸性高锰酸钾溶液褪色,且原理相同 溶液、酸性高锰酸钾溶液褪色,且原理相同 |
| D.上述反应所涉及的物质中,C原子的杂化方式有两种 |
您最近一年使用:0次
昨日更新
|
199次组卷
|
2卷引用:广东省珠海市六校2023-2024学年高二下学期4月期中考试化学试题
名校
4 . 他米巴罗汀是一种对白血病、阿尔茨海默症等疾病具有较好治疗效果的药物,其一种合成路线:
(1)A的结构简式是___________ ,C中含氧官能团的名称是___________ 。
(2)①和③的反应类型分别是___________ ,___________ 。
(3)草酰氯(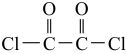 )与乙二胺(
)与乙二胺(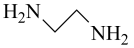 )反应可得到一种六元环状化合物,该反应的化学方程式为
)反应可得到一种六元环状化合物,该反应的化学方程式为___________ 。
(4)化合物W与C互为同分异构体,且满足下列条件:
①属于芳香族化合物且能与NaHCO3反应;
②能发生银镜反应;
③酸性条件下可发生水解反应,其产物能之一与FeCl3发生显色反应。
则W共有___________ 种,其中一种核磁共振氢谱为1:2:2:2:1,其结构简式为___________ 。
(5)参照上述合成路线,设计由苯和1,3-丁二烯合成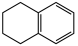 的路线(其它无机试剂任选)。
的路线(其它无机试剂任选)。___________
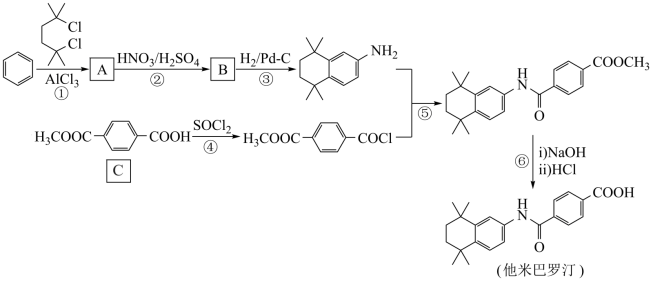
(1)A的结构简式是
(2)①和③的反应类型分别是
(3)草酰氯(
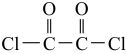 )与乙二胺(
)与乙二胺( )反应可得到一种六元环状化合物,该反应的化学方程式为
)反应可得到一种六元环状化合物,该反应的化学方程式为(4)化合物W与C互为同分异构体,且满足下列条件:
①属于芳香族化合物且能与NaHCO3反应;
②能发生银镜反应;
③酸性条件下可发生水解反应,其产物能之一与FeCl3发生显色反应。
则W共有
(5)参照上述合成路线,设计由苯和1,3-丁二烯合成
 的路线(其它无机试剂任选)。
的路线(其它无机试剂任选)。
您最近一年使用:0次
名校
解题方法
5 . 有机物的种类多,在日常生活中有重要的用途。请回答下列问题:_____ 。
(2)请用系统命名法命名有机物②_____ 。
(3)⑤与⑦发生共聚反应的化学方程式_____ 。
(4)属于非极性分子的是_____ (填序号)。
(5)⑥中基态氧原子的核外电子的空间运动状态有_____ 种。
(6)硼在成键时能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子价电子轨道表示式:_____ ,该过程形成的原子光谱为_____ (填“吸收”或“发射”)光谱。
①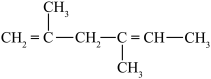 ;②
;②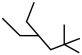 ;③
;③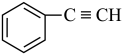 ;④
;④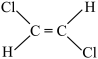 ;⑤
;⑤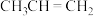 ;⑥
;⑥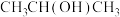 ;⑦
;⑦
(2)请用系统命名法命名有机物②
(3)⑤与⑦发生共聚反应的化学方程式
(4)属于非极性分子的是
(5)⑥中基态氧原子的核外电子的空间运动状态有
(6)硼在成键时能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子价电子轨道表示式:
您最近一年使用:0次
名校
6 . 锑(Sb)是银白色金属,广泛应用于电气、医药等领域。某科研小组从精炼铋烟尘(主要成分为 、
、 、
、 等)中提炼金属锑的流程如图所示:
等)中提炼金属锑的流程如图所示: 、
、 、
、 。
。
② 易水解生成两种氯氧锑沉淀
易水解生成两种氯氧锑沉淀 、
、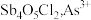 、
、 在上述情况下水解非常微弱。
在上述情况下水解非常微弱。
③ “还原熔炼”的主要反应为 ,熔炼过程中原料之间可能会形成泡渣而结块。
,熔炼过程中原料之间可能会形成泡渣而结块。
回答下列问题:
(1)基态 的价电子排布式为
的价电子排布式为_______ 。
(2)“水解”步骤发生的反应为 、
、 ,加入少量水时,
,加入少量水时, 的水解产物以
的水解产物以_______  填化学式
填化学式 为主;促进
为主;促进 转化为
转化为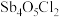 的措施有
的措施有_______ (任写一种)。
(3)“转化”步骤中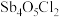 转化为
转化为 的化学方程式为
的化学方程式为_______ 。
(4)“还原熔炼”时碳的用量对锑回收率的影响如图 所示。碳用量超过
所示。碳用量超过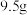 时,锑的回收率降低的原因可能是
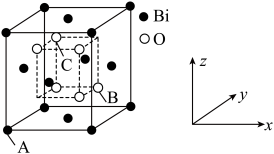
时,锑的回收率降低的原因可能是_______ 。 的立方晶胞结构如图所示
的立方晶胞结构如图所示 占据部分
占据部分 的四面体空隙
的四面体空隙 ,以
,以 点为原点建立分数坐标,已知
点为原点建立分数坐标,已知 点坐标为
点坐标为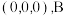 点坐标为
点坐标为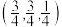 ,则
,则 点坐标为
点坐标为_______ 。晶胞边长为 ,则密度为
,则密度为_______ g cm-3(
cm-3( 的摩尔质量为
的摩尔质量为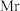 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
)
 、
、 、
、 等)中提炼金属锑的流程如图所示:
等)中提炼金属锑的流程如图所示: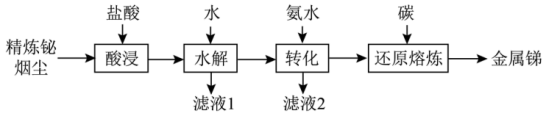
 、
、 、
、 。
。②
 易水解生成两种氯氧锑沉淀
易水解生成两种氯氧锑沉淀 、
、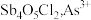 、
、 在上述情况下水解非常微弱。
在上述情况下水解非常微弱。③ “还原熔炼”的主要反应为
 ,熔炼过程中原料之间可能会形成泡渣而结块。
,熔炼过程中原料之间可能会形成泡渣而结块。回答下列问题:
(1)基态
 的价电子排布式为
的价电子排布式为(2)“水解”步骤发生的反应为
 、
、 ,加入少量水时,
,加入少量水时, 的水解产物以
的水解产物以 填化学式
填化学式 为主;促进
为主;促进 转化为
转化为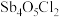 的措施有
的措施有(3)“转化”步骤中
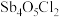 转化为
转化为 的化学方程式为
的化学方程式为(4)“还原熔炼”时碳的用量对锑回收率的影响如图
 所示。碳用量超过
所示。碳用量超过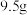 时,锑的回收率降低的原因可能是
时,锑的回收率降低的原因可能是
 的立方晶胞结构如图所示
的立方晶胞结构如图所示 占据部分
占据部分 的四面体空隙
的四面体空隙 ,以
,以 点为原点建立分数坐标,已知
点为原点建立分数坐标,已知 点坐标为
点坐标为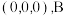 点坐标为
点坐标为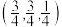 ,则
,则 点坐标为
点坐标为 ,则密度为
,则密度为 cm-3(
cm-3( 的摩尔质量为
的摩尔质量为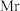 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
)
您最近一年使用:0次
昨日更新
|
52次组卷
|
2卷引用:广东省深圳市龙岗区龙城高级中学、深圳大学附属中学2023-2024学年高二下学期5月月考化学试题
名校
7 . 具有抗菌作用的白头翁素衍生物N的合成路线如图所示: R-HC=CH-R′;
R-HC=CH-R′;
(1)物质B的名称是_______ ,物质D所含官能团的名称是______ 。
(2)物质C的结构简式是_______ 。
(3)由H生成M的化学方程式为_______ ,反应类型为_______ 。
(4)F的同分异构体中,符合下列条件的有_______ 种(不包含立体异构)。_______ 。
(5)写出用乙烯和乙醛为原料制备化合物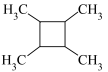 的合成路线(其他试剂任选):
的合成路线(其他试剂任选):_______ 。
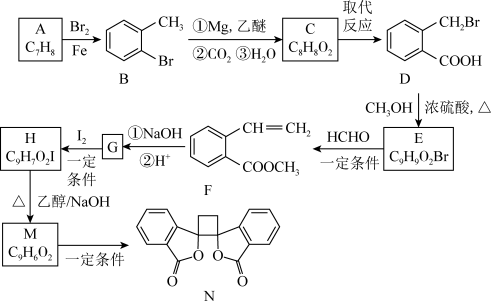
 R-HC=CH-R′;
R-HC=CH-R′;ii.R-HC=CH-R′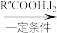
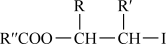 ;
;
iii.R-HC=CH-R′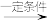
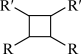 (以上R、R′、R′′代表氢、烷基或芳香烃基等)。
(以上R、R′、R′′代表氢、烷基或芳香烃基等)。
(1)物质B的名称是
(2)物质C的结构简式是
(3)由H生成M的化学方程式为
(4)F的同分异构体中,符合下列条件的有
①分子中含有苯环,且苯环上有两个取代基;②分子存在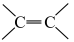 ;③能与碳酸氢钠溶液反应生成CO2。
;③能与碳酸氢钠溶液反应生成CO2。
(5)写出用乙烯和乙醛为原料制备化合物
 的合成路线(其他试剂任选):
的合成路线(其他试剂任选):
您最近一年使用:0次
名校
解题方法
8 . I.化学反应常伴随热效应,某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测定,用公式Q= cρV总· T计算获得,用如图所示装置进行中和热的测定实验。
T计算获得,用如图所示装置进行中和热的测定实验。___________ ,碎泡沫塑料的作用是___________ 。
(2)取浓度分别为0.5000mol·L-1的NaOH溶液和0.5500mol·L-1的盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为___________ J(c和ρ分别取4.18J·g-1·℃-1和1.0g·mL-1,忽略水以外各物质吸收的热量)。
Ⅱ.已知: (
( )遇水极易水解生成HCl和H2SO4;可利用中和滴定法确定制备的磺酰氯
)遇水极易水解生成HCl和H2SO4;可利用中和滴定法确定制备的磺酰氯 的纯度。
的纯度。
(3)滴定前,滴定管的正确操作是:检漏→蒸馏水洗涤→___________ →开始滴定。
A.装入滴定液至零刻度以上
B.调整滴定液液面至零刻度或零刻度以下
C.排除气泡
D.用滴定液润洗2至3次
E.记录起始读数
(4)取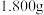 产品,加入到
产品,加入到

 溶液中加热充分水解,冷却后加蒸馏水稀释至
溶液中加热充分水解,冷却后加蒸馏水稀释至 ,取
,取 溶液于锥形瓶中,滴加2滴甲基橙,用
溶液于锥形瓶中,滴加2滴甲基橙,用 盐酸标准溶液滴定至终点,重复实验,结果记录如下:
盐酸标准溶液滴定至终点,重复实验,结果记录如下:
达到滴定终点的现象是___________ ,产品的纯度为___________ 。
(5)下列操作会导致SO2Cl2纯度测定结果偏低的是___________。
 T计算获得,用如图所示装置进行中和热的测定实验。
T计算获得,用如图所示装置进行中和热的测定实验。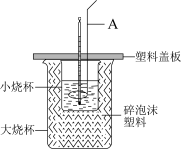
(2)取浓度分别为0.5000mol·L-1的NaOH溶液和0.5500mol·L-1的盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为
Ⅱ.已知:
 (
( )遇水极易水解生成HCl和H2SO4;可利用中和滴定法确定制备的磺酰氯
)遇水极易水解生成HCl和H2SO4;可利用中和滴定法确定制备的磺酰氯 的纯度。
的纯度。(3)滴定前,滴定管的正确操作是:检漏→蒸馏水洗涤→
A.装入滴定液至零刻度以上
B.调整滴定液液面至零刻度或零刻度以下
C.排除气泡
D.用滴定液润洗2至3次
E.记录起始读数
(4)取
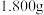 产品,加入到
产品,加入到

 溶液中加热充分水解,冷却后加蒸馏水稀释至
溶液中加热充分水解,冷却后加蒸馏水稀释至 ,取
,取 溶液于锥形瓶中,滴加2滴甲基橙,用
溶液于锥形瓶中,滴加2滴甲基橙,用 盐酸标准溶液滴定至终点,重复实验,结果记录如下:
盐酸标准溶液滴定至终点,重复实验,结果记录如下:| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗盐酸标准溶液体积/mL | 10.02 | 9.98 | 11.12 |
(5)下列操作会导致SO2Cl2纯度测定结果偏低的是___________。
| A.滴定前读数正确,滴定后俯视读数 |
| B.滴定时不慎将盐酸标准溶液滴到锥形瓶外 |
| C.滴定前无气泡,滴定达终点时发现滴定管尖嘴内有气泡出现 |
| D.装盐酸标准溶液的滴定管用蒸馏水洗后没有润洗 |
您最近一年使用:0次
解题方法
9 . 建设“美丽中国”首先要做好环境保护与治理.氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题.
Ⅰ.汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图所示:______ (填“吸收”或“放出”)______ kJ热量,1mol 和1mol
和1mol 的总能量
的总能量______ (填“大于”“等于”或“小于”)2mol 的总能量。
的总能量。
Ⅱ.某科研机构设计了几种如下转化氮氧化物的方案.请回答下列问题:
方案1:利用CO在催化剂条件下还原: 。向甲、乙两个容积均为2L的恒容密闭容器中分别充入2molNO2(g)和3molCO(g),分别在不同温度下反应.反应过程中测得CO2物质的量如下表:
。向甲、乙两个容积均为2L的恒容密闭容器中分别充入2molNO2(g)和3molCO(g),分别在不同温度下反应.反应过程中测得CO2物质的量如下表:
(2)①甲容器中,NO2的平衡转化率为______ ;
②温度为T1℃时,0~8min内用CO表示的平均反应速率v(CO)=______ mol·L-1·min-1;
③10min时,反应速率:甲______ (填“>”“<”或“=”)乙,其判断依据是______ ;
(3)在恒温、恒容密闭容器中进行上述反应,下列不能说明该反应一定达到平衡状态的是______ (填标号).
A.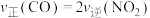 B.混合气体的密度不变
B.混合气体的密度不变
C.容器内气体颜色不变 D.气体平均相对分子质量不变
E.容器内
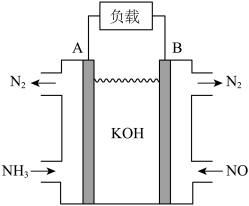
方案2:利用NH3可消除大气污染物NO,可将反应设计为原电池提供电能,如图所示;______ (填“正”或“负”)极;该电池的总反应式为______ 。
Ⅰ.汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图所示:
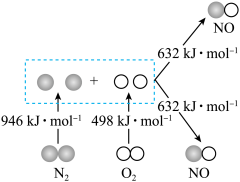
 和1mol
和1mol 的总能量
的总能量 的总能量。
的总能量。Ⅱ.某科研机构设计了几种如下转化氮氧化物的方案.请回答下列问题:
方案1:利用CO在催化剂条件下还原:
 。向甲、乙两个容积均为2L的恒容密闭容器中分别充入2molNO2(g)和3molCO(g),分别在不同温度下反应.反应过程中测得CO2物质的量如下表:
。向甲、乙两个容积均为2L的恒容密闭容器中分别充入2molNO2(g)和3molCO(g),分别在不同温度下反应.反应过程中测得CO2物质的量如下表:容器 | 甲(T1/℃) | 乙(T2/℃) | ||||||||
反应时间/min | 0 | 4 | 8 | 10 | 20 | 0 | 8 | 10 | 20 | 21 |
n(CO2)/mol | 0 | 0.8 | 1.2 | 1.2 | 1.2 | 0 | 1.0 | 1.2 | 2.0 | 2.0 |
(2)①甲容器中,NO2的平衡转化率为
②温度为T1℃时,0~8min内用CO表示的平均反应速率v(CO)=
③10min时,反应速率:甲
(3)在恒温、恒容密闭容器中进行上述反应,下列不能说明该反应一定达到平衡状态的是
A.
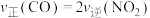 B.混合气体的密度不变
B.混合气体的密度不变C.容器内气体颜色不变 D.气体平均相对分子质量不变
E.容器内

方案2:利用NH3可消除大气污染物NO,可将反应设计为原电池提供电能,如图所示;
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题:
(1)下列状态的钙中,电离最外层一个电子所需能量最大的是_____(填标号);
(2)写出基态 离子的M层电子排布式
离子的M层电子排布式_____ 。
(3)实验室常用 检验
检验 ,
, 中
中 的配位数为
的配位数为_____ , 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为_____ 杂化。
(4)已知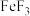 的熔点(1000℃)显著高于
的熔点(1000℃)显著高于 的熔点(306C),原因是
的熔点(306C),原因是_____ 。
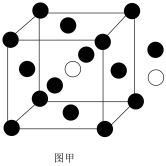
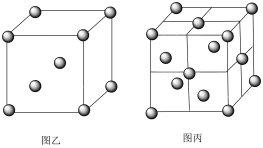
(5)铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图甲所示,写出该反应的化学方程式:_____ 。 _____ ,图乙中铁原子沿着晶胞体对角线相切,图丙中铁原子沿着晶胞面对角线相切。若两种晶体中铁原子半径相同,则两种铁晶体中密度较高的是_____ 。(填“图乙”或“图丙”)
(1)下列状态的钙中,电离最外层一个电子所需能量最大的是_____(填标号);
A. 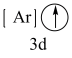 | B. 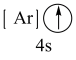 | C. 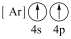 | D. 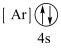 |
(2)写出基态
 离子的M层电子排布式
离子的M层电子排布式(3)实验室常用
 检验
检验 ,
, 中
中 的配位数为
的配位数为 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为(4)已知
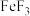 的熔点(1000℃)显著高于
的熔点(1000℃)显著高于 的熔点(306C),原因是
的熔点(306C),原因是(5)铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图甲所示,写出该反应的化学方程式:
您最近一年使用:0次



