名校
解题方法
1 . 随着小型电子设备以及新能源汽车产业的蓬勃发展,退役锂离子电池数量逐年递增,废旧锂离子电池的回收成为目前新能源产业重要的发展方向,科研人员通过对大量废旧钴酸锂( )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
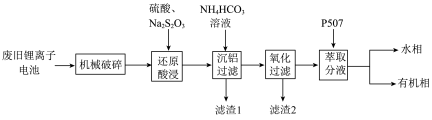
表1 粉料金属成分质量分数%
表2 部分阳离子以氢氧化物形式沉淀时溶液的
已知:Co(III)有较强氧化性, 有较强还原性。
有较强还原性。
(1)机械破碎的目的是_______
(2)还原酸浸的主要反应中 和
和 的物质的量之比为
的物质的量之比为_______
(3)沉铝操作中,加入 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分_______ 、_______ 。
(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式_______ ;实际生产中,随着反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大,可能的原因为:① 氧化成
氧化成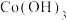 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②_______
(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为_______ 左右。

(6)该工艺中,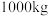 废料生产得到
废料生产得到 的质量为
的质量为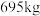 ,则该工艺的产率为
,则该工艺的产率为_______ (保留2位有效数字)。
 )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
表1 粉料金属成分质量分数%
| Co | Li | Al | Cu | Fe | Mn | Ni |
| 23.6 | 3.4 | 3.2 | 0.84 | 2.8 | 1.1 | 0.34 |

| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 | 4.7 |
完全沉淀的 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 | 6.7 |
 有较强还原性。
有较强还原性。(1)机械破碎的目的是
(2)还原酸浸的主要反应中
 和
和 的物质的量之比为
的物质的量之比为(3)沉铝操作中,加入
 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的
 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式 氧化成
氧化成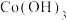 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相
 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为
(6)该工艺中,
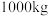 废料生产得到
废料生产得到 的质量为
的质量为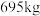 ,则该工艺的产率为
,则该工艺的产率为
您最近一年使用:0次
2023-12-05更新
|
869次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期第四次月考理科综合试卷
解题方法
2 . 将CO2转化为甲烷、甲醇、甲酸等有机物是实现“碳中和”重要途径。在催化下CO2加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅰ发生。
Ⅰ.CO2(g)+H2(g) HCOOH(g) ΔH1=-30.9kJ·mol-1
HCOOH(g) ΔH1=-30.9kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
回答下列问题:
(1)已知298K时,部分物质的相对能量如下表所示,则CO2(g)的相对能量为_____ kJ·mol-1。
(2)已知气体A的压强转化率表示为α(A)=(1- )×100%,p0为A的初始分压,p1为某时刻A的分压。保持323K、恒温恒压,CO2(g)、H2(g)投料比为1:1,CO2初始分压分别为p0-aMPa、p0-bMPa和p0-cMPa(p0-a<p0-bb<P0-c)时,测得α(CO2)与时间t的关系如图1所示。
)×100%,p0为A的初始分压,p1为某时刻A的分压。保持323K、恒温恒压,CO2(g)、H2(g)投料比为1:1,CO2初始分压分别为p0-aMPa、p0-bMPa和p0-cMPa(p0-a<p0-bb<P0-c)时,测得α(CO2)与时间t的关系如图1所示。_____ (填写选项序号)。
a.p0-aMpa b.p0-bMpa c.p0-cMPa
②在323K,CO2初始分压为p0-bMPa时,平衡后,p(HCOOH)=4p(CO),则反应Ⅰ的Kp=_____ (MPa)-1(用含p0-b的式子表示)。
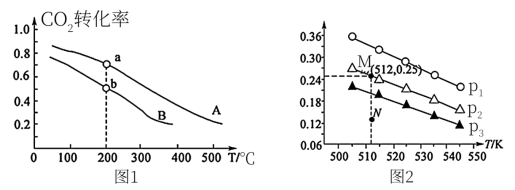
(3)反应CO2(g)+H2(g) CO(g)+H2O(g)的正、逆反应平衡常数K随温度变化的曲线如图2所示。
CO(g)+H2O(g)的正、逆反应平衡常数K随温度变化的曲线如图2所示。_____ (填“K正”或“K逆”)随温度变化的曲线。
②a点时,v正_____ v逆(填“一定等于”或“不一定等于”)。
③c点时,x=_____ 。
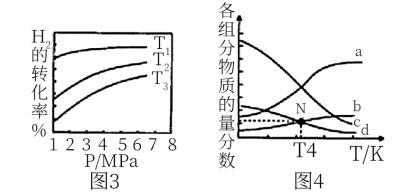
(4)0.5MPa下,将n(H2):n(CO2)=1:1的混合气体以一定流速通过装有催化剂的反应器,测得CO2的转化率、HCOOH或CO的选择性[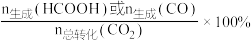 ]以及HCOOH的产率(CO2的转化率×HCOOH的选择性)随温度的变化如图3所示
]以及HCOOH的产率(CO2的转化率×HCOOH的选择性)随温度的变化如图3所示_____ (填“HCOOH”或“CO”)的选择性随温度的变化。270°C时,对应CO2的转化率为_____ ;在210~250°C之间,HCOOH的产率增大的原因是_____ 。
Ⅰ.CO2(g)+H2(g)
 HCOOH(g) ΔH1=-30.9kJ·mol-1
HCOOH(g) ΔH1=-30.9kJ·mol-1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2回答下列问题:
(1)已知298K时,部分物质的相对能量如下表所示,则CO2(g)的相对能量为
| 物质 | H2(g) | HCOOH(g) | H2O(g) | CO(g) |
| 相对能量/(kJ·mol-1) | 0 | -423.9 | -242 | -110 |
 )×100%,p0为A的初始分压,p1为某时刻A的分压。保持323K、恒温恒压,CO2(g)、H2(g)投料比为1:1,CO2初始分压分别为p0-aMPa、p0-bMPa和p0-cMPa(p0-a<p0-bb<P0-c)时,测得α(CO2)与时间t的关系如图1所示。
)×100%,p0为A的初始分压,p1为某时刻A的分压。保持323K、恒温恒压,CO2(g)、H2(g)投料比为1:1,CO2初始分压分别为p0-aMPa、p0-bMPa和p0-cMPa(p0-a<p0-bb<P0-c)时,测得α(CO2)与时间t的关系如图1所示。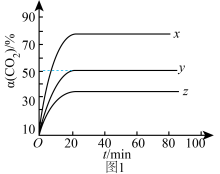
a.p0-aMpa b.p0-bMpa c.p0-cMPa
②在323K,CO2初始分压为p0-bMPa时,平衡后,p(HCOOH)=4p(CO),则反应Ⅰ的Kp=
(3)反应CO2(g)+H2(g)
 CO(g)+H2O(g)的正、逆反应平衡常数K随温度变化的曲线如图2所示。
CO(g)+H2O(g)的正、逆反应平衡常数K随温度变化的曲线如图2所示。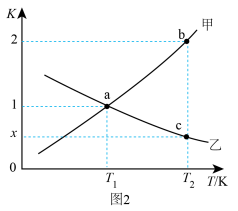
②a点时,v正
③c点时,x=
(4)0.5MPa下,将n(H2):n(CO2)=1:1的混合气体以一定流速通过装有催化剂的反应器,测得CO2的转化率、HCOOH或CO的选择性[
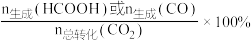 ]以及HCOOH的产率(CO2的转化率×HCOOH的选择性)随温度的变化如图3所示
]以及HCOOH的产率(CO2的转化率×HCOOH的选择性)随温度的变化如图3所示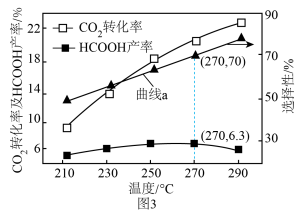
您最近一年使用:0次
2022高三·全国·专题练习
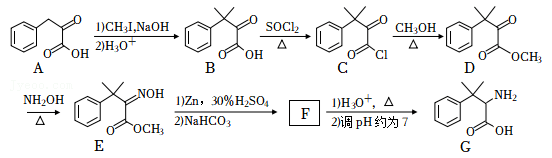
3 . 化合物G可用于药用多肽的结构修饰,其人工合成路线如下:_______ 。
(2)B→C的反应类型为_______ 。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______ 。
①分子中含有4种不同化学环境的氢原子;②碱性条件水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
(4)F的分子式为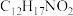 ,其结构简式为
,其结构简式为_______ 。
(5)已知: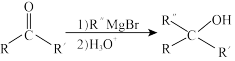 (R和R'表示烃基或氢,R''表示烃基);
(R和R'表示烃基或氢,R''表示烃基);
(2)B→C的反应类型为
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①分子中含有4种不同化学环境的氢原子;②碱性条件水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
(4)F的分子式为
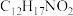 ,其结构简式为
,其结构简式为(5)已知:
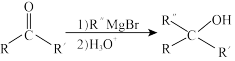 (R和R'表示烃基或氢,R''表示烃基);
(R和R'表示烃基或氢,R''表示烃基);
写出以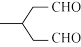 和
和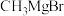 为原料制备
为原料制备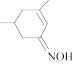 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
您最近一年使用:0次
2022-07-21更新
|
10753次组卷
|
18卷引用:宁夏回族自治区银川一中2024届高三下学期考前热身训练化学试卷2
宁夏回族自治区银川一中2024届高三下学期考前热身训练化学试卷2(已下线)专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编江苏省2022年普通高中学业水平选择性考试(已下线)2022年江苏卷高考真题变式题14-17(已下线)热点情景汇编-专题十一 有机推断中的新发展(已下线)专题32 有机推断及合成-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)江苏省2022年普通高中学业水平选择性考试变式题(有机综合题)江苏省南京市第二十九中学2022-2023学年高二下学期3月月考化学试题(已下线)回归教材重难点13 熟悉有机化学“模型”-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)第22练 有机合成与推断题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)广东省梅州市丰顺县丰顺中学2022-2023学年高三上学期1月期末考试化学试题(已下线)专题16 有机合成与推断-2023年高考化学真题题源解密(新高考专用)(已下线)考点40 有机合成(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省南阳市第一中学校2023-2024学年高三上学期开学考试化学试题河北省涞水北雄高级中学2022-2023学年高三下学期3月月考化学试题江苏省连云港市七校2023-2024学年高二下学期期中联考化学试题
4 . 二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I.CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
II.2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
500 K时,在2 L恒容密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则下列说法不正确的是
I.CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)II.2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)500 K时,在2 L恒容密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则下列说法不正确的是
| A.0~4 min,反应I的v(H2)=0.8 mol·L-1·min-1 |
| B.反应II中CH3OH的转化率为80% |
| C.反应I的平衡常数K=6.25 |
| D.容器总压强保持不变,可证明反应体系到达平衡状态 |
您最近一年使用:0次
名校
解题方法
5 . 某溶液中可能含有Na+、NH 、SO
、SO 、SO
、SO 、Cl-、Fe2+、Fe3+、CO
、Cl-、Fe2+、Fe3+、CO 中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:
中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:
①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,过滤
②向①中的滤液中加入足量的NaOH溶液,有沉淀产生,微热,有气体产生
下列说法正确的是
 、SO
、SO 、SO
、SO 、Cl-、Fe2+、Fe3+、CO
、Cl-、Fe2+、Fe3+、CO 中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:
中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,过滤
②向①中的滤液中加入足量的NaOH溶液,有沉淀产生,微热,有气体产生
下列说法正确的是
A.无法确定原溶液中是否存在SO |
| B.是否存在Na+需要通过焰色反应来确定 |
C.CO 肯定不存在,Fe2+、Fe3+至少有一种 肯定不存在,Fe2+、Fe3+至少有一种 |
D.溶液中存在NH 、SO 、SO 、Cl-、Fe2+ 、Cl-、Fe2+ |
您最近一年使用:0次
2021-02-04更新
|
2512次组卷
|
5卷引用:宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题(尖子班)
6 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:
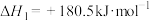

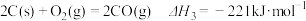
若某反应的平衡常数表达式为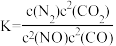 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
(2) 在一定条件下可发生分解:
在一定条件下可发生分解: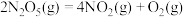 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是_____ (填字母)。
a. 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c.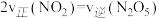 d. 气体的密度保持不变
d. 气体的密度保持不变
(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(3)将 和
和 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
①a、b两点化学反应速率分别用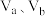 ,表示,则
,表示,则
_____  (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②列出a点对应的平衡常数表达式K=____________________ 。
(4)在1.0 L恒容密闭容器中投入1 mol 和2.75 mol
和2.75 mol  发生反应:CO2(g) + 3H2(g)
发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________ 。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为
D.在 及512 K时,图中N点
及512 K时,图中N点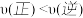
(5) 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)  C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即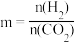 。
。
① 图3中投料比相同,温度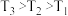 ,则该反应的焓变
,则该反应的焓变
_______ 0(填 )。
)。
② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________ (填化学式)。
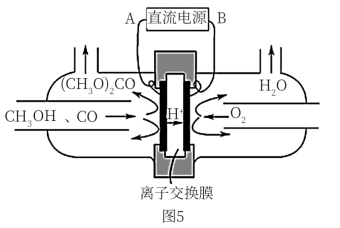
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为______ (填“阳膜”、“阴膜”),阳极的电极反应式为_______________________________________
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:

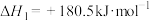

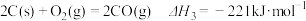
若某反应的平衡常数表达式为
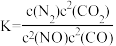 ,则此反应的热化学方程式为
,则此反应的热化学方程式为(2)
 在一定条件下可发生分解:
在一定条件下可发生分解: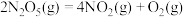 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是a.
 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化c.
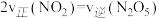 d. 气体的密度保持不变
d. 气体的密度保持不变(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g) (3)将
 和
和 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
①a、b两点化学反应速率分别用
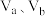 ,表示,则
,表示,则
 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)②列出a点对应的平衡常数表达式K=
(4)在1.0 L恒容密闭容器中投入1 mol
 和2.75 mol
和2.75 mol  发生反应:CO2(g) + 3H2(g)
发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为

D.在
 及512 K时,图中N点
及512 K时,图中N点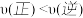

(5)
 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)  C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即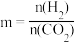 。
。① 图3中投料比相同,温度
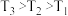 ,则该反应的焓变
,则该反应的焓变
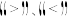 )。
)。② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为

您最近一年使用:0次
19-20高二·浙江·期末
名校
解题方法
7 . 某无色溶液由K+、Fe3+、Ag+、Al3+、 、
、 、
、 、
、 、
、 、
、 中的若干种组成。取适量该溶液进行如下实验:
中的若干种组成。取适量该溶液进行如下实验:
①加入过量HBr,生成无色气体甲和淡黄色沉淀甲;
②取①所得的溶液,加入过量 溶液,生成无色气体乙和白色沉淀乙;
溶液,生成无色气体乙和白色沉淀乙;
③取②所得的溶液,加入过量 ,生成无色气体丙和白色沉淀丙,下列说法正确的是
,生成无色气体丙和白色沉淀丙,下列说法正确的是
 、
、 、
、 、
、 、
、 、
、 中的若干种组成。取适量该溶液进行如下实验:
中的若干种组成。取适量该溶液进行如下实验:①加入过量HBr,生成无色气体甲和淡黄色沉淀甲;
②取①所得的溶液,加入过量
 溶液,生成无色气体乙和白色沉淀乙;
溶液,生成无色气体乙和白色沉淀乙;③取②所得的溶液,加入过量
 ,生成无色气体丙和白色沉淀丙,下列说法正确的是
,生成无色气体丙和白色沉淀丙,下列说法正确的是| A.气体甲的成分有三种可能性 |
B.生成沉淀甲的离子方程式为: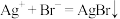 |
C.该溶液中可能存在 和 和 一定不存在Fe3+、 一定不存在Fe3+、 和Al3+ 和Al3+ |
D.为了确定该溶液中是否存在 ,可以直接用盐酸和 ,可以直接用盐酸和 溶液来检验 溶液来检验 |
您最近一年使用:0次
13-14高三下·福建莆田·阶段练习
解题方法
8 . 氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有A12O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:A1N+NaOH+H2O=NaAlO2+NH3↑)
【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
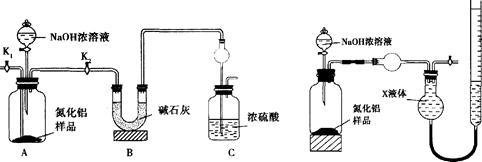
(1)左装置图中球形干燥管的作用是_______________ 。
(2)完成以下实验步骤:组装好实验装置,首先__________ ,再加入实验药品。接下来的实验操作是________________ ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_____ 。
(3)由于装置存在缺陷,导致测定结果偏高。请提出改进意见_____________ 。
【方案2】用右上装置图测定mg样品中AlN的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是_______ 。
a.CCl4b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况)。则AlN的质量分数是_____________ 。
【方案3】按下图步骤测定样品中A1N的纯度:

(6)步骤②生成沉淀的离子方程式为________________ 。
(7)若在步骤③中未洗涤,测定结果将_____ (_填“偏高”、“偏低”或“无影响”)。
【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)左装置图中球形干燥管的作用是
(2)完成以下实验步骤:组装好实验装置,首先
(3)由于装置存在缺陷,导致测定结果偏高。请提出改进意见
【方案2】用右上装置图测定mg样品中AlN的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是
a.CCl4b.H2O c.NH4Cl溶液 d.

(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况)。则AlN的质量分数是
【方案3】按下图步骤测定样品中A1N的纯度:

(6)步骤②生成沉淀的离子方程式为
(7)若在步骤③中未洗涤,测定结果将
您最近一年使用:0次
2019-01-30更新
|
1340次组卷
|
5卷引用:2016届宁夏银川二中高三三模理综化学试卷
2016届宁夏银川二中高三三模理综化学试卷(已下线)2014届福建省莆田市高三3月质量检测化学试卷(已下线)2015届山西省忻州第一中学高三上学期期中考试化学试卷2016届福建省仙游一中高三上学期10月月考化学试卷(已下线)第29讲 化学实验方案的设计与评价-2021年高考化学一轮复习名师精讲练
9 . 把一块镁铝合金投入到1mol/L 盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图所示。下列说法中不正确的是
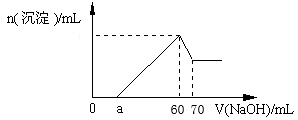

| A.生成Al(OH)3沉淀的最大质量为0.78g |
| B.加入70ml NaOH 时溶液呈碱性 |
C.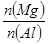 的最大值为1.5 的最大值为1.5 |
D.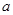 的取值范围为0≤ a<45mL 的取值范围为0≤ a<45mL |
您最近一年使用:0次



