1 . 常温下,PdCO3和Pd(OH)2的沉淀溶解平衡曲线如图所示。下列说法正确的是
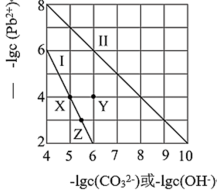
| A.向Z点对应溶液中加入适量的NaOH溶液,有可能得到X点对应溶液 |
| B.Y点对应的PdCO3分散系中,v(溶解)>v(沉淀),固体仍在溶解 |
C.PbCO3(s)+2OH-(aq) Pb(OH)2(s)+ Pb(OH)2(s)+ K=0.01 K=0.01 |
| D.由两者的Ksp可知,Pd(OH)2的溶解度更小 |
您最近一年使用:0次
解题方法
2 . 肼为二元弱碱,在水中的电离方式与氨相似。常温下,向一定浓度肼 水溶液中通入
水溶液中通入 (忽略溶液体积变化),测得
(忽略溶液体积变化),测得 与
与 [X为
[X为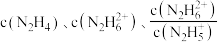 ]的变化关系如图所示。下列说法正确的是
]的变化关系如图所示。下列说法正确的是
 水溶液中通入
水溶液中通入 (忽略溶液体积变化),测得
(忽略溶液体积变化),测得 与
与 [X为
[X为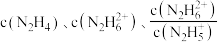 ]的变化关系如图所示。下列说法正确的是
]的变化关系如图所示。下列说法正确的是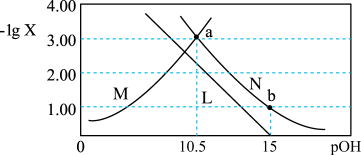
A.曲线N表示 与 与 的变化关系 的变化关系 |
B.常温下,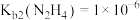 |
C.a点溶液中: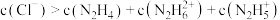 |
D.b点溶液中: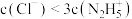 |
您最近一年使用:0次
2024-04-16更新
|
299次组卷
|
2卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
名校
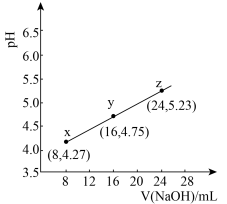
3 . 缓冲溶液指的是由弱酸及其盐组成的混合溶液。缓冲溶液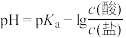 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸(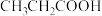 )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,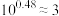 。
。
下列叙述正确的是
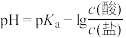 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸(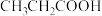 )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,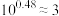 。
。下列叙述正确的是
A.常温下,丙酸电离常数 的数量级为 的数量级为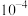 |
| B.在x、y、z点溶液中,缓冲能力最强的是z点 |
C.在z点溶液中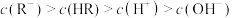 |
| D.若用同体积同浓度HNO2溶液替代HR溶液,则图中曲线竖直上移 |
您最近一年使用:0次
2024-04-05更新
|
75次组卷
|
2卷引用:四川省成都电子科技大学实验中学2023-2024学年高二上学期期末模拟化学试题
4 . 实验室用废铁屑制取无水氯化铁并测其纯度。实验方案如下:
Ⅰ. 制备
制备
①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是_______ 。
(2)控制温度在40~50℃的原因是_______ 。
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为_______ 。
Ⅱ.无水 制备
制备
已知 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。
(4)按图装置进行实验。锥形瓶中生成无水 的总化学方程式为
的总化学方程式为_______ ;仪器A的作用是_______ 。
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用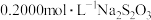 溶液滴定(
溶液滴定(
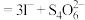 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。
①所制产品的纯度为_______ (以无水 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);
②所制产品中可能含有 杂质,检验
杂质,检验 的试剂为
的试剂为_______ (填化学式)溶液;产生 的原因可能是
的原因可能是_______ 。
Ⅰ.
 制备
制备①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是
(2)控制温度在40~50℃的原因是
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为
Ⅱ.无水
 制备
制备已知
 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。(4)按图装置进行实验。锥形瓶中生成无水
 的总化学方程式为
的总化学方程式为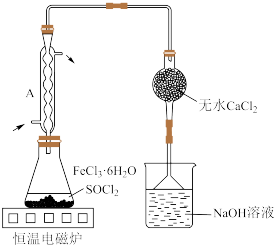
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用
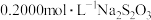 溶液滴定(
溶液滴定(
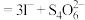 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。①所制产品的纯度为
 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);②所制产品中可能含有
 杂质,检验
杂质,检验 的试剂为
的试剂为 的原因可能是
的原因可能是
您最近一年使用:0次
名校
解题方法
5 . 甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。
已知涉及的反应如下:
反应Ⅰ:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1
CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1
反应Ⅱ:CO(g)+ H2O(g) CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
反应Ⅲ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1
CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1
回答下列问题:
(1)ΔH2=___________ kJ·mol-1。
(2)在360°C时,在固定容积的容器中充入一定量的CO进行上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随 变化的情况如图1所示。
变化的情况如图1所示。

①图中表示H2转化率、CH4产率变化的曲线分别是___________ 、___________ (填标号), A、C两点 的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是
的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是___________ 。
②一定温度下,向恒容容器内充入3mol H2和1molCO,初始压强为4p0,发生上述3个反应,达到平衡时CO的分压为p1,CO2的分压为p2,则CH4的选择性=___________ [CH4的选择性=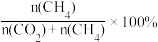 ,用p0,p1,p2表示,下同],反应Ⅱ的Kp=
,用p0,p1,p2表示,下同],反应Ⅱ的Kp=___________ (用分压表示,分压=总压×物质的量分数)。
(3)已知常温下,CaCO3的溶度积常数为Ksp,H2CO3的二级电离常数为Ka2。CaCO3溶于水除了沉淀溶解平衡,还存在碳酸根的水解(忽略二级水解)。则常温下,CaCO3的实际溶解度比理论值___________ (填“大”或者“小”)。若溶液pH已知,则钙离子的实际浓度为___________ mol/L[用含c(H+),Ksp,Ka2的式子表达]。
已知涉及的反应如下:
反应Ⅰ:CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1
CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1反应Ⅱ:CO(g)+ H2O(g)
 CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2反应Ⅲ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1
CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1回答下列问题:
(1)ΔH2=
(2)在360°C时,在固定容积的容器中充入一定量的CO进行上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随
 变化的情况如图1所示。
变化的情况如图1所示。
①图中表示H2转化率、CH4产率变化的曲线分别是
 的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是
的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是②一定温度下,向恒容容器内充入3mol H2和1molCO,初始压强为4p0,发生上述3个反应,达到平衡时CO的分压为p1,CO2的分压为p2,则CH4的选择性=
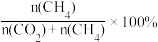 ,用p0,p1,p2表示,下同],反应Ⅱ的Kp=
,用p0,p1,p2表示,下同],反应Ⅱ的Kp=(3)已知常温下,CaCO3的溶度积常数为Ksp,H2CO3的二级电离常数为Ka2。CaCO3溶于水除了沉淀溶解平衡,还存在碳酸根的水解(忽略二级水解)。则常温下,CaCO3的实际溶解度比理论值
您最近一年使用:0次
名校
解题方法
6 . 将1.52 g铜镁合金完全溶解于50 mL密度为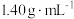 、质量分数为63%的浓硝酸中,得到
、质量分数为63%的浓硝酸中,得到 和
和 的混合气体0.05 mol,向反应后的溶液中加入
的混合气体0.05 mol,向反应后的溶液中加入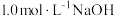 溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
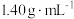 、质量分数为63%的浓硝酸中,得到
、质量分数为63%的浓硝酸中,得到 和
和 的混合气体0.05 mol,向反应后的溶液中加入
的混合气体0.05 mol,向反应后的溶液中加入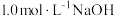 溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是| A.该合金中铜与镁的物质的量之比是2:1 |
B.该浓硝酸中 的物质的量浓度是 的物质的量浓度是 |
C. 和 和 的混合气体中, 的混合气体中, 的体积分数是20% 的体积分数是20% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是660 mL |
您最近一年使用:0次
7 . 以红土镍矿 主要成分为
主要成分为 、
、 、
、 、
、 和
和 等
等 为原料制备
为原料制备 的工艺流程如图:
的工艺流程如图:
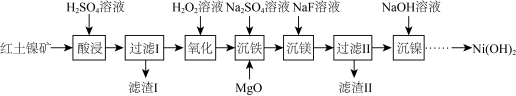
(1)“酸浸”时,加快化学反应速率的措施_______  写一条即可
写一条即可 ,滤渣Ⅰ的成分为
,滤渣Ⅰ的成分为_______  填化学式
填化学式 。
。
(2)“氧化”时, 发生反应的离子方程式为
发生反应的离子方程式为_______ ,若用 代替
代替 溶液,使
溶液,使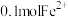 转化为
转化为 ,则需
,则需 至少为
至少为_______  。
。
(3) 的作用是调节溶液
的作用是调节溶液 使
使 沉淀,根据下表的数据,则调节溶液
沉淀,根据下表的数据,则调节溶液 的范围是
的范围是_______ 。
(4)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是_______ 。
(5)金属 可以与
可以与 、
、 形成一种化合物M,M是一种新型超导体,它的临界温度为
形成一种化合物M,M是一种新型超导体,它的临界温度为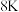 。已知
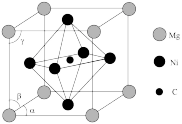
。已知 的晶胞
的晶胞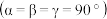 结构如图所示,则
结构如图所示,则 的化学式为
的化学式为_______ 。原子A和B的位置分别为(0,0,0),(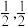 ,0),原子C的位置为
,0),原子C的位置为_______ 。 用坐标表示
用坐标表示
 主要成分为
主要成分为 、
、 、
、 、
、 和
和 等
等 为原料制备
为原料制备 的工艺流程如图:
的工艺流程如图:
(1)“酸浸”时,加快化学反应速率的措施
 写一条即可
写一条即可 ,滤渣Ⅰ的成分为
,滤渣Ⅰ的成分为 填化学式
填化学式 。
。(2)“氧化”时,
 发生反应的离子方程式为
发生反应的离子方程式为 代替
代替 溶液,使
溶液,使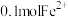 转化为
转化为 ,则需
,则需 至少为
至少为 。
。(3)
 的作用是调节溶液
的作用是调节溶液 使
使 沉淀,根据下表的数据,则调节溶液
沉淀,根据下表的数据,则调节溶液 的范围是
的范围是| 金属离子 |  |  |  |  |
开始沉淀的 | 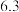 |  |  |  |
沉淀完全的 |  |  | 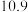 |  |
(5)金属
 可以与
可以与 、
、 形成一种化合物M,M是一种新型超导体,它的临界温度为
形成一种化合物M,M是一种新型超导体,它的临界温度为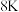 。已知
。已知 的晶胞
的晶胞 结构如图所示,则
结构如图所示,则 的化学式为
的化学式为 ,0),原子C的位置为
,0),原子C的位置为 用坐标表示
用坐标表示

您最近一年使用:0次
名校
解题方法
8 .  可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
 可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是| A.氧化产物与还原产物物质的量之比为3:2 |
B.反应中有4.48 L  被氧化 被氧化 |
C.转移电子数为1.2 |
D.原混合气体中NO、 物质的量之比为3:7或4:1 物质的量之比为3:7或4:1 |
您最近一年使用:0次
2022-12-07更新
|
1511次组卷
|
4卷引用:四川省成都市第七中学2022-2023学年高一上学期12月月考化学试题
9 . 完成下列问题
(1)下列四个合成反应路线的设计哪些是错误的?(请写出错误路线的编号) 和
和 从大到小排序:
从大到小排序:_________


_________ _________ _________ _________ _________
(1)下列四个合成反应路线的设计哪些是错误的?(请写出错误路线的编号)
①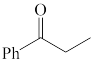

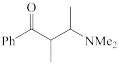
②


③

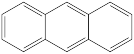
④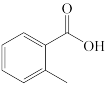


 和
和 从大到小排序:
从大到小排序:



(a)  (b)
(b) 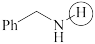 (c)
(c) 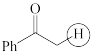 (d)
(d) 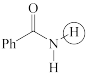 (e)
(e) 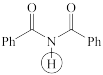
A. B.
B. C.
C.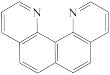 D.
D.
A.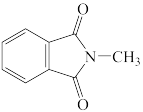 B.
B. C.
C. D.
D.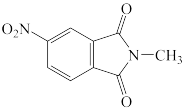
A. 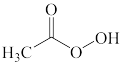 B.
B. 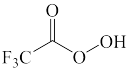 C.
C. 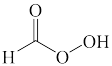 D.
D.  E.
E.  F.
F. 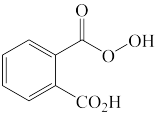
①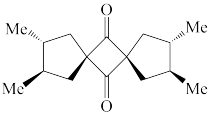 ②
② ③
③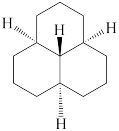 ④
④ ⑤
⑤
⑥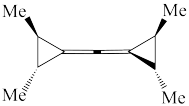 ⑦
⑦ ⑧
⑧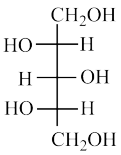 ⑨
⑨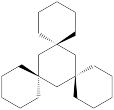 ⑩
⑩
您最近一年使用:0次
名校
解题方法
10 . 科学家发现固体电解质Li3SBF4快离子导体具有良好的导电能力,为锂离子电池的发展做出了重要贡献。回答下列问题:
(1)基态F原子的价电子排布图为_______ 。B和F均为第2周期元素,在第2周期元素中,第一电离能介于B与F之间的元素有_______ 种。
(2)一种硼酸盐的阴离子为B3O4n-,其结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O 的结构图
的结构图_______ (注明所带电荷数)。[B5O6(OH)4]-的结构为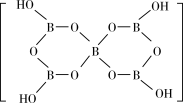 ,则B原子的配位数是
,则B原子的配位数是_______ 。
(3)L3SBF4可由Li2S与LiBF4按一定比例反应合成。Li2S和LiBF4的熔点如表所示:
Li2S与LiBF4均属于_______ 晶体;熔点:Li2S>LiBF4,原因是_______ 。
(4)Li3SBF4的晶胞结构如图所示,其中BF 位于体心,则Li+位于
位于体心,则Li+位于_______ (填“顶点”或“棱边”)。设NA为阿伏加德罗常数的值,若该晶胞中Li+与BF 间的最近距离为apm,则晶体密度为
间的最近距离为apm,则晶体密度为_______ g·cm-3,在Li3SBF4晶胞的另一种结构中,BF 位于顶点,则S2-位于
位于顶点,则S2-位于_______ (填“体心”“面心”或“棱边”)。
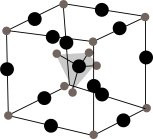
(1)基态F原子的价电子排布图为
(2)一种硼酸盐的阴离子为B3O4n-,其结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O
 的结构图
的结构图 ,则B原子的配位数是
,则B原子的配位数是(3)L3SBF4可由Li2S与LiBF4按一定比例反应合成。Li2S和LiBF4的熔点如表所示:
| 物质 | Li2S | LiBF4 |
| 熔点/℃ | 938 | 300 |
(4)Li3SBF4的晶胞结构如图所示,其中BF
 位于体心,则Li+位于
位于体心,则Li+位于 间的最近距离为apm,则晶体密度为
间的最近距离为apm,则晶体密度为 位于顶点,则S2-位于
位于顶点,则S2-位于
您最近一年使用:0次



