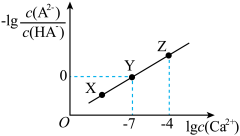
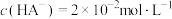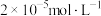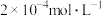缓冲溶液指的是由弱酸及其盐组成的混合溶液。缓冲溶液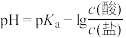 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸( )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,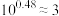 。
。
下列叙述正确的是
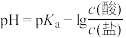 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸( )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,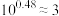 。
。下列叙述正确的是
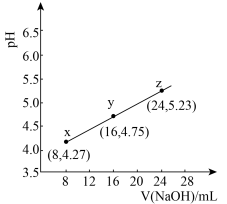
A.常温下,丙酸电离常数 的数量级为 的数量级为 |
| B.在x、y、z点溶液中,缓冲能力最强的是z点 |
C.在z点溶液中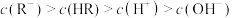 |
| D.若用同体积同浓度HNO2溶液替代HR溶液,则图中曲线竖直上移 |
更新时间:2024-04-05 21:49:30
|
相似题推荐
单选题
|
困难
(0.15)
【推荐1】25℃时,用KOH溶液滴定柠檬酸(化学式为C6H8O7,结构简式为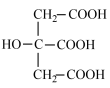 )溶液,溶液中-lgc(H+)与C6H8O7、
)溶液,溶液中-lgc(H+)与C6H8O7、 、
、 、
、 的分布系数δ的关系如图所示[如C6H7O
的分布系数δ的关系如图所示[如C6H7O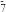 的分布系数δ(
的分布系数δ( )=
)=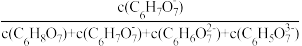 ]。下列说法错误的是
]。下列说法错误的是

| A.柠檬酸为三元弱酸,Ka3=1×10-6.8 |
B.pH=2.1时,c(C6H8O7):c(C6H7O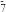 )=10︰1 )=10︰1 |
| C.溶液中水的电离程度a<b<c |
| D.0.01mol•L-1K2C6H6O7溶液中c(OH-)-c(H+)>2c(C6H8O7) |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐2】已知常温下H2A的Ka1=2.7×10-6,Ka2=6.3×10-10,HClO的Ka=3×10-8。下列说法正确的是
| A.NaHA溶液中存在:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| B.向Na2A溶液中通入少量Cl2的离子方程式:Cl2+2A2-+H2O=Cl-+ClO-+2HA- |
| C.NaClO溶液中水电离出的c(H+)·c(OH-)大于等浓度的Na2A溶液中水电离出的c(H+)·c(OH-) |
| D.等浓度、等体积的NaHA和NaClO的混合溶液中存在:c(OH-)=c(H+)+c(ClO-)+c(HA-)+c(HClO)+c(H2A) |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐1】室温下, ,
,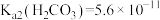 ,通过下列实验探究碳酸钠溶液的性质。下列有关说法不正确的是。
,通过下列实验探究碳酸钠溶液的性质。下列有关说法不正确的是。
 ,
,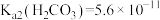 ,通过下列实验探究碳酸钠溶液的性质。下列有关说法不正确的是。
,通过下列实验探究碳酸钠溶液的性质。下列有关说法不正确的是。| 实验 | 实验操作和现象 |
| 1 | 将碳酸钠溶于蒸馏水,配制碳酸钠溶液,测得溶液的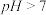 |
| 2 | 向碳酸钠溶液中加入等浓度等体积的盐酸,测得溶液的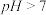 |
| 3 | 向碳酸钠溶液中加入等浓度等体积的溶液,产生白色沉淀 |
| 4 | 向碳酸钠溶液中滴入稀盐酸至溶液 |
A.实验1的溶液中存在: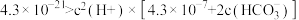 |
B.实验2的溶液中存在: |
C.实验3的清液中存在: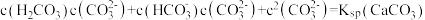 |
D.实验4过程中溶液不存在: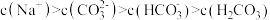 |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐2】已知:25℃,NH3·H2O电离平衡常数K=1.76×10-5。25℃,向1 L 0.1 mol/L某一元酸HR溶液中逐渐通入氨气,若溶液温度和体积保持不变,所得混合溶液的pH与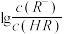 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
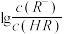 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
| A.由图可推知:25℃,0.1 mol/L NaR溶液的pH约为10 |
| B.当通入0.1 mol NH3时,所得溶液中:c(NH4+)>c(R-)>c(OH-)>c(H+) |
| C.pH=7时,所得溶液中:c(HR)>c(R-) =c(NH4+) |
| D.pH=10时,所得溶液中:c(R-)>c(HR) ,c(NH4+)>c(NH3·H2O) |
您最近一年使用:0次
【推荐3】25℃时,用 NaOH 溶液分别滴定 HX 、CuSO4、FeSO4三种溶液,pM[p表示负对数,M 表示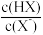 、c(Cu2+ ) 、c(Fe2+)等]随 pH 变化关系如图所示, 已知Ksp[Cu(OH)2]<Ksp[Fe(OH)2],下列说法正确的是
、c(Cu2+ ) 、c(Fe2+)等]随 pH 变化关系如图所示, 已知Ksp[Cu(OH)2]<Ksp[Fe(OH)2],下列说法正确的是

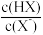 、c(Cu2+ ) 、c(Fe2+)等]随 pH 变化关系如图所示, 已知Ksp[Cu(OH)2]<Ksp[Fe(OH)2],下列说法正确的是
、c(Cu2+ ) 、c(Fe2+)等]随 pH 变化关系如图所示, 已知Ksp[Cu(OH)2]<Ksp[Fe(OH)2],下列说法正确的是
| A.①代表滴定 FeSO4 溶液的变化关系 |
| B.Cu(OH)2不易溶于HX 溶液中,而Fe(OH)2易溶于HX溶液中 |
| C.调整溶液的pH=7,无法除去工业废水中的Cu2+ |
| D.滴定HX溶液至a点时,溶液中一定满足 c(Na+)>c(X-)>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
【推荐1】常温下,向含有 和
和 的悬浊液中滴加弱酸HC,溶液中pM[
的悬浊液中滴加弱酸HC,溶液中pM[ ,M代表
,M代表 、
、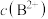 、
、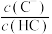 ]与pH的关系如下图所示,下列说法正确的是
]与pH的关系如下图所示,下列说法正确的是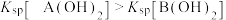
 和
和 的悬浊液中滴加弱酸HC,溶液中pM[
的悬浊液中滴加弱酸HC,溶液中pM[ ,M代表
,M代表 、
、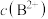 、
、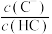 ]与pH的关系如下图所示,下列说法正确的是
]与pH的关系如下图所示,下列说法正确的是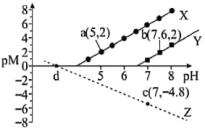
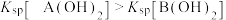
A.X、Y、Z分别表示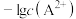 、 、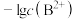 、 、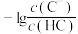 与pH的关系 与pH的关系 |
B. ;d点坐标为 ;d点坐标为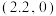 |
C. 和 和 均能完全溶解于足量的HC中 均能完全溶解于足量的HC中 |
D.向 悬浊液中加入足量的 悬浊液中加入足量的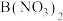 , , 可完全转化为 可完全转化为 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐2】25℃时,分别向20mL浓度均 的
的 、
、 溶液中逐滴加入浓度均
溶液中逐滴加入浓度均 NaOH、HCl溶液VmL,溶液的pH与
NaOH、HCl溶液VmL,溶液的pH与 [
[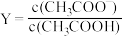 或
或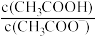 ]的关系如下图所示。下列说法错误的是
]的关系如下图所示。下列说法错误的是
 的
的 、
、 溶液中逐滴加入浓度均
溶液中逐滴加入浓度均 NaOH、HCl溶液VmL,溶液的pH与
NaOH、HCl溶液VmL,溶液的pH与 [
[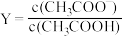 或
或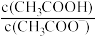 ]的关系如下图所示。下列说法错误的是
]的关系如下图所示。下列说法错误的是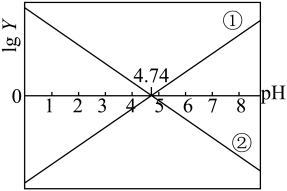
A.25℃时,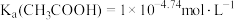 |
B.当 时,滴入溶液的体积 时,滴入溶液的体积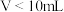 |
C.当滴入体积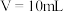 时, 时, |
D.25℃时,  溶液的 溶液的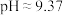 |
您最近一年使用:0次


 、
、 混合液中加入
混合液中加入 固体(忽略溶液体积、温度的变化),测得溶液中离子浓度变化如图所示。已知:
固体(忽略溶液体积、温度的变化),测得溶液中离子浓度变化如图所示。已知: 为二元弱酸,
为二元弱酸,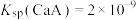 ,
, 易溶于水且溶液呈碱性。下列说法正确的是
易溶于水且溶液呈碱性。下列说法正确的是