已知常温下H2A的Ka1=2.7×10-6,Ka2=6.3×10-10,HClO的Ka=3×10-8。下列说法正确的是
| A.NaHA溶液中存在:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| B.向Na2A溶液中通入少量Cl2的离子方程式:Cl2+2A2-+H2O=Cl-+ClO-+2HA- |
| C.NaClO溶液中水电离出的c(H+)·c(OH-)大于等浓度的Na2A溶液中水电离出的c(H+)·c(OH-) |
| D.等浓度、等体积的NaHA和NaClO的混合溶液中存在:c(OH-)=c(H+)+c(ClO-)+c(HA-)+c(HClO)+c(H2A) |
更新时间:2020-08-02 13:49:18
|
相似题推荐
单选题
|
困难
(0.15)
名校
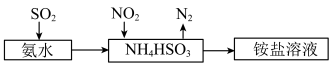
【推荐1】工业上可利用氨水吸收 和
和 ,原理如图所示。已知:
,原理如图所示。已知: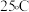 时,
时, 的
的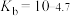 ,
, 的
的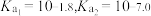 。下列说法正确的是
。下列说法正确的是
 和
和 ,原理如图所示。已知:
,原理如图所示。已知: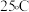 时,
时, 的
的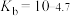 ,
, 的
的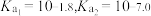 。下列说法正确的是
。下列说法正确的是
A.反应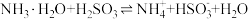 的平衡常数 的平衡常数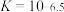 |
B.向氨水中通入 至 至 |
C.测得 溶液 溶液 : :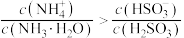 |
D. 溶液中: 溶液中: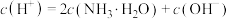 |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
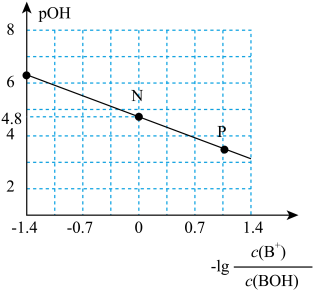
【推荐2】25℃时,向20.00mL0.1mol·L-1H2X溶液中滴入0.1mol·L-1 NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-1gc水(OH-)]与所加NaOH溶液体积的关系如图所示。
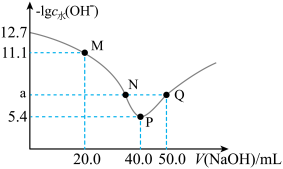
下列说法中正确的是

下列说法中正确的是
| A.水的电离程度:M>N=Q>P |
B.图中M、P、Q三点对应溶液中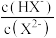 相等 相等 |
| C.N点溶液中c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-) |
| D.P点溶液中c(OH-)=c(H+)+c(HX-)+c(H2X) |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐3】已知:25℃,NH3·H2O电离平衡常数K=1.76×10-5。25℃,向1 L 0.1 mol/L某一元酸HR溶液中逐渐通入氨气,若溶液温度和体积保持不变,所得混合溶液的pH与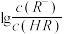 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
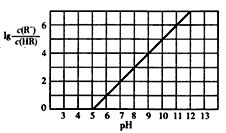
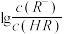 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
| A.由图可推知:25℃,0.1 mol/L NaR溶液的pH约为10 |
| B.当通入0.1 mol NH3时,所得溶液中:c(NH4+)>c(R-)>c(OH-)>c(H+) |
| C.pH=7时,所得溶液中:c(HR)>c(R-) =c(NH4+) |
| D.pH=10时,所得溶液中:c(R-)>c(HR) ,c(NH4+)>c(NH3·H2O) |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐1】常温下,二元弱酸H3PO3溶液中含磷物种的浓度之和为0.1mol•L﹣1,溶液中各含磷物种的pc﹣pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=﹣lgc),pOH表示OH的浓度的负对数[pOH=﹣lgc(OH﹣)]。下列有关说法正确的是
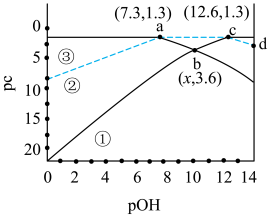

A.若反应 +H3PO3 +H3PO3 2 2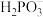 可以发生,其平衡常数值为10﹣5.3 可以发生,其平衡常数值为10﹣5.3 |
B.在浓度均为0.1mol/L的NaH2PO3和Na2HPO3混合溶液中c(Na+)>c(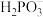 )>c( )>c( )>c(H+)>c(OH﹣) )>c(H+)>c(OH﹣) |
| C.b点时,x=9.95 |
D.d点溶液中存在关系式c(H+)=0.1+c( )+c(OH﹣) )+c(OH﹣) |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐2】常温下,向一定浓度的NaA溶液中加适量强酸或强碱(忽略溶液体积变化),溶液中 、
、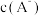 、
、 、
、 的负对数
的负对数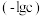 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是

 、
、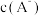 、
、 、
、 的负对数
的负对数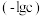 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是
A.曲线①表示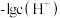 随溶液pH的变化情况 随溶液pH的变化情况 |
B.曲线①和曲线②的交点对应的溶液中存在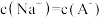 |
C.常温下,将A点对应溶液加水稀释,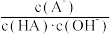 不变 不变 |
D.等物质的量浓度、等体积的NaA溶液与HA溶液混合后: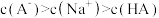 |
您最近一年使用:0次