科学家发现固体电解质Li3SBF4快离子导体具有良好的导电能力,为锂离子电池的发展做出了重要贡献。回答下列问题:
(1)基态F原子的价电子排布图为_______ 。B和F均为第2周期元素,在第2周期元素中,第一电离能介于B与F之间的元素有_______ 种。
(2)一种硼酸盐的阴离子为B3O4n-,其结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O 的结构图
的结构图_______ (注明所带电荷数)。[B5O6(OH)4]-的结构为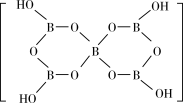 ,则B原子的配位数是
,则B原子的配位数是_______ 。
(3)L3SBF4可由Li2S与LiBF4按一定比例反应合成。Li2S和LiBF4的熔点如表所示:
Li2S与LiBF4均属于_______ 晶体;熔点:Li2S>LiBF4,原因是_______ 。
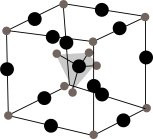
(4)Li3SBF4的晶胞结构如图所示,其中BF 位于体心,则Li+位于
位于体心,则Li+位于_______ (填“顶点”或“棱边”)。设NA为阿伏加德罗常数的值,若该晶胞中Li+与BF 间的最近距离为apm,则晶体密度为
间的最近距离为apm,则晶体密度为_______ g·cm-3,在Li3SBF4晶胞的另一种结构中,BF 位于顶点,则S2-位于
位于顶点,则S2-位于_______ (填“体心”“面心”或“棱边”)。
(1)基态F原子的价电子排布图为
(2)一种硼酸盐的阴离子为B3O4n-,其结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O
 的结构图
的结构图 ,则B原子的配位数是
,则B原子的配位数是(3)L3SBF4可由Li2S与LiBF4按一定比例反应合成。Li2S和LiBF4的熔点如表所示:
| 物质 | Li2S | LiBF4 |
| 熔点/℃ | 938 | 300 |
(4)Li3SBF4的晶胞结构如图所示,其中BF
 位于体心,则Li+位于
位于体心,则Li+位于 间的最近距离为apm,则晶体密度为
间的最近距离为apm,则晶体密度为 位于顶点,则S2-位于
位于顶点,则S2-位于
更新时间:2022-10-31 19:52:08
|
相似题推荐
解答题-结构与性质
|
困难
(0.15)
【推荐1】铜是人类最早发现的金属之一,铜及其化合物在生活和生产中有着广泛的应用。根据信息回答下列问题:
(1)基态铜原子价层电子的轨道表达式为__________ 。
(2)农药波尔多液的有效杀菌成分是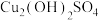 (碱式硫酸铜),
(碱式硫酸铜),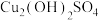 中非金属元素电负性由小到大的顺序是
中非金属元素电负性由小到大的顺序是__________ ,写出与 互为等电子体的一种分子的化学式
互为等电子体的一种分子的化学式__________ 。
(3)氨缩脲( )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为__________ , 键与
键与 键的数目之比为
键的数目之比为__________ 。氨缩脲与胆矾溶液反应得到如图所示的离子, 该离子中含配位键的数目为
该离子中含配位键的数目为__________ 。
(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为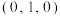 。原子B的坐标参数为
。原子B的坐标参数为__________ ;若该晶体密度为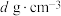 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为__________ pm。
(1)基态铜原子价层电子的轨道表达式为
(2)农药波尔多液的有效杀菌成分是
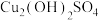 (碱式硫酸铜),
(碱式硫酸铜),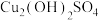 中非金属元素电负性由小到大的顺序是
中非金属元素电负性由小到大的顺序是 互为等电子体的一种分子的化学式
互为等电子体的一种分子的化学式(3)氨缩脲(
 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为 键与
键与 键的数目之比为
键的数目之比为 该离子中含配位键的数目为
该离子中含配位键的数目为
A. | B. |
C. | D. |
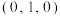 。原子B的坐标参数为
。原子B的坐标参数为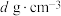 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为
您最近一年使用:0次
解答题-无机推断题
|
困难
(0.15)
【推荐2】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式:______________________________ 。
(2)B元素基态原子中能量最高的电子,其电子云在空间有__________ 个方向,原子轨道呈_______ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为 该同学所画的电子排布图违背
该同学所画的电子排布图违背___________________ 。
(4)G位于________ 族________ 区,该元素的核外电子排布式为_________________ 。
(5)DE3中心原子的杂化方式为____________ ,用价层电子对互斥理论推测其空间构型为__________ 。
(6)检验F元素的方法是____________ ,请用原子结构的知识解释产生此现象的原因:_____________ 。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738 kJ·mol-1 I2=1451 kJ·mol-1 I3=7733 kJ·mol-1 I4=10540 kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B元素基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 该同学所画的电子排布图违背
该同学所画的电子排布图违背(4)G位于
(5)DE3中心原子的杂化方式为
(6)检验F元素的方法是
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
解题方法
【推荐3】[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________ ,D原子的杂化类型为_______________ 。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________ (填“大于”、“小于”、或“等于”)N的沸点,原因是_______________ 。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________ 。写出相应的化学反应方程式:____________________ 。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________ ,加入乙醇的作用是________________ 。
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________ 。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______ g.cm-3
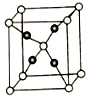
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为

您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
解题方法
【推荐1】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________ ,第二周期第一电离能比B高的元素有_______ 种。
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________ (标出配位键),其中心原子的 VSEPR模型名称为________ ,写出[BH4]-的两种等电子体_____________________ 。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________ (以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________ 。
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________ ;同一片层划分出的一个二维晶胞(平行四边形)含有_______ 个H3BO3分子。
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:__________________

(1)基态B原子的价电子轨道表达式为
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为
| 图1 | 图2 | 图3 |
 |  |  |
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:

您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
【推荐2】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中_______ 区;第二周期元素中,第一电离能比氧大的有_______ 种。
(2)O3可用于消毒。O3的中心原子的杂化形式为_______ ;其分子的VSEPR模型为_______ ,与其互为等电子体的离子为_______ (写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为_______ 。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。
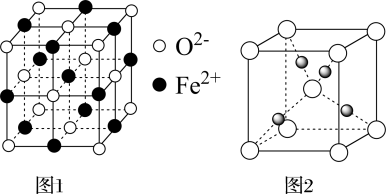
①FeO立方晶胞结构如图1所示,则Fe2+的配位数为_______ ;与O2-紧邻的所有Fe2+构成的几何构型为_______ 。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为_______ g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
(1)氧元素位于元素周期表中
(2)O3可用于消毒。O3的中心原子的杂化形式为
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为
您最近一年使用:0次
【推荐3】冶炼铝时常用的某种助熔剂,其晶胞如图a所示,晶胞中钠离子的俯视投影如图b所示,晶胞底边边长为apm,高为cpm,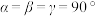 。回答下列问题:
。回答下列问题:

(1)基态Al原子核外电子有___________ 种不同的空间运动状态,铝的超原子结构有 和
和 等,这类超原子具有40个价电子时最稳定,则
等,这类超原子具有40个价电子时最稳定,则 与
与___________ 族元素的性质相似。
(2)Al原子的第一电离能低于Mg,原因是___________ 。
(3)该助熔剂的化学式为___________ ,若阿伏加德罗常数值为 ,晶体密度为
,晶体密度为___________  (写出计算式即可)
(写出计算式即可)
(4)该助熔剂的另一种晶胞是由大阴离子构成的面心立方晶胞, 可看作是填充在晶胞的空隙中,其中大阴离子中一个
可看作是填充在晶胞的空隙中,其中大阴离子中一个 在体对角线上,该
在体对角线上,该 的坐标为
的坐标为___________ (该 所配位的原子为原点,保留3位有效数字,已知Al-F键长181pm,晶胞边长为780pm,
所配位的原子为原点,保留3位有效数字,已知Al-F键长181pm,晶胞边长为780pm, )。
)。
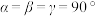 。回答下列问题:
。回答下列问题:
(1)基态Al原子核外电子有
 和
和 等,这类超原子具有40个价电子时最稳定,则
等,这类超原子具有40个价电子时最稳定,则 与
与(2)Al原子的第一电离能低于Mg,原因是
(3)该助熔剂的化学式为
 ,晶体密度为
,晶体密度为 (写出计算式即可)
(写出计算式即可)(4)该助熔剂的另一种晶胞是由大阴离子构成的面心立方晶胞,
 可看作是填充在晶胞的空隙中,其中大阴离子中一个
可看作是填充在晶胞的空隙中,其中大阴离子中一个 在体对角线上,该
在体对角线上,该 的坐标为
的坐标为 所配位的原子为原点,保留3位有效数字,已知Al-F键长181pm,晶胞边长为780pm,
所配位的原子为原点,保留3位有效数字,已知Al-F键长181pm,晶胞边长为780pm, )。
)。
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
解题方法
【推荐1】卤素元素比较活泼,能形成种类繁多的化合物,回答下列问题:
(1)F,Cl,Br,I形成简单氢化物的沸点由高到低的顺序为:____________________________ 。
(2)卤素可形成很多酸根离子,如 、
、 、
、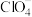 、
、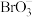 等,
等,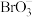 的空间结构为
的空间结构为______________ 。
(3)卤素元素之间还能形成很多卤素互化物,如 ,
, ,
,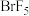 ,
,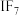 等,根据I与Cl原子的电负性大小关系写成
等,根据I与Cl原子的电负性大小关系写成 在水中水解的化学方程式:
在水中水解的化学方程式:_____________________ 。
(4)在石墨烯膜上可以制备Cl元素和Ca元素形成的新型的化合物,如图是俯视图和侧视图,俯视图中小六元环为石墨层,大六元环含3个大球(石墨六元环中心正上方)和3个小球(石墨层部分碳原子正上方),请写出该化合物的化学式______________ ,在石墨六元环中心正上方的元素为______________ 。(填元素符号)

(5)卤素还被称为成盐元素,某种卤素盐的晶体中含有Cl,Cs与Au三种元素,其最简式为 ,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为
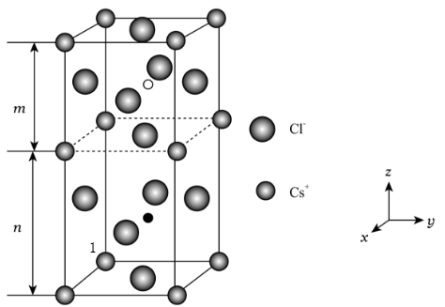
,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为 ,高为
,高为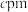 ,高分为两段,分别为
,高分为两段,分别为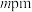 和
和 ,
, 的相对分子质量为M,回答下列问题:
的相对分子质量为M,回答下列问题:
①如果 与
与 相等,
相等, 和
和 构成
构成______________ 晶胞。
②金(Au)离子和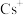 的配位数分别为
的配位数分别为__________ 和__________ 。
③如图所示,以原子1为原点建立坐标系,写出晶胞内部小白球的分数坐标______ 。
(1)F,Cl,Br,I形成简单氢化物的沸点由高到低的顺序为:
(2)卤素可形成很多酸根离子,如
 、
、 、
、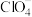 、
、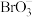 等,
等,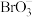 的空间结构为
的空间结构为(3)卤素元素之间还能形成很多卤素互化物,如
 ,
, ,
,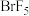 ,
,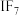 等,根据I与Cl原子的电负性大小关系写成
等,根据I与Cl原子的电负性大小关系写成 在水中水解的化学方程式:
在水中水解的化学方程式:(4)在石墨烯膜上可以制备Cl元素和Ca元素形成的新型的化合物,如图是俯视图和侧视图,俯视图中小六元环为石墨层,大六元环含3个大球(石墨六元环中心正上方)和3个小球(石墨层部分碳原子正上方),请写出该化合物的化学式

(5)卤素还被称为成盐元素,某种卤素盐的晶体中含有Cl,Cs与Au三种元素,其最简式为
 ,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为
,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为 ,高为
,高为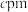 ,高分为两段,分别为
,高分为两段,分别为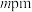 和
和 ,
, 的相对分子质量为M,回答下列问题:
的相对分子质量为M,回答下列问题:
①如果
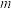 与
与 相等,
相等, 和
和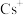 构成
构成②金(Au)离子和
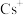 的配位数分别为
的配位数分别为③如图所示,以原子1为原点建立坐标系,写出晶胞内部小白球的分数坐标
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
【推荐2】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中_______ 区;第二周期元素中,第一电离能比氧大的有_______ 种。
(2)O3可用于消毒。O3的中心原子的杂化形式为_______ ;其分子的VSEPR模型为_______ ,与其互为等电子体的离子为_______ (写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为_______ 。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为_______ ;与O2-紧邻的所有Fe2+构成的几何构型为_______ 。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为_______ g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
(1)氧元素位于元素周期表中
(2)O3可用于消毒。O3的中心原子的杂化形式为
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
解题方法
【推荐3】在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)Ag元素在元素周期表分区中属于_______ 区,基态Ag原子的价电子排布式为_______ 。
(2)硫代硫酸银(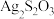 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成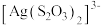 等络阴离子。
等络阴离子。
①依据 理论推测
理论推测 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
②在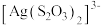 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ 。
(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有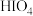 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和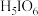 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性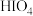
_______ 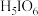 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是_______ 。
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
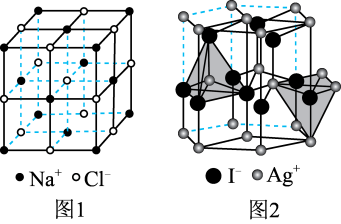
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为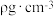 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______ ;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______ (储氢能力 )
)
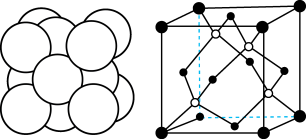
(1)Ag元素在元素周期表分区中属于
(2)硫代硫酸银(
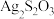 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成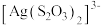 等络阴离子。
等络阴离子。①依据
 理论推测
理论推测 的空间构型为
的空间构型为②在
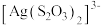 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有
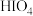 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和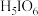 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性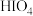
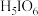 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为a.几何因素 b.电荷因素 c.键性因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为
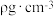 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )
)
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
【推荐1】铜是人类最早发现的金属之一,铜及其化合物在生活和生产中有着广泛的应用。根据信息回答下列问题:
(1)基态铜原子价层电子的轨道表达式为__________ 。
(2)农药波尔多液的有效杀菌成分是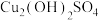 (碱式硫酸铜),
(碱式硫酸铜),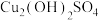 中非金属元素电负性由小到大的顺序是
中非金属元素电负性由小到大的顺序是__________ ,写出与 互为等电子体的一种分子的化学式
互为等电子体的一种分子的化学式__________ 。
(3)氨缩脲( )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为__________ , 键与
键与 键的数目之比为
键的数目之比为__________ 。氨缩脲与胆矾溶液反应得到如图所示的离子, 该离子中含配位键的数目为
该离子中含配位键的数目为__________ 。
(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为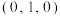 。原子B的坐标参数为
。原子B的坐标参数为__________ ;若该晶体密度为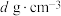 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为__________ pm。
(1)基态铜原子价层电子的轨道表达式为
(2)农药波尔多液的有效杀菌成分是
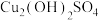 (碱式硫酸铜),
(碱式硫酸铜),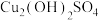 中非金属元素电负性由小到大的顺序是
中非金属元素电负性由小到大的顺序是 互为等电子体的一种分子的化学式
互为等电子体的一种分子的化学式(3)氨缩脲(
 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为 键与
键与 键的数目之比为
键的数目之比为 该离子中含配位键的数目为
该离子中含配位键的数目为
A. | B. |
C. | D. |
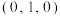 。原子B的坐标参数为
。原子B的坐标参数为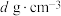 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
解题方法
【推荐2】铜及其化合物在科学研究和工业生产中具有许多用途,请回答下列问题:
(1)写出基态Cu原子的价电子排布式_______ 。
(2)已知高温下 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因_______ 。
(3)配合物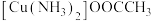 中碳原子的杂化类型是
中碳原子的杂化类型是_______ ,配体的空间构型为_______ 。配合物所含元素的电负性由大到小的顺序是_______ (用元素符号表示)。
(4)M原子的价电子排布式为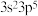 ,铜与M形成化合物的晶胞如图所示。
,铜与M形成化合物的晶胞如图所示。
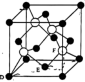
①原子坐标参数,表示晶胞内部各原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0),E为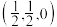 ,则F原子的坐标参数为
,则F原子的坐标参数为_______ 。
②已知该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为_______ pm(写出计算式)。
(1)写出基态Cu原子的价电子排布式
(2)已知高温下
 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因(3)配合物
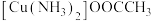 中碳原子的杂化类型是
中碳原子的杂化类型是(4)M原子的价电子排布式为
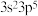 ,铜与M形成化合物的晶胞如图所示。
,铜与M形成化合物的晶胞如图所示。
①原子坐标参数,表示晶胞内部各原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0),E为
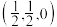 ,则F原子的坐标参数为
,则F原子的坐标参数为②已知该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
解题方法
【推荐3】碳是地球上组成生命的最基本元素之一,与其他元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。回答下列问题:
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。
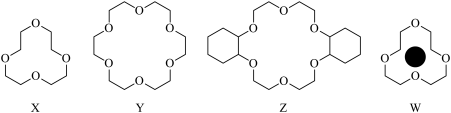
①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有___ 种运动状态不同的电子,其外围电子轨道表示式为___ 。W中Li+与孤对电子之间的作用属于___ (填标号)。
A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是___ 。
③冠醚分子中氧的杂化轨道的空间构型是___ ,C—O—C的键角___ (填“>”“<”或“=”)109°28′。
(2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为___ 个。已知石墨的密度为ρg·cm-3,C—C键键长为rcm,阿伏加 德罗常数的值为NA,计算石墨晶体的层间距d为___ cm。
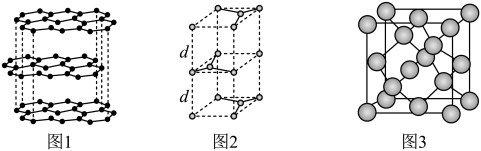
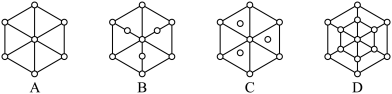
(3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图___ (从A~D图中选填)。
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有
A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是
③冠醚分子中氧的杂化轨道的空间构型是
(2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为

(3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图

您最近一年使用:0次



