名校
解题方法
1 .  、
、 是新型磁性材料的成分,设
是新型磁性材料的成分,设 为阿伏加德罗常数的值,依据其中有关元素回答问题:
为阿伏加德罗常数的值,依据其中有关元素回答问题:
(1)钕(Nd)属于镧系元素,则其在元素周期表中处于___________ 区, 的价电子排布图为
的价电子排布图为___________ 。
(2) 的立体构型为
的立体构型为___________ ;F原子核外有___________ 种不同空间运动状态的电子。
(3) 是一种还原剂,B原子的杂化方式为
是一种还原剂,B原子的杂化方式为___________ 。该物质中是否存在配位键___________ (填“是”或“否”)。
(4) 的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。
的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。___________ 。
②该晶体密度为 ,则K和Co之间的最短距离为
,则K和Co之间的最短距离为___________ pm。
(5) 的制备:称取研细的
的制备:称取研细的 和
和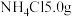 于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的
于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液。写出该反应的离子方程式
溶液。写出该反应的离子方程式___________ 。若上述实验过程中得到 ,则其中所含的
,则其中所含的 键数目为
键数目为___________ 。
(6)已知某温度下 的电离平衡常数:
的电离平衡常数: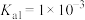 、
、 ,
,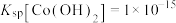 、
、 。写出该温度时向
。写出该温度时向 碳酸钠溶液中逐滴加入
碳酸钠溶液中逐滴加入 溶液,生成沉淀的离子方程式:
溶液,生成沉淀的离子方程式:___________ 。
 、
、 是新型磁性材料的成分,设
是新型磁性材料的成分,设 为阿伏加德罗常数的值,依据其中有关元素回答问题:
为阿伏加德罗常数的值,依据其中有关元素回答问题:(1)钕(Nd)属于镧系元素,则其在元素周期表中处于
 的价电子排布图为
的价电子排布图为(2)
 的立体构型为
的立体构型为(3)
 是一种还原剂,B原子的杂化方式为
是一种还原剂,B原子的杂化方式为(4)
 的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。
的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。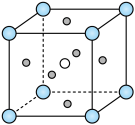
②该晶体密度为
 ,则K和Co之间的最短距离为
,则K和Co之间的最短距离为(5)
 的制备:称取研细的
的制备:称取研细的 和
和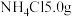 于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的
于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液。写出该反应的离子方程式
溶液。写出该反应的离子方程式 ,则其中所含的
,则其中所含的 键数目为
键数目为(6)已知某温度下
 的电离平衡常数:
的电离平衡常数: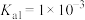 、
、 ,
,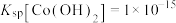 、
、 。写出该温度时向
。写出该温度时向 碳酸钠溶液中逐滴加入
碳酸钠溶液中逐滴加入 溶液,生成沉淀的离子方程式:
溶液,生成沉淀的离子方程式:
您最近半年使用:0次
名校
2 . 化学,让生活更美好。回答下列问题:
(1) 广泛应用于太阳能电池领域。以
广泛应用于太阳能电池领域。以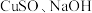 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图所示。
。抗坏血酸的分子结构如图所示。___________ 。 的空间构型是
的空间构型是___________ 。
②下列说法中不正确的是___________ 。
A.抗坏血酸分子中碳原子的轨道杂化类型为 和
和
B.抗坏血酸难溶于水,易溶于乙醇
C.抗坏血酸分子具有很强的还原性,易形成脱氢抗坏血酸
D. 在水溶液中以
在水溶液中以 形式存在,其空间构型为正四面体
形式存在,其空间构型为正四面体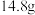 ,放入燃烧管中,不断通入氧气流持续加热,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重
,放入燃烧管中,不断通入氧气流持续加热,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重 和
和 ,生成物完全被吸收。如图是该有机物甲的质谱图,则其相对分子质量为
,生成物完全被吸收。如图是该有机物甲的质谱图,则其相对分子质量为___________ ,分子式为___________ 。通过实验可知甲中一定含有羟基,则甲可能的结构有___________ 种,写出其中核磁共振有2种峰且面积比为9:1的有机物结构简式___________ 。
(1)
 广泛应用于太阳能电池领域。以
广泛应用于太阳能电池领域。以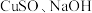 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图所示。
。抗坏血酸的分子结构如图所示。
 的空间构型是
的空间构型是②下列说法中不正确的是
A.抗坏血酸分子中碳原子的轨道杂化类型为
 和
和
B.抗坏血酸难溶于水,易溶于乙醇
C.抗坏血酸分子具有很强的还原性,易形成脱氢抗坏血酸
D.
 在水溶液中以
在水溶液中以 形式存在,其空间构型为正四面体
形式存在,其空间构型为正四面体③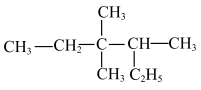 的系统命名为
的系统命名为
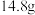 ,放入燃烧管中,不断通入氧气流持续加热,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重
,放入燃烧管中,不断通入氧气流持续加热,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重 和
和 ,生成物完全被吸收。如图是该有机物甲的质谱图,则其相对分子质量为
,生成物完全被吸收。如图是该有机物甲的质谱图,则其相对分子质量为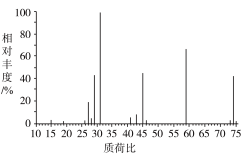
您最近半年使用:0次
名校
解题方法
3 . 已知a~f是原子序数依次增大前四周期的六种元素,a元素原子核外电子只有一种自旋取向;b元素原子最高能级的不同轨道都有电子且自旋方向相同;c元素原子的价层电子排布为 ,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用元素符号表示):
,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用元素符号表示):
(1)d其原子核外电子共有___________ 种空间运动状态;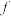 属于
属于___________ 区元素。
(2)b、c、d、e四种元素第一电离能由大到小的顺序为___________ 。
(3)与e元素处于对角线位置的第二周期元素的氢氧化物与 元素的最高价氧化物对应水化物反应的离子方程式为
元素的最高价氧化物对应水化物反应的离子方程式为___________ 。
(4) 能与
能与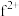 形成
形成 配离子,而
配离子,而 不能形成
不能形成 配离子,其原因是
配离子,其原因是___________ 。
(5)过渡金属离子与水分子形成的配合物是否有颜色,与其 轨道电子排布有关。一般而言,为
轨道电子排布有关。一般而言,为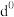 或
或 排布时,无颜色;为
排布时,无颜色;为 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,
___________ 颜色(填“无”或“有”)。
 ,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用元素符号表示):
,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用元素符号表示):(1)d其原子核外电子共有
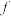 属于
属于(2)b、c、d、e四种元素第一电离能由大到小的顺序为
(3)与e元素处于对角线位置的第二周期元素的氢氧化物与
 元素的最高价氧化物对应水化物反应的离子方程式为
元素的最高价氧化物对应水化物反应的离子方程式为(4)
 能与
能与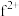 形成
形成 配离子,而
配离子,而 不能形成
不能形成 配离子,其原因是
配离子,其原因是(5)过渡金属离子与水分子形成的配合物是否有颜色,与其
 轨道电子排布有关。一般而言,为
轨道电子排布有关。一般而言,为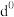 或
或 排布时,无颜色;为
排布时,无颜色;为 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,
您最近半年使用:0次
名校
4 . 甲烷是重要的资源,通过下列过程可实现由甲烷到氢气的转化。 与
与 重整主要发生下列反应:
重整主要发生下列反应:

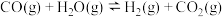
已知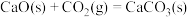
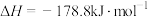 。向重整反应体系中加入适量多孔CaO,其优点是
。向重整反应体系中加入适量多孔CaO,其优点是________ 。
(2) 与
与 重整的主要反应的热化学方程式为
重整的主要反应的热化学方程式为
反应Ⅰ:
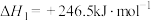
反应Ⅱ: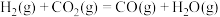

反应Ⅲ: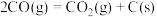

①在 与
与 重整体系中通入适量
重整体系中通入适量 ,可减少C(s)的生成,反应3
,可减少C(s)的生成,反应3 的
的
________ 。
② 下,将
下,将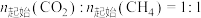 的混合气体置于密闭容器中,不同温度下重整体系中
的混合气体置于密闭容器中,不同温度下重整体系中 和
和 的平衡转化率如图1所示。800℃下
的平衡转化率如图1所示。800℃下 平衡转化率远大于600℃下
平衡转化率远大于600℃下 平衡转化率,其原因是
平衡转化率,其原因是________ 。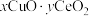 ,Ce是活泼金属)催化氧化可除去
,Ce是活泼金属)催化氧化可除去 中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。将
中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。将 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有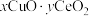 催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。
催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。 ,基态Cu原子核外电子排布式为
,基态Cu原子核外电子排布式为________ ,图2所示机理的步骤(i)中,元素Cu、Ce化合价发生的变化为________ 。
②图2所表示的总反应为________ 。
③当催化氧化温度超过150℃时,催化剂的催化活性下降,其可能原因是________ 。

 与
与 重整主要发生下列反应:
重整主要发生下列反应:
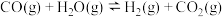
已知
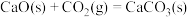
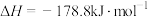 。向重整反应体系中加入适量多孔CaO,其优点是
。向重整反应体系中加入适量多孔CaO,其优点是(2)
 与
与 重整的主要反应的热化学方程式为
重整的主要反应的热化学方程式为反应Ⅰ:

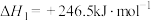
反应Ⅱ:
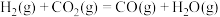

反应Ⅲ:
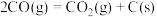

①在
 与
与 重整体系中通入适量
重整体系中通入适量 ,可减少C(s)的生成,反应3
,可减少C(s)的生成,反应3 的
的
②
 下,将
下,将 的混合气体置于密闭容器中,不同温度下重整体系中
的混合气体置于密闭容器中,不同温度下重整体系中 和
和 的平衡转化率如图1所示。800℃下
的平衡转化率如图1所示。800℃下 平衡转化率远大于600℃下
平衡转化率远大于600℃下 平衡转化率,其原因是
平衡转化率,其原因是 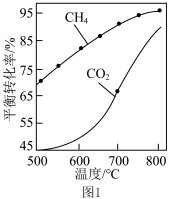
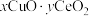 ,Ce是活泼金属)催化氧化可除去
,Ce是活泼金属)催化氧化可除去 中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。将
中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。将 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有 催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。
催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。

 ,基态Cu原子核外电子排布式为
,基态Cu原子核外电子排布式为②图2所表示的总反应为
③当催化氧化温度超过150℃时,催化剂的催化活性下降,其可能原因是
您最近半年使用:0次
名校
5 . 下列关于 及构成微粒的化学用语或图示表达错误的是
及构成微粒的化学用语或图示表达错误的是
 及构成微粒的化学用语或图示表达错误的是
及构成微粒的化学用语或图示表达错误的是A. 的分子结构模型: 的分子结构模型: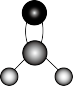 |
B.H原子电子的电子云轮廓图: |
C.C原子杂化轨道示意图: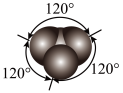 |
D.基态氧原子的轨道表示式为: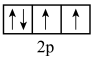 |
您最近半年使用:0次
名校
解题方法
6 . 我国科学家利用过渡金属碳化物(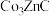 )合成了钴单质催化剂(
)合成了钴单质催化剂(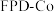 ),其晶胞转化如图所示。
),其晶胞转化如图所示。 ,底长为
,底长为 、宽为
、宽为 、高为
、高为 ;
;
② 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
下列说法错误的是
 )合成了钴单质催化剂(
)合成了钴单质催化剂(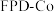 ),其晶胞转化如图所示。
),其晶胞转化如图所示。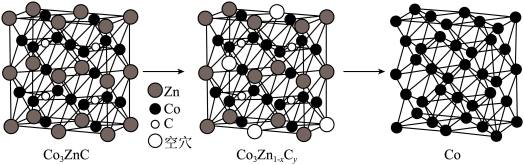
 ,底长为
,底长为 、宽为
、宽为 、高为
、高为 ;
;②
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。下列说法错误的是
A.同周期基态原子,与 原子中所含单电子数相同的原子有2种 原子中所含单电子数相同的原子有2种 |
B.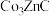 晶胞中与C原子距离最近的 晶胞中与C原子距离最近的 原子形成正八面体结构 原子形成正八面体结构 |
C. 晶胞中 晶胞中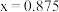 |
D.钴晶胞的密度为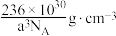 |
您最近半年使用:0次
解题方法
7 . 合成氨N2+3H2 2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:
2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:
(1)基态N原子中,电子占据最高能级的符号是___________ ,占据该能级电子的电子云轮廓图为___________ 形。
(2)26号元素Fe基态原子的价层电子轨道表示式是___________ 。
(3)24Cr的价层电子排布式为___________ ,在元素周期表中位于___________ 区(填“s”“p”“d”或“ds”)。
(4)NH3分子中,与N原子相连的H显正电性。分析电负性大小关系为N___________ H(填“>”“<”或“=”)。
(5)工业上电解Al2O3制备铝,常用冰晶石Na3[AlF6]来降低Al2O3的熔点,请写出Na3[AlF6]电离方程式___________ 。
 2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:
2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:(1)基态N原子中,电子占据最高能级的符号是
(2)26号元素Fe基态原子的价层电子轨道表示式是
(3)24Cr的价层电子排布式为
(4)NH3分子中,与N原子相连的H显正电性。分析电负性大小关系为N
(5)工业上电解Al2O3制备铝,常用冰晶石Na3[AlF6]来降低Al2O3的熔点,请写出Na3[AlF6]电离方程式
您最近半年使用:0次
名校
解题方法
8 . 氮化镓是第三代半导体材料,是坚硬的高熔点材料,常用金属有机物气相沉积法大批量生产。用三甲基镓与氨反应制备氮化镓的原理为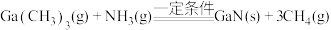 。下列说法错误的是
。下列说法错误的是
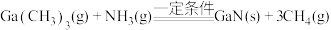 。下列说法错误的是
。下列说法错误的是A. 和 和 的 的 模型相同 模型相同 |
B.基态 原子的电子排布式: 原子的电子排布式: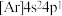 |
C. 中仅含有极性键 中仅含有极性键 |
D. 和N可形成共价晶体 和N可形成共价晶体 |
您最近半年使用:0次
9 .  被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为
被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为 ,含少量
,含少量 、
、 和
和 )为原料制备
)为原料制备 的流程如下:
的流程如下: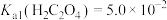 ,
,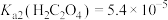 ,
, ;
;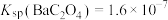 ,
,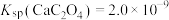 。
。
回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有_____ 种。
(2)浸渣的主要成分为_____ 和_____ (填化学式),“浸出”步骤中 与
与 溶液反应的原理为
溶液反应的原理为_____ (用离子方程式表示)。
(3)若浸出液中 ,
, ,“除钙”步骤中,当沉钙率为90%时,钡损率为
,“除钙”步骤中,当沉钙率为90%时,钡损率为_____ 。
(4) 溶液显
溶液显_____ (填“酸”“碱”或“中”)性;“沉钛”步骤所得沉淀为 ,该步骤生成的能循环利用的物质是
,该步骤生成的能循环利用的物质是_____ (填化学式)。
(5)“热解”步骤的化学方程式为_____ 。
(6) 在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。 ,则B点微粒的坐标为
,则B点微粒的坐标为_____ 。
②Ti在晶胞中的位置为_____ ;晶胞中一个Ba周围与其最近的O的个数为_____ 。
 被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为
被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为 ,含少量
,含少量 、
、 和
和 )为原料制备
)为原料制备 的流程如下:
的流程如下: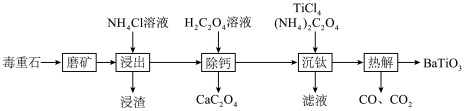
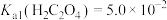 ,
,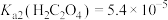 ,
, ;
;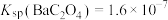 ,
,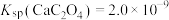 。
。回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有
(2)浸渣的主要成分为
 与
与 溶液反应的原理为
溶液反应的原理为(3)若浸出液中
 ,
, ,“除钙”步骤中,当沉钙率为90%时,钡损率为
,“除钙”步骤中,当沉钙率为90%时,钡损率为(4)
 溶液显
溶液显 ,该步骤生成的能循环利用的物质是
,该步骤生成的能循环利用的物质是(5)“热解”步骤的化学方程式为
(6)
 在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。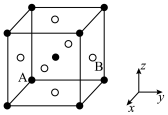
 ,则B点微粒的坐标为
,则B点微粒的坐标为②Ti在晶胞中的位置为
您最近半年使用:0次
10 . 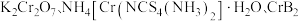 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: 原子有
原子有___________ 种能量不同的电子,价电子排布式为___________ 。
(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量, 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为___________  ;
; ,其原因是
,其原因是___________ 。
(3)雷氏盐的化学式为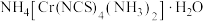 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为___________ 。
②雷氏盐中所含化学键类型___________ 。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一 分子的
分子的 模型名称为
模型名称为___________ ,与配体 互为等电子体的分子和离子有
互为等电子体的分子和离子有___________ 、___________ (各写1种)。
(4)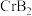 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
___________ (列出计算式)。
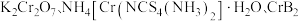 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: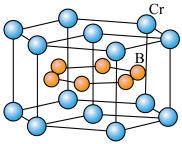
 原子有
原子有(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为 ;
; ,其原因是
,其原因是(3)雷氏盐的化学式为
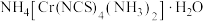 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②雷氏盐中所含化学键类型
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一
 分子的
分子的 模型名称为
模型名称为 互为等电子体的分子和离子有
互为等电子体的分子和离子有(4)
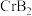 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
您最近半年使用:0次



