解题方法
1 . A、B、C、D、E是前四周期的元素。A、B、C同周期,C、D同主族且原子半径C>D,A的原子结构示意图为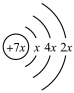 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E对应的单质是目前用量最大的金属。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E对应的单质是目前用量最大的金属。回答下列问题:
(2)用元素符号表示D所在周期第一电离能最大的元素是
(3)E原子价电子排布式是
您最近一年使用:0次
2 . 第四周期有14种金属元素,其中4种为主族元素,10种为过渡元素。回答下列问题:
(1)镓元素在周期表中的位置为_____ ;属于_____ 区元素 填“s”“p”“d”“ds”或“f”
填“s”“p”“d”“ds”或“f” 。
。
(2)比较第一电离:Mn_____ O(填“大于”“小于”“等于”)
(3)基态铬原子的价电子轨道表示式为_____ ,与铬同周期的所有元素的基态原子中,最外层电子数与铬原子相同的有_____ 。
(4)基态Fe原子中,电子占据的最高能层的符号为_____ ,该能层具有的原子轨道数为_____ 。
(5)铜、锌两种元素的第一电离能、第二电离能如表所示:
铜的第二电离能 却大于锌的第二电离能,其主要原因是
却大于锌的第二电离能,其主要原因是_____ 。
(1)镓元素在周期表中的位置为
 填“s”“p”“d”“ds”或“f”
填“s”“p”“d”“ds”或“f” 。
。(2)比较第一电离:Mn
(3)基态铬原子的价电子轨道表示式为
(4)基态Fe原子中,电子占据的最高能层的符号为
(5)铜、锌两种元素的第一电离能、第二电离能如表所示:
电离能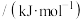 |  |  |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
 却大于锌的第二电离能,其主要原因是
却大于锌的第二电离能,其主要原因是
您最近一年使用:0次
解题方法
3 . 铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为_____ ,占据最高能级的电子云轮廓图形状为_____ ,基态铝原子比基态镁原子的第一电离能小,其原因是_____ 。
(2)通常情况下, 可由六氟铝酸铵
可由六氟铝酸铵 受热分解制得,请写出
受热分解制得,请写出 的空间构型
的空间构型_____ 。
(3) 具有较高的熔点(1040℃),属于
具有较高的熔点(1040℃),属于_____ (填晶体类型)晶体; 在178℃时升华,属于
在178℃时升华,属于_____ (填晶体类型)晶体。
(4) 在水溶液中实际上是以
在水溶液中实际上是以 的形式存在。其中
的形式存在。其中 为配离子,Al原子的杂化方式为
为配离子,Al原子的杂化方式为_____ ,该阴离子中存在的化学键有_____ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石( )晶体的晶胞如图所示,已知立方体边长为
)晶体的晶胞如图所示,已知立方体边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为_____  (列出计算式)。
(列出计算式)。
(1)基态铝原子的核外电子排布式为
(2)通常情况下,
 可由六氟铝酸铵
可由六氟铝酸铵 受热分解制得,请写出
受热分解制得,请写出 的空间构型
的空间构型(3)
 具有较高的熔点(1040℃),属于
具有较高的熔点(1040℃),属于 在178℃时升华,属于
在178℃时升华,属于(4)
 在水溶液中实际上是以
在水溶液中实际上是以 的形式存在。其中
的形式存在。其中 为配离子,Al原子的杂化方式为
为配离子,Al原子的杂化方式为A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石(
 )晶体的晶胞如图所示,已知立方体边长为
)晶体的晶胞如图所示,已知立方体边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。
(列出计算式)。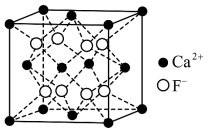
您最近一年使用:0次
解题方法
4 . 下列说法正确的是
| A.2p和3p能级能量相同 |
| B.同一原子中,2p、3p、4p能级的轨道数依次增多 |
| C.s区元素全部是金属元素 |
D.电子排布图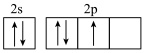 违背了洪特规则 违背了洪特规则 |
您最近一年使用:0次
5 . 第四周期元素原子的最外层电子数为2,价电子数为5,下列关于该元素的判断错误的是
| A.基态原子的电子排布式为1s22s22p63s23p63d34s2 |
| B.该元素为V(钒) |
| C.该元素为ⅡA族元素 |
| D.该元素位于d区 |
您最近一年使用:0次
23-24高三下·陕西西安·阶段练习
解题方法
6 . CdS、ZnS等硫化物与TiO2、SnO2、ZnO等进行复合,可以得到性能很好的复合半导体光催化剂。回答下列问题:
(1)Sn与C同主族,基态Sn原子的价层电子排布式为_______ ,基态Ti原子核外电子有_______ 种空间运动状态, 核外未成对电子数为
核外未成对电子数为_______ ,ZnS、ZnO中各元素的电负性由大到小的顺序为_______ 。
(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。_______ ;图2中N原子会和B原子形成配位键,成键时_______ (填元素符号)原子提供空轨道。
(3)N、O、F三种元素的第一电离能由大到小的顺序为_______ (填元素符号),解释其原因:_______ 。
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。_______ 。
②若晶胞参数为anm,该晶体的密度为_______ g (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Sn与C同主族,基态Sn原子的价层电子排布式为
 核外未成对电子数为
核外未成对电子数为(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。

(3)N、O、F三种元素的第一电离能由大到小的顺序为
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是
 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。
②若晶胞参数为anm,该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
7 . 检验微量砷的原理为 。AsH3常温下为无色气体。下列说法正确的是
。AsH3常温下为无色气体。下列说法正确的是
 。AsH3常温下为无色气体。下列说法正确的是
。AsH3常温下为无色气体。下列说法正确的是| A.As的基态核外电子排布式为[Ar]4s24p3 | B.H2O的VSEPR空间构型为V型 |
| C.固态AsH3属于共价晶体 | D.AgNO3中含有离子键和极性键 |
您最近一年使用:0次
2024-04-24更新
|
277次组卷
|
2卷引用:西藏拉萨市第三高级中学2023-2024学年高二下学期期中考试化学试卷
名校
解题方法
8 . 光气 是一种重要的试剂,可通过反应
是一种重要的试剂,可通过反应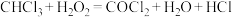 制备。下列说法正确的是
制备。下列说法正确的是
 是一种重要的试剂,可通过反应
是一种重要的试剂,可通过反应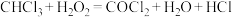 制备。下列说法正确的是
制备。下列说法正确的是A. 中只含有极性键 中只含有极性键 | B.基态氧原子的价层电子轨道表示式: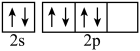 |
C. 是直线形分子 是直线形分子 | D. 是极性分子 是极性分子 |
您最近一年使用:0次
2024-04-23更新
|
70次组卷
|
2卷引用:西藏拉萨市第三高级中学2023-2024学年高二下学期期中考试化学试卷
9 . 下列有关核外电子排布的式子不正确的是
A.基态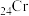 的电子排布式: 的电子排布式: |
B.基态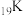 最外层电子的排布式: 最外层电子的排布式: |
C.基态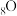 的轨道表示式: 的轨道表示式: |
D.基态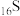 的轨道表示式: 的轨道表示式: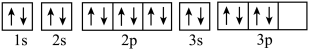 |
您最近一年使用:0次
2024-04-09更新
|
53次组卷
|
2卷引用:西藏拉萨市第三高级中学2023-2024学年高二下学期期中考试化学试卷
10 . 下列元素中,未成对电子最多的是
| A.Ne | B.P | C.Fe | D.Cr |
您最近一年使用:0次
2024-04-09更新
|
63次组卷
|
2卷引用:西藏拉萨市第三高级中学2023-2024学年高二下学期期中考试化学试卷



