1 . 工业上利用锌焙砂(主要成分为  ,含有少量
,含有少量 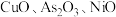 等)生产高纯
等)生产高纯  的流程示意图如下。
的流程示意图如下。
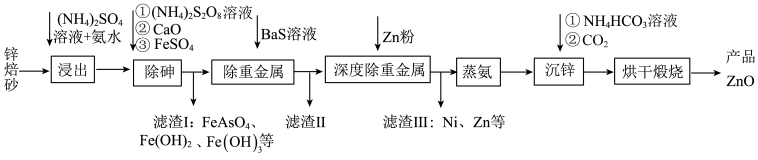
(1)用足量 溶液和氨水 “浸出” 锌焙砂。
溶液和氨水 “浸出” 锌焙砂。
①“浸出”前,锌焙砂预先粉碎的目的是___________ 。
②通过“浸出”步骤,锌焙砂中的 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)“浸出”时 转化为
转化为 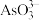 。“除砷”步骤①中用
。“除砷”步骤①中用  作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为
作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为___________
(3)“除重金属”时,加入 溶液。滤渣II中含有的主要物质是
溶液。滤渣II中含有的主要物质是___________ 和  。
。
(4)“蒸氨”时会出现白色固体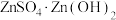 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)“沉锌”步骤①中加入足量 溶液将白色固体转化为
溶液将白色固体转化为  的离子方程式为
的离子方程式为___________ 。
(6)煅烧”步骤中,在一定温度下,煅烧 一定时间后固体失重质量分数为
一定时间后固体失重质量分数为  ,则
,则  的分解率 为
的分解率 为___________  (保留到小数点后一位)。已知: 固体失重质量分数
(保留到小数点后一位)。已知: 固体失重质量分数  。
。
(7)该流程中可循环利用的物质有___________ (答出任意 2 种即可)
 ,含有少量
,含有少量 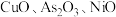 等)生产高纯
等)生产高纯  的流程示意图如下。
的流程示意图如下。
(1)用足量
 溶液和氨水 “浸出” 锌焙砂。
溶液和氨水 “浸出” 锌焙砂。①“浸出”前,锌焙砂预先粉碎的目的是
②通过“浸出”步骤,锌焙砂中的
 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为(2)“浸出”时
 转化为
转化为 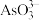 。“除砷”步骤①中用
。“除砷”步骤①中用  作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为
作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为(3)“除重金属”时,加入
 溶液。滤渣II中含有的主要物质是
溶液。滤渣II中含有的主要物质是 。
。(4)“蒸氨”时会出现白色固体
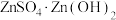 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)“沉锌”步骤①中加入足量
 溶液将白色固体转化为
溶液将白色固体转化为  的离子方程式为
的离子方程式为(6)煅烧”步骤中,在一定温度下,煅烧
 一定时间后固体失重质量分数为
一定时间后固体失重质量分数为  ,则
,则  的分解率 为
的分解率 为 (保留到小数点后一位)。已知: 固体失重质量分数
(保留到小数点后一位)。已知: 固体失重质量分数  。
。(7)该流程中可循环利用的物质有
您最近一年使用:0次
2 . 短周期元素A、B、C、D的原子序数依次增大,A元素原子的核外电子只有一种运动状态:基态B原子s能级的电子总数比p能级的多1;基态C原子中成对电子数是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题
(1)B原子的轨道表示式___________ 。
(2)A和C原子个数比为1∶1的化合物的电子式___________ 。
(3)元素A、B、C中,第一电离能最大的是___________ (填元素名称)。
(4)在B、C、D三种元素的简单离子中,其离子的半径最小的是___________ 。(填离子符号)
(5)C的简单氢化物的键角小于B的简单氢化物,其原因是___________ 。
(6)BC₃的空间结构为___________ 。
(7)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB晶体的密度为a g⋅cm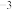 ,则晶体中两个最近D原子之间的距离为
,则晶体中两个最近D原子之间的距离为___________ pm(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
(1)B原子的轨道表示式
(2)A和C原子个数比为1∶1的化合物的电子式
(3)元素A、B、C中,第一电离能最大的是
(4)在B、C、D三种元素的简单离子中,其离子的半径最小的是
(5)C的简单氢化物的键角小于B的简单氢化物,其原因是
(6)BC₃的空间结构为
(7)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB晶体的密度为a g⋅cm
 ,则晶体中两个最近D原子之间的距离为
,则晶体中两个最近D原子之间的距离为 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。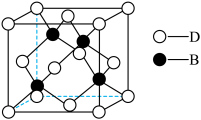
您最近一年使用:0次
名校
解题方法
3 . 化学平衡是中学化学的重点研究对象
I.氮及其化合物是重要的化工原料。回答下列问题:
(1)汽车尾气的储存还原技术法(NSR)可有效消除机动车尾气中NOx和CO的排放。
已知:

则2NO(g)+2CO(g)⇌2CO2(g)+N2(g) △H3=___________ kJ∙mol-1。
(2)在不同压强下,向恒容密闭容器中通入初始浓度为3.0molmol∙L-1NO、1.0mol∙L-1 ,使其发生反应:
,使其发生反应: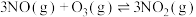
 kJ•mol-1。测得平衡时
kJ•mol-1。测得平衡时 的体积百分含量随着温度、压强变化情况如图所示:
的体积百分含量随着温度、压强变化情况如图所示:

① 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ 。
②下列数据能表明反应处于平衡状态的是___________ (填字母)。
A.混合气体的密度不变 B.混合气体的平均摩尔质量不变
C. D.混合气体的颜色深浅不变
D.混合气体的颜色深浅不变
③温度为 时,反应的平衡常数
时,反应的平衡常数
___________ (填具体数字)。
(3)对于可逆反应 ,若起始投料
,若起始投料 mol,达到平衡后,增大压强,
mol,达到平衡后,增大压强, 的体积分数
的体积分数___________ (填“增大”“减小”或“不变”)。
Ⅱ.
(4)水是极弱的电解质,常温下某电解质溶解在水中后,溶液中的 mol∙L-1,则该电解质可能是___________(填字母)。
mol∙L-1,则该电解质可能是___________(填字母)。
(5)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的 增大,可以采取的措施为___________(填字母)。
增大,可以采取的措施为___________(填字母)。
(6)常温下,为证明 是弱电解质,某同学取出10mL0·10mol•L-1氨水,用pH试纸测其pH为a;用蒸馏水稀释至1000mL,再用pH试纸测其pH为b;只要a、b满足关系
是弱电解质,某同学取出10mL0·10mol•L-1氨水,用pH试纸测其pH为a;用蒸馏水稀释至1000mL,再用pH试纸测其pH为b;只要a、b满足关系___________ (用等式或不等式表示),就可确认 是弱电解质。
是弱电解质。
(7)已知:25℃时,两种常见弱酸的电离平衡常数:
①25℃时,10mL0.10mol⋅L
 溶液与10mL0.10mol•L-1
溶液与10mL0.10mol•L-1 溶液中,离子总数大小关系:
溶液中,离子总数大小关系: 溶液
溶液___________  溶液(填“>”、“<”或“=”)。
溶液(填“>”、“<”或“=”)。
②向 溶液中通入过量
溶液中通入过量 反应的离子方程式为
反应的离子方程式为___________ 。
(8)已知:常温下, ,(在溶液中某离子完全沉淀时,认为该离子浓度小于
,(在溶液中某离子完全沉淀时,认为该离子浓度小于 )
)
① 的溶度积常数表达式
的溶度积常数表达式
___________ 。
② 完全沉淀的
完全沉淀的 为
为___________ 。
I.氮及其化合物是重要的化工原料。回答下列问题:
(1)汽车尾气的储存还原技术法(NSR)可有效消除机动车尾气中NOx和CO的排放。
已知:


则2NO(g)+2CO(g)⇌2CO2(g)+N2(g) △H3=
(2)在不同压强下,向恒容密闭容器中通入初始浓度为3.0molmol∙L-1NO、1.0mol∙L-1
 ,使其发生反应:
,使其发生反应: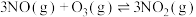
 kJ•mol-1。测得平衡时
kJ•mol-1。测得平衡时 的体积百分含量随着温度、压强变化情况如图所示:
的体积百分含量随着温度、压强变化情况如图所示:
①
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②下列数据能表明反应处于平衡状态的是
A.混合气体的密度不变 B.混合气体的平均摩尔质量不变
C.
 D.混合气体的颜色深浅不变
D.混合气体的颜色深浅不变③温度为
 时,反应的平衡常数
时,反应的平衡常数
(3)对于可逆反应
 ,若起始投料
,若起始投料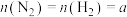 mol,达到平衡后,增大压强,
mol,达到平衡后,增大压强, 的体积分数
的体积分数Ⅱ.
(4)水是极弱的电解质,常温下某电解质溶解在水中后,溶液中的
 mol∙L-1,则该电解质可能是___________(填字母)。
mol∙L-1,则该电解质可能是___________(填字母)。A. | B.HCl | C. | D.NaOH |
(5)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的
 增大,可以采取的措施为___________(填字母)。
增大,可以采取的措施为___________(填字母)。A.再通入 | B.加碳酸钙粉末 | C.加氯化钠溶液 | D.加足量NaOH |
(6)常温下,为证明
 是弱电解质,某同学取出10mL0·10mol•L-1氨水,用pH试纸测其pH为a;用蒸馏水稀释至1000mL,再用pH试纸测其pH为b;只要a、b满足关系
是弱电解质,某同学取出10mL0·10mol•L-1氨水,用pH试纸测其pH为a;用蒸馏水稀释至1000mL,再用pH试纸测其pH为b;只要a、b满足关系 是弱电解质。
是弱电解质。(7)已知:25℃时,两种常见弱酸的电离平衡常数:
| 酸 | 电离平衡常数 |
 |  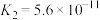 |
 | 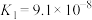 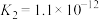 |

 溶液与10mL0.10mol•L-1
溶液与10mL0.10mol•L-1 溶液中,离子总数大小关系:
溶液中,离子总数大小关系: 溶液
溶液 溶液(填“>”、“<”或“=”)。
溶液(填“>”、“<”或“=”)。②向
 溶液中通入过量
溶液中通入过量 反应的离子方程式为
反应的离子方程式为(8)已知:常温下,
 ,(在溶液中某离子完全沉淀时,认为该离子浓度小于
,(在溶液中某离子完全沉淀时,认为该离子浓度小于 )
)①
 的溶度积常数表达式
的溶度积常数表达式
②
 完全沉淀的
完全沉淀的 为
为
您最近一年使用:0次
名校
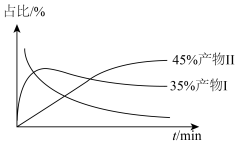
4 . 已知一定条件下,1-苯基丙炔(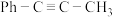 )可与HCl发生加成反应,反应如下:
)可与HCl发生加成反应,反应如下:
回答下列问题:
(1)在473K、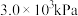 的高压HCl氛围下,以
的高压HCl氛围下,以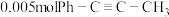 为原料进行上述反应。当产物Ⅰ和产物Ⅱ的产率均为10%时,体系放热akJ;当产物Ⅰ产率为15%和产物Ⅱ的产率为25%时,体系放热bkJ。若2a<b,则反应Ⅲ的焓变
为原料进行上述反应。当产物Ⅰ和产物Ⅱ的产率均为10%时,体系放热akJ;当产物Ⅰ产率为15%和产物Ⅱ的产率为25%时,体系放热bkJ。若2a<b,则反应Ⅲ的焓变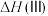
___________ 0(填“>”“=”或“<”),反应Ⅱ在该条件下的焓变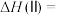
___________ (用含a、b的代数式表示)。
(2)下列能说明反应已经达到平衡的是___________(填标号)。
(3)在473K、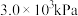 的高压HCl氛围下,以
的高压HCl氛围下,以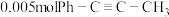 为原料进行上述反应,反应过程中除HCl外该炔烃及反应产物的占比[如:
为原料进行上述反应,反应过程中除HCl外该炔烃及反应产物的占比[如: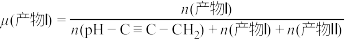 ]随时间的变化如图,则反应的活化能反应Ⅰ
]随时间的变化如图,则反应的活化能反应Ⅰ___________ 反应Ⅱ(填“大于”“小于”或“等于”),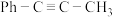 的平衡转化率为
的平衡转化率为___________ ,反应Ⅱ的
___________ ,为获得产物Ⅰ可采取的措施为___________ 。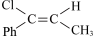 ,假定只发生反应Ⅲ,甲中
,假定只发生反应Ⅲ,甲中 的相关量随时间变化如图所示:
的相关量随时间变化如图所示:
___________ (填“大于”“小于”或“等于”,下同)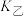 ,
,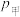
___________ 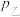 。
。
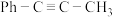 )可与HCl发生加成反应,反应如下:
)可与HCl发生加成反应,反应如下: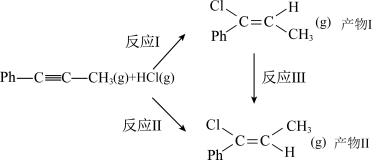
回答下列问题:
(1)在473K、
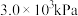 的高压HCl氛围下,以
的高压HCl氛围下,以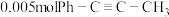 为原料进行上述反应。当产物Ⅰ和产物Ⅱ的产率均为10%时,体系放热akJ;当产物Ⅰ产率为15%和产物Ⅱ的产率为25%时,体系放热bkJ。若2a<b,则反应Ⅲ的焓变
为原料进行上述反应。当产物Ⅰ和产物Ⅱ的产率均为10%时,体系放热akJ;当产物Ⅰ产率为15%和产物Ⅱ的产率为25%时,体系放热bkJ。若2a<b,则反应Ⅲ的焓变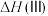
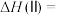
(2)下列能说明反应已经达到平衡的是___________(填标号)。
| A.反应体系内总质量不再变化 |
| B.恒容条件下,反应压强不再改变 |
| C.气体的平均相对分子质量不再变化 |
D.v(Ph-C≡C-CH3)=v( ) ) |
(3)在473K、
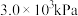 的高压HCl氛围下,以
的高压HCl氛围下,以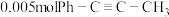 为原料进行上述反应,反应过程中除HCl外该炔烃及反应产物的占比[如:
为原料进行上述反应,反应过程中除HCl外该炔烃及反应产物的占比[如: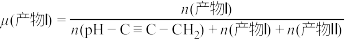 ]随时间的变化如图,则反应的活化能反应Ⅰ
]随时间的变化如图,则反应的活化能反应Ⅰ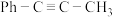 的平衡转化率为
的平衡转化率为
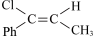 ,假定只发生反应Ⅲ,甲中
,假定只发生反应Ⅲ,甲中 的相关量随时间变化如图所示:
的相关量随时间变化如图所示: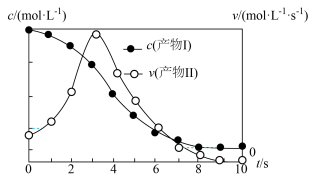
①0~3s内,甲容器中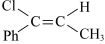 的反应速率增大的原因是
的反应速率增大的原因是

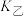 ,
,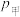
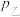 。
。
您最近一年使用:0次
2024-01-22更新
|
418次组卷
|
2卷引用:四川省成都市石室中学2023-2024学年高二下学期4月月考化学试卷
5 . 下图为常温Al(OH)3、Mn(OH)2、Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol·L-1),M为Al3+、Mn2+或Cu2+;c(M)≤10-5mol/L可认为M离子沉淀完全)。下列叙述正确的是
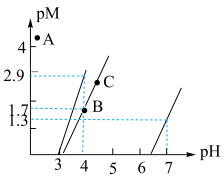
| A.常温下,Ksp[Al(OH)3]=10-22.3 |
| B.加适量CuCl2固体可使溶液由B点变到C点 |
C.若A点为含Al3+、Cu2+的混合溶液,则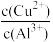 =10-0.7 =10-0.7 |
| D.浓度均为0.1mol/L的Cu2+和Mn2+可通过分步沉淀进行分离 |
您最近一年使用:0次
名校
解题方法
6 . 乙醇与水催化反应可以制得氢气。
(1)已知: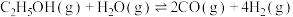
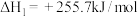 ,回答下列问题:
,回答下列问题:
①升温,平衡_______ 移动(填“向左”、“向右”、“不”);
②与原平衡相比较,增大压强,新平衡时
_______ (填“增大”、“减小”、“不变”,下同);
③恒温、恒容条件下。加入水蒸气,转化率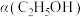
_______ ;
④恒温、恒压条件下,加入稀有气体,体积分数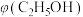
_______ 。
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I: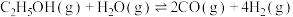
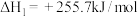
反应II:

反应III:

则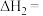
_______  。
。
(3)压强为100kPa, 的平衡产率与温度、起始时
的平衡产率与温度、起始时 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
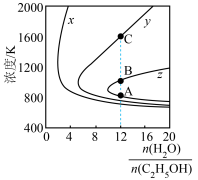
 的平衡产率:B点
的平衡产率:B点_______ C点(填“>”或“<”)。
(4)恒容条件下,将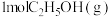 和
和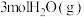 投入密闭容器中发生上述三个反应,平衡时
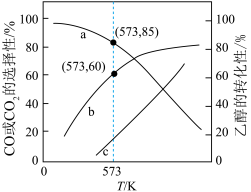
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
【已知:CO的选择性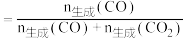 】
】
①表示乙醇转化率的曲线是_______ (填“a”、“b”或“c”)。
②573K时,反应II的压强平衡常数
_______ 。(已知:分压=总压 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
(1)已知:
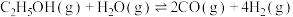
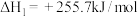 ,回答下列问题:
,回答下列问题:①升温,平衡
②与原平衡相比较,增大压强,新平衡时

③恒温、恒容条件下。加入水蒸气,转化率
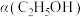
④恒温、恒压条件下,加入稀有气体,体积分数
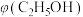
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I:
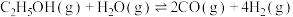
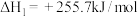
反应II:


反应III:


则
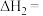
 。
。(3)压强为100kPa,
 的平衡产率与温度、起始时
的平衡产率与温度、起始时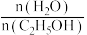 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
 的平衡产率:B点
的平衡产率:B点(4)恒容条件下,将
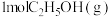 和
和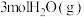 投入密闭容器中发生上述三个反应,平衡时
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
【已知:CO的选择性
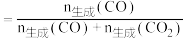 】
】①表示乙醇转化率的曲线是
②573K时,反应II的压强平衡常数

 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
您最近一年使用:0次
2023-11-14更新
|
366次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高二上学期11月期中化学试题
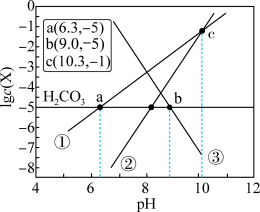
7 . 天然水体中的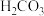 与空气中的
与空气中的 保持平衡。某地溶洞水体中
保持平衡。某地溶洞水体中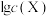 (X为
(X为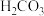 、
、 、
、 或
或 )与pH的线性关系如图所示。下列说法不正确的是
)与pH的线性关系如图所示。下列说法不正确的是
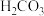 与空气中的
与空气中的 保持平衡。某地溶洞水体中
保持平衡。某地溶洞水体中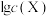 (X为
(X为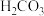 、
、 、
、 或
或 )与pH的线性关系如图所示。下列说法不正确的是
)与pH的线性关系如图所示。下列说法不正确的是
A.直线①代表 ,直线③代表 ,直线③代表 |
B.图中 |
C.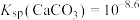 |
D.若空气中的 浓度增加,则水体中的 浓度增加,则水体中的 浓度减小 浓度减小 |
您最近一年使用:0次
2023-04-27更新
|
1027次组卷
|
3卷引用:四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题
四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题浙江省稽阳联谊学校2022-2023学年高三下学期4月联考化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建
2023·全国·模拟预测
解题方法
8 . 甲酸是基本有机化工原料之一,广泛应用于农药、皮革、染料、医药和橡胶等工业。在较高温度或有催化剂存在下,它会分解成CO和 或
或 和
和 。
。
反应Ⅰ: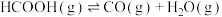

反应Ⅱ: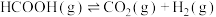
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的 =
=___________  。
。
(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。
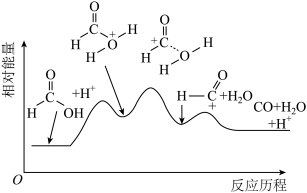
该反应的催化剂为___________ ,该反应历程中速率最慢步骤的化学方程式为___________ 。
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体, 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
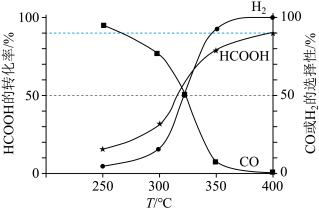
①400℃时,反应Ⅱ的平衡常数 =
=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×体积分数;结果保留小数点后1位)。
②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:___________ 。
(4)已知:25℃时, 的电离平衡常数
的电离平衡常数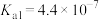 ,
,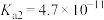 ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。
①将100mL 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL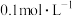 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:___________ 。
②25℃时,当溶液中 时,溶液中
时,溶液中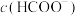 =
=___________  。
。
 或
或 和
和 。
。反应Ⅰ:
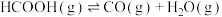

反应Ⅱ:
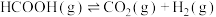
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的
 =
= 。
。(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。

该反应的催化剂为
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体,
 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
①400℃时,反应Ⅱ的平衡常数
 =
=②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:
(4)已知:25℃时,
 的电离平衡常数
的电离平衡常数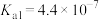 ,
,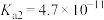 ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。①将100mL
 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL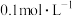 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:②25℃时,当溶液中
 时,溶液中
时,溶液中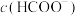 =
= 。
。
您最近一年使用:0次
9 . 难溶盐 可溶于盐酸,常温下,用
可溶于盐酸,常温下,用 调节
调节 浊液的
浊液的 ,测得体系中
,测得体系中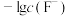 或
或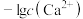 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 可溶于盐酸,常温下,用
可溶于盐酸,常温下,用 调节
调节 浊液的
浊液的 ,测得体系中
,测得体系中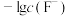 或
或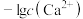 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.M代表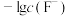 与 与 的变化曲线 的变化曲线 |
B.难溶盐 的溶度积常数 的溶度积常数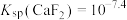 |
C.Y点的溶液中存在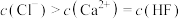 |
D.Z点的溶液中存在 |
您最近一年使用:0次
2023-02-18更新
|
1953次组卷
|
9卷引用:四川省绵阳市南山中学实验学校2022-2023学年高三下学期3月月考理科综合化学试题
四川省绵阳市南山中学实验学校2022-2023学年高三下学期3月月考理科综合化学试题湖南省百校2023届高三开年摸底联考化学试题浙江省杭州学军中学2022-2023学年高三下学期阶段性测试化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)先机卷 04 -【热题狂飙】2023年高考化学样卷(全国卷专用)广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题山东省蒙阴第一中学等5校2023届高三开学摸底联考化学试题河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)选择题11-15
名校
解题方法
10 .  可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
 可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是| A.氧化产物与还原产物物质的量之比为3:2 |
B.反应中有4.48 L  被氧化 被氧化 |
C.转移电子数为1.2 |
D.原混合气体中NO、 物质的量之比为3:7或4:1 物质的量之比为3:7或4:1 |
您最近一年使用:0次
2022-12-07更新
|
1511次组卷
|
4卷引用:四川省成都市第七中学2022-2023学年高一上学期12月月考化学试题



