1 . 某温度下,分别向10.00mL0.1mol/L的KCl和K2CrO4溶液中滴加0.1mol/L AgNO3溶液,滴加过程中-lgc(M)(M为Cl-或 )与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化,
)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化,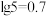 下列说法正确的是
下列说法正确的是
 )与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化,
)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化,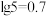 下列说法正确的是
下列说法正确的是 
| A.曲线L2表示lgc(Cl-)与V(AgNO3)的变化关系 |
| B.该温度下,Ksp(Ag2CrO4)=4.0×10-12 |
| C.x = 7.9 |
| D.相同实验条件下,若改为0.05mol/L的KCl和K2CrO4溶液,则曲线L2中N点移到Q点 |
您最近一年使用:0次
名校
2 . 在推进碳达峰、碳中和的大背景下,可以通过多种手段实现 的减排和资源化利用。请回答下列问题:
的减排和资源化利用。请回答下列问题:
(1)科学家设想,二氧化碳加氢还原转化为推进剂甲烷,以实现星际旅行的愿望。其中涉及的主要反应如下:
反应Ⅰ:

反应Ⅱ:

①已知: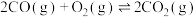
 ,则反应
,则反应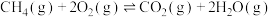 的
的
______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
②反应Ⅰ的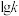 与温度的关系如图1所示。已知反应Ⅰ的速率方程为
与温度的关系如图1所示。已知反应Ⅰ的速率方程为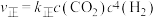 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。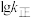 曲线的是
曲线的是______ (填“MH”或“NG”);反应Ⅰ的 (浓度平衡常数)与速率常数之间的关系为
(浓度平衡常数)与速率常数之间的关系为______ (用含 、
、 的代数式表示)。
的代数式表示)。
③向某恒压密闭容器中充入5 mol CO2、和20mol 、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量
、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量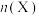 与温度T的关系如图2所示。
与温度T的关系如图2所示。______ (填含碳物质的分子式)的物质的量与温度的关系变化曲线;800K时,若平衡时容器内总压为p,图2中缺少的含碳物质平衡时为1.0 mol,则反应Ⅱ的压强平衡常数
_____ (结果保留两位有效数字, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
(2)二氧化碳加氢制甲醇发生的主要化学反应如下:
①
 kJ⋅mol
kJ⋅mol
②
 kJ⋅mol
kJ⋅mol
控制压强为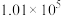 Pa、
Pa、 ,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对
,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对 的平衡转化率及
的平衡转化率及 的平衡选择性的影响如图3、4所示[
的平衡选择性的影响如图3、4所示[ 的选择性可表示为
的选择性可表示为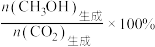 ]。
]。 的平衡转化率随温度升高而降低的原因是
的平衡转化率随温度升高而降低的原因是____________ 。
(3)金红石型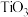 ,可用于
,可用于 催化氢化
催化氢化 ,其立方晶胞结构如图所示,设阿伏加德罗常数的值为
,其立方晶胞结构如图所示,设阿伏加德罗常数的值为 。
。______ 中心(填字母)。
A.三角形 B.四面体 C.六面体 D.八面体
②该晶体的密度为______ g·cm (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
 的减排和资源化利用。请回答下列问题:
的减排和资源化利用。请回答下列问题:(1)科学家设想,二氧化碳加氢还原转化为推进剂甲烷,以实现星际旅行的愿望。其中涉及的主要反应如下:
反应Ⅰ:


反应Ⅱ:


①已知:
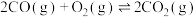
 ,则反应
,则反应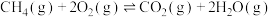 的
的
 、
、 、
、 的代数式表示)。
的代数式表示)。②反应Ⅰ的
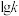 与温度的关系如图1所示。已知反应Ⅰ的速率方程为
与温度的关系如图1所示。已知反应Ⅰ的速率方程为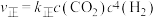 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。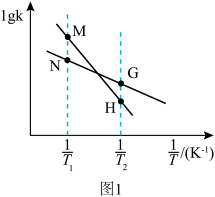
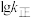 曲线的是
曲线的是 (浓度平衡常数)与速率常数之间的关系为
(浓度平衡常数)与速率常数之间的关系为 、
、 的代数式表示)。
的代数式表示)。③向某恒压密闭容器中充入5 mol CO2、和20mol
 、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量
、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量 与温度T的关系如图2所示。
与温度T的关系如图2所示。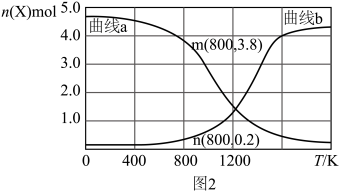

 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。(2)二氧化碳加氢制甲醇发生的主要化学反应如下:
①

 kJ⋅mol
kJ⋅mol
②

 kJ⋅mol
kJ⋅mol
控制压强为
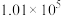 Pa、
Pa、 ,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对
,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对 的平衡转化率及
的平衡转化率及 的平衡选择性的影响如图3、4所示[
的平衡选择性的影响如图3、4所示[ 的选择性可表示为
的选择性可表示为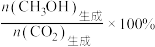 ]。
]。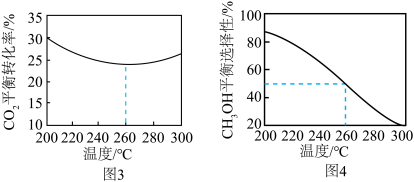
 的平衡转化率随温度升高而降低的原因是
的平衡转化率随温度升高而降低的原因是(3)金红石型
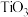 ,可用于
,可用于 催化氢化
催化氢化 ,其立方晶胞结构如图所示,设阿伏加德罗常数的值为
,其立方晶胞结构如图所示,设阿伏加德罗常数的值为 。
。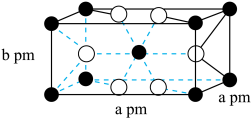
A.三角形 B.四面体 C.六面体 D.八面体
②该晶体的密度为
 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
3 . 唑草酮是一种广谱除草剂,在农业上应用范围比较广,除草效果比较好。唑草酮的一种合成路线如下图。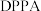 是一种叠氮化试剂。
是一种叠氮化试剂。
回答下列问题:
(1)C中官能团的名称为___________ 。
(2)由A生成C的反应类型为___________ ,该反应的目的是___________ 。
(3) 的化学方程式为
的化学方程式为___________ 。
(4)已知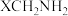 中
中 键的极性越大,则
键的极性越大,则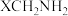 的碱性越弱。下列物质的碱性由强到弱的顺序为
的碱性越弱。下列物质的碱性由强到弱的顺序为___________ (填标号)。___________ 种。
①含有苯环,且苯环上有3个取代基
②能发生银镜反应
③含有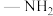
(6)化合物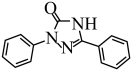 的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为
的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为___________ 和___________ 。

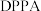 是一种叠氮化试剂。
是一种叠氮化试剂。回答下列问题:
(1)C中官能团的名称为
(2)由A生成C的反应类型为
(3)
 的化学方程式为
的化学方程式为(4)已知
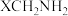 中
中 键的极性越大,则
键的极性越大,则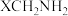 的碱性越弱。下列物质的碱性由强到弱的顺序为
的碱性越弱。下列物质的碱性由强到弱的顺序为a. 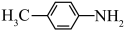 b.
b. 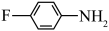 c.
c.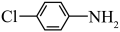
①含有苯环,且苯环上有3个取代基
②能发生银镜反应
③含有
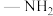
(6)化合物
 的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为
的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为
您最近一年使用:0次
7日内更新
|
166次组卷
|
2卷引用:2024届黑龙江省齐齐哈尔市高三下学期三模化学试题
解题方法
4 . 利用 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。
Ⅰ.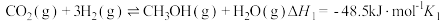
Ⅱ.
回答下列问题:
(1)已知反应Ⅲ的平衡常数 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式___________ 。
(2)一定条件下,向恒压密闭容器中以一定流速通入 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。 选择性的曲线是
选择性的曲线是___________ (填“ ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是___________ 。
②生成 的最佳条件是
的最佳条件是___________ (填标号)。


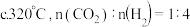

(3)一定温度下,向恒压密闭容器中通入 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为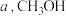 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数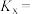
___________ ( 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。
(4)向压强恒为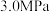 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气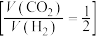 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是___________ 。
② 时,
时, 的平均反应速率
的平均反应速率
___________  。
。
③反应Ⅰ的速率方程可表示为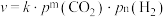 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,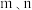 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则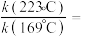
___________ 。
 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。Ⅰ.
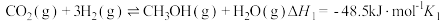
Ⅱ.

回答下列问题:
(1)已知反应Ⅲ的平衡常数
 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式(2)一定条件下,向恒压密闭容器中以一定流速通入
 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。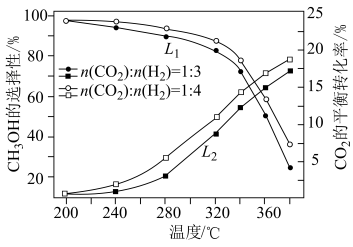
 选择性的曲线是
选择性的曲线是 ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是②生成
 的最佳条件是
的最佳条件是

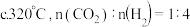

(3)一定温度下,向恒压密闭容器中通入
 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为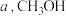 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数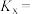
 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。(4)向压强恒为
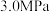 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气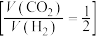 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是②
 时,
时, 的平均反应速率
的平均反应速率
 。
。③反应Ⅰ的速率方程可表示为
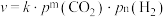 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,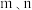 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则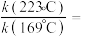
您最近一年使用:0次
5 . 甲烷蒸汽重整是制氢的主要途径,涉及反应如下:
反应Ⅰ:

反应Ⅱ:
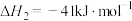
回答下列问题:
(1)标准摩尔生成焓( )是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的
)是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的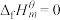 。根据下表数据计算a=
。根据下表数据计算a=________ 。
(2)向恒容密闭容器中按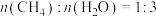 投料,初始总压强为
投料,初始总压强为 ,测得平衡时各组分的物质的量分数与温度的关系如图所示。
,测得平衡时各组分的物质的量分数与温度的关系如图所示。________ 。
②温度低于600℃时,d的物质的量分数随温度升高而增大,原因是________ 。
③600℃时, 的平衡转化率为
的平衡转化率为________ (保留两位有效数字),反应Ⅱ的
________ 。
(3)镍基复合催化剂可作为 重整的催化剂和
重整的催化剂和 吸收剂。
吸收剂。
①在催化剂(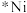 )表面
)表面 和
和 发生反应,生成CO、
发生反应,生成CO、 和
和 的反应机理如下。
的反应机理如下。
a.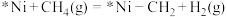
b.________
c.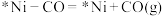
d.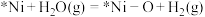
e.
补充b反应的方程式:________ 。
②镍基复合催化剂可吸收部分 。某温度下,向恒容密闭容器中按
。某温度下,向恒容密闭容器中按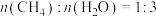 投料,初始总压强为
投料,初始总压强为 ,平衡后总压强为p,
,平衡后总压强为p, 的转化率为50%,
的转化率为50%, 。则
。则
________ (用含 、p的表达式表示)。
、p的表达式表示)。
反应Ⅰ:


反应Ⅱ:

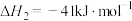
回答下列问题:
(1)标准摩尔生成焓(
 )是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的
)是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的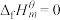 。根据下表数据计算a=
。根据下表数据计算a=物质 |
|
|
|
| -74.8 | -110.5 | -241.8 |
(2)向恒容密闭容器中按
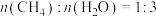 投料,初始总压强为
投料,初始总压强为 ,测得平衡时各组分的物质的量分数与温度的关系如图所示。
,测得平衡时各组分的物质的量分数与温度的关系如图所示。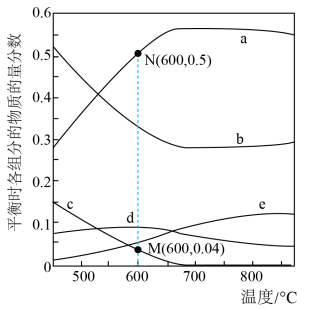
②温度低于600℃时,d的物质的量分数随温度升高而增大,原因是
③600℃时,
 的平衡转化率为
的平衡转化率为
(3)镍基复合催化剂可作为
 重整的催化剂和
重整的催化剂和 吸收剂。
吸收剂。①在催化剂(
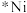 )表面
)表面 和
和 发生反应,生成CO、
发生反应,生成CO、 和
和 的反应机理如下。
的反应机理如下。a.
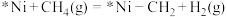
b.________
c.
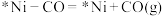
d.
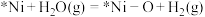
e.

补充b反应的方程式:
②镍基复合催化剂可吸收部分
 。某温度下,向恒容密闭容器中按
。某温度下,向恒容密闭容器中按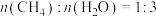 投料,初始总压强为
投料,初始总压强为 ,平衡后总压强为p,
,平衡后总压强为p, 的转化率为50%,
的转化率为50%, 。则
。则
 、p的表达式表示)。
、p的表达式表示)。
您最近一年使用:0次
7日内更新
|
169次组卷
|
2卷引用:山东省德州市2024届高三下学期高考适应性练习(二)化学试题
解题方法
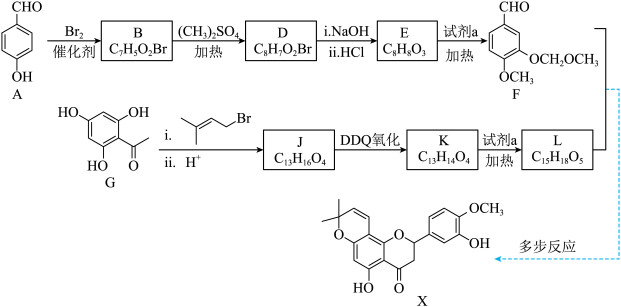
6 . 黄酮类物质X具有抗金黄色葡萄球菌、大肠杆菌等活性,一种合成路线如下。________ 。
(2)A→B反应的化学方程式是________ 。
(3)B→D的反应类型是________ 。
(4)E→F的反应同时生成HCl,试剂a的结构简式是________ 。
(5)G转化为J需加入 。
。
①J的结构简式是________ 。
② 的主要作用是
的主要作用是________ 。
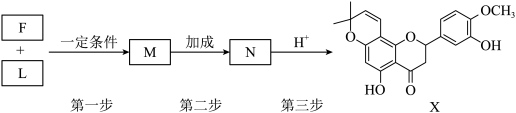
(6)F和L生成X经历如下多步反应:________ 。
②三步反应中,涉及生成手性碳原子的为第________ 步(填“一”“二”或“三”)。
已知: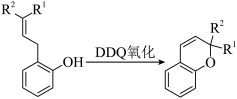
(2)A→B反应的化学方程式是
(3)B→D的反应类型是
(4)E→F的反应同时生成HCl,试剂a的结构简式是
(5)G转化为J需加入
 。
。①J的结构简式是
②
 的主要作用是
的主要作用是(6)F和L生成X经历如下多步反应:
已知:Ⅰ.
Ⅱ.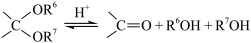
②三步反应中,涉及生成手性碳原子的为第
您最近一年使用:0次
名校
7 . 重氮羰基化合物聚合可获得主链由一个碳原子作为重复结构单元的聚合物,为制备多官能团聚合物提供了新方法。利用该方法合成聚合物P的反应路线如图下列说法错误的是

| A.反应①中有氮元素的单质生成 |
| B.反应②的副产物不可能是网状结构的高分子 |
| C.在酸性或碱性的水溶液中,聚合物P的溶解程度比在水中的大 |
| D.反应②中聚合物和E的化学计量数之比为2:n |
您最近一年使用:0次
8 . 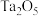 和
和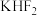 按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数
按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数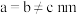 ,
, ,
, 键键长为
键键长为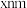 。下列说法错误的是
。下列说法错误的是
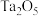 和
和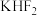 按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数
按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数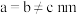 ,
, ,
, 键键长为
键键长为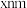 。下列说法错误的是
。下列说法错误的是
A.制备晶体的化学方程式: |
B.O原子分数坐标可能为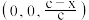 , ,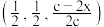 |
C.与棱心 等距且紧邻的 等距且紧邻的 有8个 有8个 |
D.该晶体密度为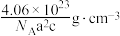 |
您最近一年使用:0次
名校
9 . 二氧化铈( )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)“氧化焙烧”后,Ce元素转化为 和
和 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式_______ 。
(2)“酸浸”时,铈的浸出率与温度、 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为_______ (填标号)。不能用盐酸代替硫酸进行酸浸,理由是_______ 。 B.75℃、
B.75℃、 C.85℃、
C.85℃、 D.100℃、
D.100℃、
(3)“系列操作”包含以下几个过程: 不能溶于有机物TBP,
不能溶于有机物TBP,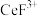 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。
“系列操作”在_______ (填仪器名称)中完成,“有机层B”中发生反应的离子方程式为_______ 。
(4)“调pH”中,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于_______ (已知:25℃时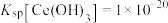 )。
)。
(5)“氧化”中,氧化剂与还原剂的物质的量之比为_______ 。
(6) 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为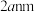 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有_______ 个。
②在尾气消除过程中 与
与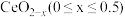 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和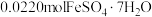 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: ),则x的值为
),则x的值为_______ ,则此时氧空位率为_______ 。
 )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。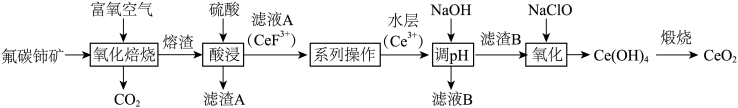
(1)“氧化焙烧”后,Ce元素转化为
 和
和 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式(2)“酸浸”时,铈的浸出率与温度、
 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为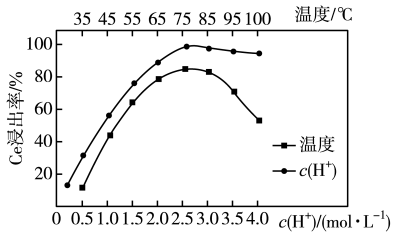
 B.75℃、
B.75℃、 C.85℃、
C.85℃、 D.100℃、
D.100℃、
(3)“系列操作”包含以下几个过程:
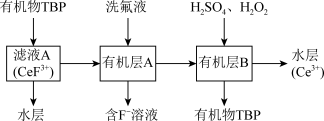
 不能溶于有机物TBP,
不能溶于有机物TBP, 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。“系列操作”在
(4)“调pH”中,要使
 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于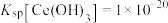 )。
)。(5)“氧化”中,氧化剂与还原剂的物质的量之比为
(6)
 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。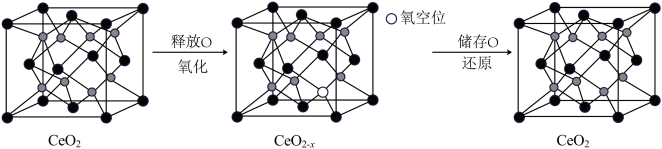
 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为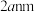 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有②在尾气消除过程中
 与
与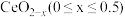 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和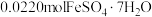 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: ),则x的值为
),则x的值为
您最近一年使用:0次
名校
10 . Ⅰ、CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①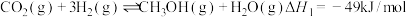
②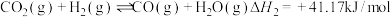
③
(1)③___________ (填“高温自发”“低温自发”或“任何温度下都自发”),该反应中活化能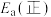
___________ 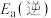 。(填“>”或“<”)
。(填“>”或“<”)
(2)反应①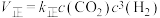 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
___________  。升高温度,
。升高温度, 增大的倍数
增大的倍数___________ (填“大于”“小于”或“等于”) 增大的倍数。
增大的倍数。
(3)一定压强下,往某密闭容器中按投料比 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ 。
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大
C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[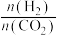 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=___________  (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
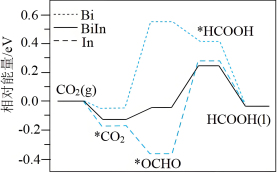
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是___________ 。
①
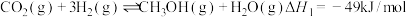
②
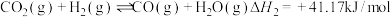
③

(1)③
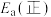
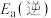 。(填“>”或“<”)
。(填“>”或“<”)(2)反应①
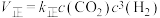 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
 。升高温度,
。升高温度, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(3)一定压强下,往某密闭容器中按投料比
 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。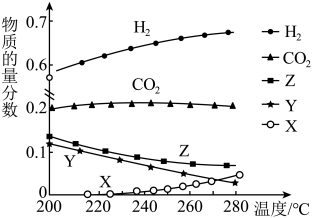
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大
 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[
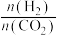 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp= (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。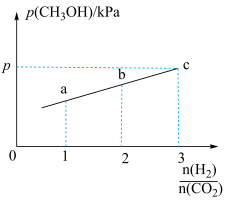
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
您最近一年使用:0次






