解题方法
1 . CO与 反应可合成可再生能源甲醇,反应为
反应可合成可再生能源甲醇,反应为 。回答下列问题。
。回答下列问题。
I.已知:反应①

反应②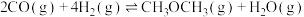

(1)则 的
的
_______ (用 、
、 表示)。
表示)。
II.在一个容积可变的密闭容器中充有5molCO和 ,在催化剂作用下发生反应
,在催化剂作用下发生反应 。CO的平衡转化率(
。CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。
)与温度(T)、压强(p)的关系如图所示。
_______  (填“>”或“<”,下同)。温度为
(填“>”或“<”,下同)。温度为 ,压强
,压强 时,D点反应速率:
时,D点反应速率:
_______  。
。
(3)A、B、C三点平衡常数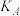 、
、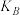 、
、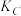 的大小关系为
的大小关系为_______ 。
(4)A点的正反应速率_______ (填“>”或“<”)C点的逆反应速率。
(5)恒温恒压条件下,下列能说明反应达到平衡状态的是_______ (填标号)。
a.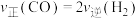
b.容器内混合气体的密度不再改变
c.CO和 的物质的量之比不再改变
的物质的量之比不再改变
d.混合气体的平均相对分子质量不再改变
(6)若达到平衡状态A时,容器的容积为5L,则在平衡状态B时容器的容积为_______ L。
(7)C点时,若再充入5mol的 ,保持恒温恒压再次平衡时CO的物质的量分数
,保持恒温恒压再次平衡时CO的物质的量分数_______ (填“增大”“减小”或“不变”)。
 反应可合成可再生能源甲醇,反应为
反应可合成可再生能源甲醇,反应为 。回答下列问题。
。回答下列问题。I.已知:反应①


反应②
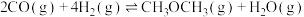

(1)则
 的
的
 、
、 表示)。
表示)。II.在一个容积可变的密闭容器中充有5molCO和
 ,在催化剂作用下发生反应
,在催化剂作用下发生反应 。CO的平衡转化率(
。CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。
)与温度(T)、压强(p)的关系如图所示。

 (填“>”或“<”,下同)。温度为
(填“>”或“<”,下同)。温度为 ,压强
,压强 时,D点反应速率:
时,D点反应速率:
 。
。(3)A、B、C三点平衡常数
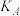 、
、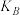 、
、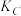 的大小关系为
的大小关系为(4)A点的正反应速率
(5)恒温恒压条件下,下列能说明反应达到平衡状态的是
a.
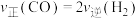
b.容器内混合气体的密度不再改变
c.CO和
 的物质的量之比不再改变
的物质的量之比不再改变 d.混合气体的平均相对分子质量不再改变
(6)若达到平衡状态A时,容器的容积为5L,则在平衡状态B时容器的容积为
(7)C点时,若再充入5mol的
 ,保持恒温恒压再次平衡时CO的物质的量分数
,保持恒温恒压再次平衡时CO的物质的量分数
您最近一年使用:0次
解题方法
2 . 浓差电池是利用物质的浓度差产生电势的一种装置,其原理是高浓度溶液向低浓度溶液扩散而引发的一类电池,最终两边电解质溶液浓度相等。某化学兴趣小组同学设计的浓差电池如图所示。
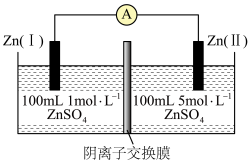
| A.Zn(Ⅰ)为电源的负极,发生氧化反应 |
B.工作时,溶液中 由左向右移动 由左向右移动 |
C.Zn(Ⅱ)极的电极反应为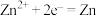 |
D.当两池 相等时,电路中转移 相等时,电路中转移 |
您最近一年使用:0次
2024-07-12更新
|
196次组卷
|
2卷引用:辽宁省七校2024-2025学年高二下学期期初考试化学试卷
名校
3 . Ⅰ、CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①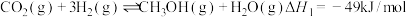
②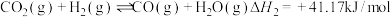
③
(1)③___________ (填“高温自发”“低温自发”或“任何温度下都自发”),该反应中活化能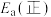
___________ 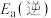 。(填“>”或“<”)
。(填“>”或“<”)
(2)反应①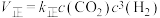 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
___________  。升高温度,
。升高温度, 增大的倍数
增大的倍数___________ (填“大于”“小于”或“等于”) 增大的倍数。
增大的倍数。
(3)一定压强下,往某密闭容器中按投料比 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ 。
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大
C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[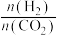 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=___________ 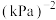 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
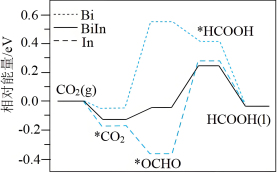
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是___________ 。
①
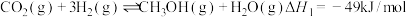
②
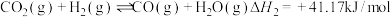
③

(1)③
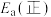
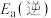 。(填“>”或“<”)
。(填“>”或“<”)(2)反应①
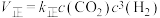 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
 。升高温度,
。升高温度, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(3)一定压强下,往某密闭容器中按投料比
 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。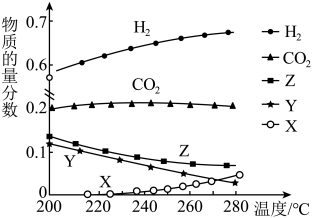
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大
 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[
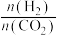 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=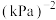 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。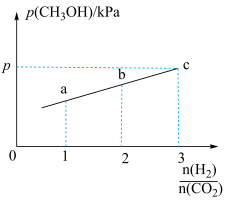
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
您最近一年使用:0次
2024-05-24更新
|
577次组卷
|
3卷引用:2024届辽宁省实验中学高三下学期考前模拟训练(五模)化学试卷
解题方法
4 . 甲醇和乙醇都是清洁能源,也是重要的化工原料。回答下列问题:
(1)工业上利用合成气合成甲醇: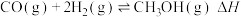
已知:① ;
;
②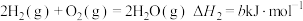 ;
;
③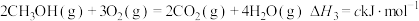
上述反应中的
___________  。
。
(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇: ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢: ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。___________ 下(高温、低温、任意温度)自发进行;图示历程包括___________ 个基元反应;其中决速反应是反应___________ (填序号),写出该步反应式:___________ 。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
① (主反应);
(主反应);
② (主反应);
(主反应);
③ (副反应)。
(副反应)。
一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是___________ ;采用水分子膜分离技术的容器是___________ (填“甲”或“乙”)。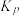 为
为___________  。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
(1)工业上利用合成气合成甲醇:
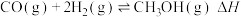
已知:①
 ;
;②
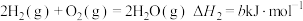 ;
;③
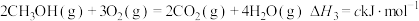
上述反应中的

 。
。(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇:
 ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。| A.当CO体积分数不变时达到平衡状态 |
| B.平衡后充入少量氩气,平衡不移动 |
| C.平衡后再充入0.1molCO和0.1molH2,CO平衡转化率增大 |
| D.增大催化剂质量,正、逆反应速率同倍数增大 |
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢:
 ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
①
 (主反应);
(主反应);②
 (主反应);
(主反应);③
 (副反应)。
(副反应)。一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是
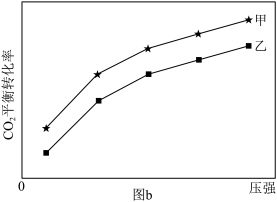
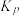 为
为 。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
您最近一年使用:0次
名校
解题方法
5 . 葡萄糖水溶液中,存在链状和环状结构间的平衡。常温下,各种葡萄糖结构及其所占百分含量如下图所示。已知各种葡萄糖结构中链状结构的熵最大,下列说法不正确的是
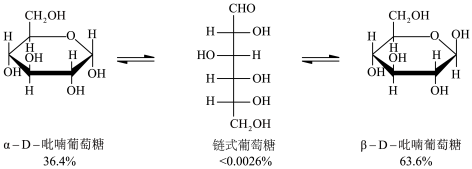
| A.葡萄糖由链状转化为环状结构发生了加成反应 |
B.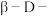 吡喃葡萄糖的稳定性大于 吡喃葡萄糖的稳定性大于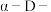 吡喃葡萄糖 吡喃葡萄糖 |
| C.葡萄糖链状和环状结构中均有4个手性碳原子 |
D.葡萄糖由链状转化为环状结构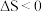 , , |
您最近一年使用:0次
2024-04-16更新
|
661次组卷
|
2卷引用:辽宁省大连市第十二中学2023-2024学年高二下学期6月份学情反馈化学试卷
6 . 硼化镁晶体的理想模型中,镁原子和硼原子分层排布,彼此分层间隔。硼原子(黑球,半径为a)和镁原子(白球,半径为b)在平面上的投影如图1.下列说法正确的是
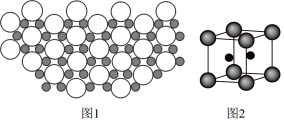
A.晶胞边长为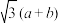 | B.镁原子的价电子排布为 |
C.该晶体的化学式为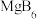 | D.在硼化镁晶体中,硼原子的配位数为3 |
您最近一年使用:0次
2024-04-05更新
|
234次组卷
|
2卷引用:辽宁省部分学校2023-2024学年高二下学期6月月考试卷 化学试题
7 . 氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用.涉及反应如下:
反应Ⅰ:CO(g)+3H2(g) CH4(g)+H2O(g)
CH4(g)+H2O(g)  =-206.2kJ·mol-1
=-206.2kJ·mol-1
反应Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 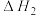
反应Ⅲ:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g) 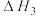 =-165.0kJ·mol-1
=-165.0kJ·mol-1
回答下列问题:
(1)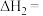
_____________  。
。
(2)已知反应Ⅱ的速率方程为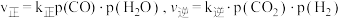 ,其中
,其中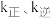 分别为正、逆反应的速率常数。如图(lgk表示速率常数的对数:
分别为正、逆反应的速率常数。如图(lgk表示速率常数的对数: 表示温度的倒数)所示a、b、c、d四条斜线中,能表示
表示温度的倒数)所示a、b、c、d四条斜线中,能表示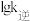 随
随 变化关系的是斜线
变化关系的是斜线__________ (填标号)。 时,在固定容积的容器中充入一定量的
时,在固定容积的容器中充入一定量的 和1molCO,平衡时
和1molCO,平衡时 和CO的转化率(α)及
和CO的转化率(α)及 和
和 的物质的量(n)随
的物质的量(n)随 变化的情况如图所示。
变化的情况如图所示。 变化的曲线分别是
变化的曲线分别是__________ 、__________ (填标号);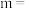
_____________ ; 的选择性
的选择性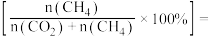
_____________ 。
②已知起始充入1mol的CO和0.5mol的 进行上述反应时,起始压强为
进行上述反应时,起始压强为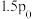 。反应1的
。反应1的
_____________ (用 表示):温度
表示):温度 ,
,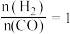 时,
时,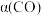 可能对应图中X、Y、Z、W四点中的
可能对应图中X、Y、Z、W四点中的__________ (填标号)。
反应Ⅰ:CO(g)+3H2(g)
 CH4(g)+H2O(g)
CH4(g)+H2O(g)  =-206.2kJ·mol-1
=-206.2kJ·mol-1反应Ⅱ:CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g) 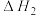
反应Ⅲ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g) 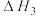 =-165.0kJ·mol-1
=-165.0kJ·mol-1回答下列问题:
(1)
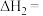
 。
。(2)已知反应Ⅱ的速率方程为
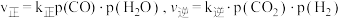 ,其中
,其中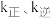 分别为正、逆反应的速率常数。如图(lgk表示速率常数的对数:
分别为正、逆反应的速率常数。如图(lgk表示速率常数的对数: 表示温度的倒数)所示a、b、c、d四条斜线中,能表示
表示温度的倒数)所示a、b、c、d四条斜线中,能表示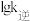 随
随 变化关系的是斜线
变化关系的是斜线
 时,在固定容积的容器中充入一定量的
时,在固定容积的容器中充入一定量的 和1molCO,平衡时
和1molCO,平衡时 和CO的转化率(α)及
和CO的转化率(α)及 和
和 的物质的量(n)随
的物质的量(n)随 变化的情况如图所示。
变化的情况如图所示。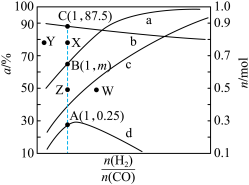
 变化的曲线分别是
变化的曲线分别是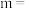
 的选择性
的选择性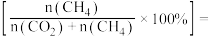
②已知起始充入1mol的CO和0.5mol的
 进行上述反应时,起始压强为
进行上述反应时,起始压强为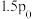 。反应1的
。反应1的
 表示):温度
表示):温度 ,
,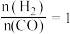 时,
时,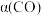 可能对应图中X、Y、Z、W四点中的
可能对应图中X、Y、Z、W四点中的
您最近一年使用:0次
2024-03-15更新
|
630次组卷
|
6卷引用:大题预测卷(辽宁专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
(已下线)大题预测卷(辽宁专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)山东省烟台市2024届高三一模化学试题2024届山东省高三下学期第一次练兵考试一模化学试题山东省德州市2023-2024学年高三下学期一模考试化学试题(已下线)专题14 化学反应原理综合题-【好题汇编】5年(2020-2024)高考1年模拟化学真题分类汇编(山东专用)专题7 化学反应速率与化学平衡-化学反应速率及平衡计算
8 . 常温下,FeS和ZnS的饱和溶液中,金属阳离子( )与
)与 的物质的量浓度的负对数关系如图所示。下列说法正确的是
的物质的量浓度的负对数关系如图所示。下列说法正确的是

 )与
)与 的物质的量浓度的负对数关系如图所示。下列说法正确的是
的物质的量浓度的负对数关系如图所示。下列说法正确的是
A.取一定量主要含 、 、 的浓缩液,向其中滴加 的浓缩液,向其中滴加 溶液,当ZnS开始沉淀时,溶液中的 溶液,当ZnS开始沉淀时,溶液中的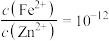 |
B.上述FeS饱和溶液中,只含有 和 和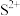 ,不含其他离子 ,不含其他离子 |
C.常温下,将足量ZnS分别加入体积均为100mL的  溶液和 溶液和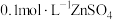 溶液中,充分搅拌后, 溶液中,充分搅拌后,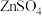 溶液中 溶液中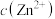 较 较 溶液中 溶液中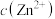 大 大 |
D.常温下,向ZnS饱和溶液中加入稀硝酸,发生的反应为 |
您最近一年使用:0次
2023-11-12更新
|
823次组卷
|
2卷引用:辽宁省葫芦岛市协作校2023-2024学年高三上学期第二次考试化学试题
解题方法
9 . 以有机物A为原料合成药物F的路线如下:

回答下列问题:
(1)A分子中碳原子的杂化方式为___________ ,用*标记A分子中含有的手性碳原子:___________ 。
(2)试剂X的分子式为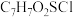 ,写出试剂X的结构简式:
,写出试剂X的结构简式:___________ , 的反应类型为
的反应类型为___________ 。
(3)反应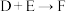 中,每1molD参与反应,产生1molHBr,写出
中,每1molD参与反应,产生1molHBr,写出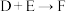 的反应的化学方程式:
的反应的化学方程式:___________ 。
(4)在C的同分异构体中,同时满足下列条件的有___________ 种(不含立体异构),其中核磁共振氢谱显示有6组氢(氢原子数目比为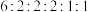 )的结构简式为
)的结构简式为___________ (写一种)。
①含有苯环和2个甲基,苯环上只有2个对位取代基(不是甲基);
②与 溶液不发生显色反应,但能与金属钠反应生成气体;
溶液不发生显色反应,但能与金属钠反应生成气体;
③能发生银镜反应,不能发生水解反应。
(5)参照上述合成路线,设计以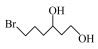
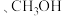 为原料制备
为原料制备 的合成路线:
的合成路线:___________ (无机试剂和有机溶剂任用)。

回答下列问题:
(1)A分子中碳原子的杂化方式为
(2)试剂X的分子式为
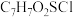 ,写出试剂X的结构简式:
,写出试剂X的结构简式: 的反应类型为
的反应类型为(3)反应
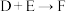 中,每1molD参与反应,产生1molHBr,写出
中,每1molD参与反应,产生1molHBr,写出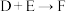 的反应的化学方程式:
的反应的化学方程式:(4)在C的同分异构体中,同时满足下列条件的有
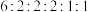 )的结构简式为
)的结构简式为①含有苯环和2个甲基,苯环上只有2个对位取代基(不是甲基);
②与
 溶液不发生显色反应,但能与金属钠反应生成气体;
溶液不发生显色反应,但能与金属钠反应生成气体;③能发生银镜反应,不能发生水解反应。
(5)参照上述合成路线,设计以

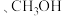 为原料制备
为原料制备 的合成路线:
的合成路线:
您最近一年使用:0次
名校
解题方法
10 . 溶液X中含有下表离子中的某5种,且其浓度均为 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是阳离子 | 阴离子 |
|
|
| A.X溶液中可能含3种阳离子、2种阴离子 | B.X溶液中不可能含有 或 或 |
C.生成的无色气体是 | D.根据电荷守恒,原溶液中一定含 |
您最近一年使用:0次
2023-04-20更新
|
1605次组卷
|
10卷引用:辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题
辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题辽宁省沈阳市铁路实验中学2022-2023学年高一下学期第一次月考化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题上海市育才中学2022-2023学年高三上学期10月月考化学试题黑龙江省鹤岗市绥滨县第一中学2021-2022学年高三上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题河北省秦皇岛市昌黎第一中学2023届高三第一次调研考试化学试题河北省石家庄市第二中学2023-2024高一上学期第一次诊断测评化学试题黑龙江省实验中学2024-2025学年高三上学期9月月考 化学试题

 、
、 、
、 、
、
 、
、 、
、


