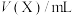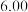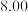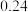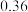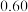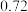名校
1 . Ⅰ、CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①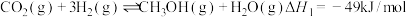
②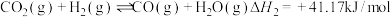
③
(1)③___________ (填“高温自发”“低温自发”或“任何温度下都自发”),该反应中活化能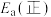
___________ 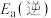 。(填“>”或“<”)
。(填“>”或“<”)
(2)反应①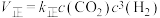 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
___________  。升高温度,
。升高温度, 增大的倍数
增大的倍数___________ (填“大于”“小于”或“等于”) 增大的倍数。
增大的倍数。
(3)一定压强下,往某密闭容器中按投料比 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ 。
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大
C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[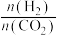 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=___________ 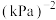 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是___________ 。
①
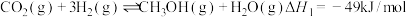
②
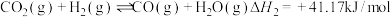
③

(1)③
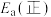
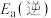 。(填“>”或“<”)
。(填“>”或“<”)(2)反应①
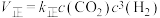 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
 。升高温度,
。升高温度, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(3)一定压强下,往某密闭容器中按投料比
 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。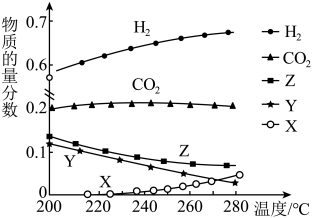
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大
 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[
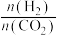 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=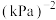 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
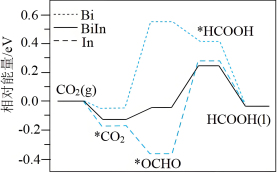
您最近一年使用:0次
2024-06-06更新
|
341次组卷
|
3卷引用:吉林省长春市东北师范大学附属实验学校2023-2024学年高三下学期七模化学试题
名校
解题方法
2 . 铁元素广泛存在于自然界中,铁及其化合物有着丰富的化学性质。
(1) 铁粉与
铁粉与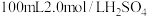 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。 反应平均速率
反应平均速率
_______ 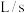 ;
;
② 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:_______ 。
(2)常温下, 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)
(3)反应 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。__________________________________________ ;
②反应过程中由于 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:____________________________________ 。
(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为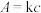 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: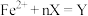 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为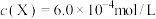 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
根据此数据,可以推断反应计量数 ,并计算
,并计算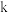 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。
已知:1.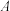 为吸光度,无单位;
为吸光度,无单位;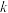 为常数,单位为
为常数,单位为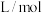 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。
①使用该方法时,需要控制 在2~9之间,其原因为:
在2~9之间,其原因为:____________________ 。
② 中
中 的配位数为
的配位数为_______ 。(填标号)
A.2 B.3 C.6 D.8
③该实验条件下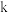 值为
值为______________ 。
(1)
 铁粉与
铁粉与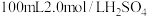 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。
 反应平均速率
反应平均速率
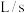 ;
;②
 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:(2)常温下,
 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)A.增大 溶液的浓度,平衡常数增大 溶液的浓度,平衡常数增大 |
B.向上述平衡体系中加入适量 固体,平衡不移动 固体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,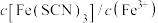 减小 减小 |
(3)反应
 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。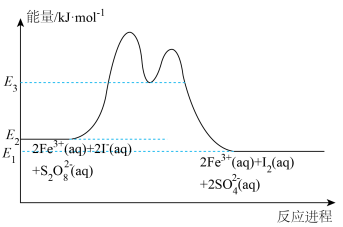
②反应过程中由于
 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为
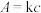 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: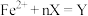 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为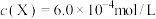 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 ,并计算
,并计算 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。已知:1.
 为吸光度,无单位;
为吸光度,无单位; 为常数,单位为
为常数,单位为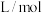 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。2.邻二氮菲的结构如图所示: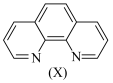
①使用该方法时,需要控制
 在2~9之间,其原因为:
在2~9之间,其原因为:②
 中
中 的配位数为
的配位数为A.2 B.3 C.6 D.8
③该实验条件下
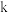 值为
值为
您最近一年使用:0次
3 . 下图为常温Al(OH)3、Mn(OH)2、Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol·L-1),M为Al3+、Mn2+或Cu2+;c(M)≤10-5mol/L可认为M离子沉淀完全)。下列叙述正确的是
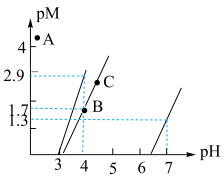
| A.常温下,Ksp[Al(OH)3]=10-22.3 |
| B.加适量CuCl2固体可使溶液由B点变到C点 |
C.若A点为含Al3+、Cu2+的混合溶液,则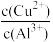 =10-0.7 =10-0.7 |
| D.浓度均为0.1mol/L的Cu2+和Mn2+可通过分步沉淀进行分离 |
您最近一年使用:0次
名校
解题方法
4 . 随着小型电子设备以及新能源汽车产业的蓬勃发展,退役锂离子电池数量逐年递增,废旧锂离子电池的回收成为目前新能源产业重要的发展方向,科研人员通过对大量废旧钴酸锂( )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
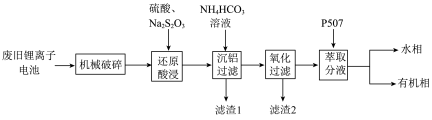
表1 粉料金属成分质量分数%
表2 部分阳离子以氢氧化物形式沉淀时溶液的
已知:Co(III)有较强氧化性, 有较强还原性。
有较强还原性。
(1)机械破碎的目的是_______
(2)还原酸浸的主要反应中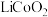 和
和 的物质的量之比为
的物质的量之比为_______
(3)沉铝操作中,加入 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分_______ 、_______ 。
(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式_______ ;实际生产中,随着反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大,可能的原因为:① 氧化成
氧化成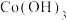 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②_______
(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为_______ 左右。

(6)该工艺中,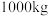 废料生产得到
废料生产得到 的质量为
的质量为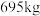 ,则该工艺的产率为
,则该工艺的产率为_______ (保留2位有效数字)。
 )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
表1 粉料金属成分质量分数%
| Co | Li | Al | Cu | Fe | Mn | Ni |
| 23.6 | 3.4 | 3.2 | 0.84 | 2.8 | 1.1 | 0.34 |

| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 | 4.7 |
完全沉淀的 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 | 6.7 |
 有较强还原性。
有较强还原性。(1)机械破碎的目的是
(2)还原酸浸的主要反应中
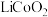 和
和 的物质的量之比为
的物质的量之比为(3)沉铝操作中,加入
 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的
 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式 氧化成
氧化成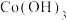 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相
 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为
(6)该工艺中,
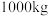 废料生产得到
废料生产得到 的质量为
的质量为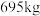 ,则该工艺的产率为
,则该工艺的产率为
您最近一年使用:0次
2023-12-05更新
|
869次组卷
|
3卷引用:吉林省长春市东北师大附中2023-2024学年高三上学期第三次摸底考试化学科试卷
名校
解题方法
5 . 罗美昔布是一种抗炎药,临床用于治疗风湿性关节炎、牙痛等,化合物W是合成罗美昔布的一种中间体,W合成路线如下:
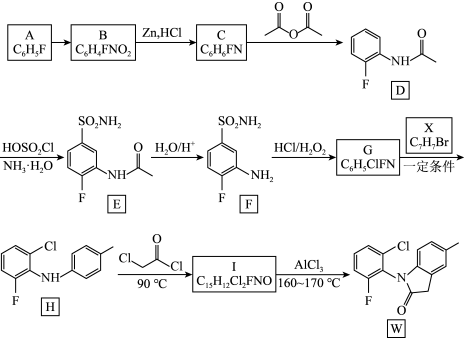
已知:(ⅰ)
(ⅱ)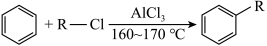
回答下列问题:
(1)A的化学名称为_______ ,B中含氧官能团的名称为_______ 。
(2)由C生成D的反应类型为_______ ;D中所含元素(H除外)第一电离能由大到小的顺序为_______ 。
(3)设置D→E和F→G两步反应的作用是_______ 。
(4)写出由G生成H的化学方程式_______ 。
(5)写出Ⅰ的结构简式_______ 。
(6)M为D的同系物,相对分子质量比D大14。M的同分异构体中同时满足下列条件的共有_______ 种(不考虑立体异构)。
①属于芳香族化合物;
②苯环上含有两个取代基,且位置相对;
③含有 ;
;
④能发生银镜反应。
满足上述条件的同分异构体中,核磁共振氢谱为3∶2∶2∶2∶1的同分异构体为_______ (写出其中两种的结构简式)。

已知:(ⅰ)

(ⅱ)
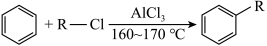
回答下列问题:
(1)A的化学名称为
(2)由C生成D的反应类型为
(3)设置D→E和F→G两步反应的作用是
(4)写出由G生成H的化学方程式
(5)写出Ⅰ的结构简式
(6)M为D的同系物,相对分子质量比D大14。M的同分异构体中同时满足下列条件的共有
①属于芳香族化合物;
②苯环上含有两个取代基,且位置相对;
③含有
 ;
;④能发生银镜反应。
满足上述条件的同分异构体中,核磁共振氢谱为3∶2∶2∶2∶1的同分异构体为
您最近一年使用:0次
2023-04-14更新
|
955次组卷
|
2卷引用:吉林省长春市2023届高三质量监测(三)理综化学试题
解题方法
6 . 某芳纶的拉伸强度比钢丝还高,耐热性能好,广泛用作防护材料。其结构片段如图,下列关于该芳纶的说法正确的是


| A.其单体是对氨基苯甲酸 |
| B.芳纶是一种蛋白质 |
| C.氢键对芳纶的性能有一定的影响 |
| D.若芳纶分子平均聚合度为927,则每个分子中平均含有酰胺基的数目为926 |
您最近一年使用:0次
7 . 铟(In)是一种主要用于液晶显示屏和半导体生产的重要稀有金属。从铅、锌的冶炼过程中产生的高铟烟灰(主要含ZnO、PbO、Fe2O3、In2O3、In2S3)中提取铟的流程如图:

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是____ 。
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是____ (用化学方程式表示)。
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有____ (填化学式)。
(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=____ (已知lg19=1.28忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为____ mol•L-1。

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为____ 。

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO
 ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2
 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为
您最近一年使用:0次
2022-10-29更新
|
614次组卷
|
3卷引用:吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题
名校
解题方法
8 . 纳米氧化锌可作为一些催化剂的载体,二氧化锰也常作催化剂、氧化剂与去极化剂,用途非常广泛。工业上由软锰矿(主要成分为MnO2)与锌精矿(主要成分为ZnS)酸性共溶法制备MnO2,及纳米ZnO,工艺流程如图:

已知:P5O7(酸性磷酸酯)可作萃取剂分离锌、锰离子,它是一种不溶于水的淡黄色透明油状液体,属于酸性萃取剂。
请回答下列问题:
(1)为了提高酸浸效果,可采取的措施有____ 。(答出一条即可)
(2)写出步骤①酸浸时ZnS与MnO2发生的主要反应的离子方程式:____ 。(无单质硫生成),若软锰矿的比例较低,可能产生的后果是____ 。
(3)实验室完成步骤③所用到的主要玻璃仪器是____ (填写名称)。
(4)完成步骤④中发生反应的离子方程式:____ 。
(5)经⑤所得水相再经过____ 过滤等操作得到ZnSO4•7H2O。
已知:①工业条件下,部分金属阳离子Mn+开始沉淀和完全沉淀时的pH值如图:
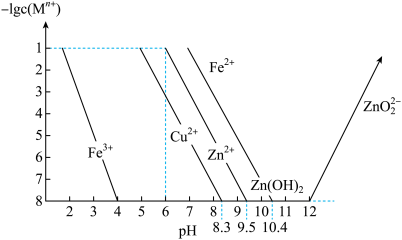
②相关常数:Ksp(ZnS)=2.1×10-22,Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15,Ka(CH3COOH)=1.8×10-5。
制得ZnSO4•7H2O后最终残留的酸性废液中含有ZnSO4,除去酸性废液中Zn2+的方法是:在酸性废液中加入一定量CH3COONa后,再通入H2S生成ZnS沉淀。处理后的溶液中部分微粒浓度为:
测:处理后的溶液中c(Zn2+)=____ mol•L-1。
(6)ZnSO4•7H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是____ 。

已知:P5O7(酸性磷酸酯)可作萃取剂分离锌、锰离子,它是一种不溶于水的淡黄色透明油状液体,属于酸性萃取剂。
请回答下列问题:
(1)为了提高酸浸效果,可采取的措施有
(2)写出步骤①酸浸时ZnS与MnO2发生的主要反应的离子方程式:
(3)实验室完成步骤③所用到的主要玻璃仪器是
(4)完成步骤④中发生反应的离子方程式:
(5)经⑤所得水相再经过
已知:①工业条件下,部分金属阳离子Mn+开始沉淀和完全沉淀时的pH值如图:

②相关常数:Ksp(ZnS)=2.1×10-22,Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15,Ka(CH3COOH)=1.8×10-5。
制得ZnSO4•7H2O后最终残留的酸性废液中含有ZnSO4,除去酸性废液中Zn2+的方法是:在酸性废液中加入一定量CH3COONa后,再通入H2S生成ZnS沉淀。处理后的溶液中部分微粒浓度为:
| 微粒 | H2S | CH3COOH | CH3COO- |
| 浓度(mol•L-1) | 0.10 | 0.10 | 0.18 |
(6)ZnSO4•7H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是
| A.滴定前,锥形瓶和滴定管均须用标准溶液润洗 |
| B.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移 |
| C.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转 |
| D.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小 |
您最近一年使用:0次
9 . 我国提出争取在2030年前实现碳峰值、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。将CO2 转化为清洁能源是促进碳中和最直接有效的方法。
(1)H2还原CO2制取CH4的部分反应如下:
①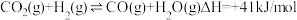
②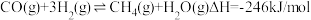
③
反应2C(s)+2H2O(g)=CH4(g)+CO2(g)的∆H=___________ kJ/mol。
(2)恒温条件下,向2L恒容密闭容器中充入1molCO和2molH2,只发生如下反应:CO(g)+3H2 (g)=CH4(g)+H2O(g),反应4min后,测得CO的物质的量为0.8mol,下列有关说法正确的是___________ (填字母。)
A. 利用合适的催化剂可增大该反应的平衡常数
B. 容器内气体的平均相对分子质量保持不变,说明该反应达到平衡状态
C. 用 H2表示该反应4min内的平均速率为0.075mol·L-1·s-1
D. 其它条件不变,升高温度,CO的平衡转化率降低
(3)在一定条件下,向某0.5L恒容密闭容器中充入xmolCO2和ymolH2,发生反应:
①图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线___________ (填“m” 或“n”),判断依据是___________ 。
②若x=2、y=3,测得在相同时间内,不同温度下H 2的转化率如图2所示,v(a) 逆___________ v(c) 逆(填“>”、<”或“=”);T2时,起始压强为2.5MPa,则Kp=___________ MPa-2(保留二位小数;K p为以分压表示的平衡常数,分压=总压×物质的量分数)。
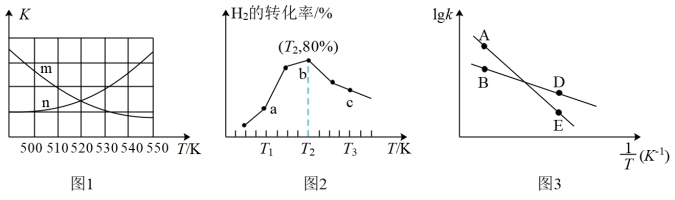
③已知速率方程 v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响。图3表示速率常数的对数lgk与温度的倒数 之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是
之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是___________ (填“A”、“B”、“D”或“E”)。
(1)H2还原CO2制取CH4的部分反应如下:
①
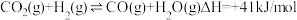
②
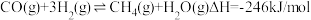
③

反应2C(s)+2H2O(g)=CH4(g)+CO2(g)的∆H=
(2)恒温条件下,向2L恒容密闭容器中充入1molCO和2molH2,只发生如下反应:CO(g)+3H2 (g)=CH4(g)+H2O(g),反应4min后,测得CO的物质的量为0.8mol,下列有关说法正确的是
A. 利用合适的催化剂可增大该反应的平衡常数
B. 容器内气体的平均相对分子质量保持不变,说明该反应达到平衡状态
C. 用 H2表示该反应4min内的平均速率为0.075mol·L-1·s-1
D. 其它条件不变,升高温度,CO的平衡转化率降低
(3)在一定条件下,向某0.5L恒容密闭容器中充入xmolCO2和ymolH2,发生反应:


①图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线
②若x=2、y=3,测得在相同时间内,不同温度下H 2的转化率如图2所示,v(a) 逆
③已知速率方程 v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响。图3表示速率常数的对数lgk与温度的倒数
 之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是
之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是
您最近一年使用:0次
2022-04-09更新
|
1123次组卷
|
6卷引用:吉林省长春市2022届高三质量监测线上考试(三)理综化学试题
吉林省长春市2022届高三质量监测线上考试(三)理综化学试题(已下线)【奋进985】05-备战2022年高考化学名校进阶模拟卷(通用版)湖北省襄阳市第五中学2022届高三适应性考试(一)化学试题湖南省浏阳市第一中学2022届高三下学期期中考试化学试题江西省重点校2022-2023学年高三上学期第三次联考化学试题.(已下线)化学反应速率和化学平衡
12-13高三下·江苏扬州·阶段练习
名校
解题方法
10 . 常温下,向 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是
 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是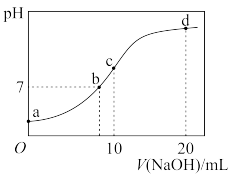
A.点 所示溶液中: 所示溶液中: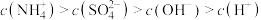 |
B.点 所示溶液中: 所示溶液中: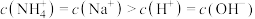 |
C.点 所示溶液中: 所示溶液中: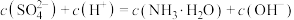 |
D.点 以后的溶液中可能出现: 以后的溶液中可能出现: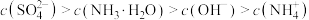 |
您最近一年使用:0次
2021-12-29更新
|
1227次组卷
|
23卷引用:吉林油田高级中学2021-2022学年高二上学期期中考试化学试题
吉林油田高级中学2021-2022学年高二上学期期中考试化学试题(已下线)2013届江苏省扬州市高三下学期5月考前适应性考试化学试卷2017届江苏省南通市高三高考全真模拟(四)化学 试卷2016-2017学年浙江省温州市“十五校联合体”高二下学期期中联考化学试卷河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题黑龙江省双鸭山市第一中学2017届高三全真模拟(第四次)考试理科综合化学试题浙江省2018版考前特训(2017年10月):选考仿真测试卷(四)江苏省前黄高级中学、如东高级中学、姜堰中学等五校2018届高三上学期第一次学情监测化学试题新疆2018届高三第一次适应性检测(一模)理科综合化学试题【区级联考】山东省临沂市罗庄区2018-2019学年高二上学期期末考试化学试题安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题河北省武邑中学2019-2020学年高二下学期3月线上考试化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题黑龙江省安达市第七中学2019-2020学年高二下学期第一次网络检测化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 章末综合检测卷上海交通大学附属中学2021届高三下学期3月月考化学试题天津市耀华中学2021届高三年级第二次模拟考试化学试题辽宁省朝阳市建平县实验中学2021-2022学年高二上学期期末考试化学试题江西省九江市第一中学2021-2022学年高二上学期期末化学试题江苏省秦淮中学、宇通实验学校等六校2022-2023学年高三上学期10月学情调研化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第3单元03巩固练黑龙江省海伦市第一中学2022-2023学年高二上学期11月期中考试化学试题