铟(In)是一种主要用于液晶显示屏和半导体生产的重要稀有金属。从铅、锌的冶炼过程中产生的高铟烟灰(主要含ZnO、PbO、Fe2O3、In2O3、In2S3)中提取铟的流程如图:

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是____ 。
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是____ (用化学方程式表示)。
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有____ (填化学式)。
(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=____ (已知lg19=1.28忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为____ mol•L-1。

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为____ 。

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO
 ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2
 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为
更新时间:2022-10-29 21:49:10
|
相似题推荐
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐1】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
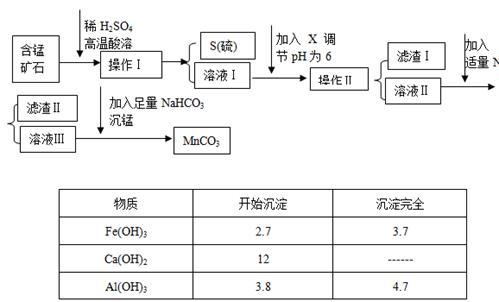
回答下列问题:
(1)操作Ⅰ为:___________ 。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为( )
(4)滤渣Ⅰ为___________ ,滤渣Ⅱ为___________ 。
(5)沉锰的化学方程式为:______________________ 。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________ 。

回答下列问题:
(1)操作Ⅰ为:
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为
| A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为
(5)沉锰的化学方程式为:
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:
您最近一年使用:0次
【推荐2】铼(Re)是熔点和沸点较高的金属单质之一,用于制造高效能喷射引擎和火箭引擎。钼酸锂(Li2MoO4)的外观为白色结晶粉末,用于电极材料、金属陶瓷的制作。从辉钼矿氧化焙烧后的烟道灰(主要成分有SiO2、Re2O7、MoO3、CuO、Fe3O4)中提取铼粉和制钼酸锂的流程如下图所示。
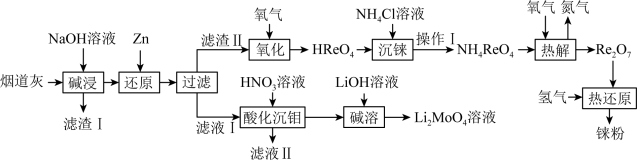
已知:
I.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应_______ (填写化学方程式)、MoO3+2NaOH=NaMoO4+H2O,则“滤渣I”的主要成分为_______ (填化学式)。
(2)“还原”时,Zn被氧化成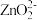 ,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为
,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___________ 。
(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括___________ 、___________ 、洗涤、干燥。
(4)“热解”时,发生反应的化学方程式为___________ 。
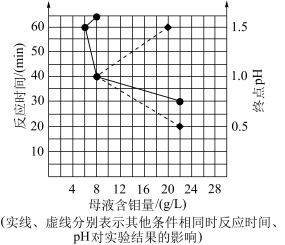
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据下图中数据判断最佳的“酸化沉钼”条件:反应时间为___________ min、pH为___________ 。
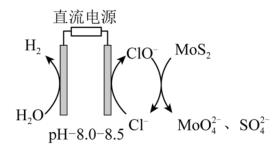
(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为______ g。

已知:
I.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应
(2)“还原”时,Zn被氧化成
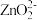 ,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为
,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括
(4)“热解”时,发生反应的化学方程式为
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据下图中数据判断最佳的“酸化沉钼”条件:反应时间为

(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为

您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐3】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
利用下图所示装置进行实验。

(1)装置①的作用是_________________ 装置③的作用是__________________ 。
(2)装置②中产生ClO2的化学方程式为____________________ 。装置④中产生NaClO2的化学方程式为________________________ 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③___________ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO + 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O =2I-+S4O
=2I-+S4O )。
)。
(4)滴定中使用的指示剂是____________ 。
(5)样品中NaClO2的质量分数为_______________ (用含m、c、V的代数式表示)。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
利用下图所示装置进行实验。

(1)装置①的作用是
(2)装置②中产生ClO2的化学方程式为
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO
 + 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O
 =2I-+S4O
=2I-+S4O )。
)。(4)滴定中使用的指示剂是
(5)样品中NaClO2的质量分数为
您最近一年使用:0次



