名校
解题方法
1 . 氧钒(Ⅳ)碱式碳酸铵晶体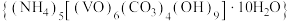 是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。
是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。
 溶液
溶液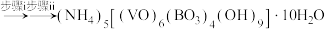
步骤i:用 排除装置中的氧气,将
排除装置中的氧气,将 溶液缓慢加入足量
溶液缓慢加入足量 溶液中,有气泡产生,析出紫红色晶体。
溶液中,有气泡产生,析出紫红色晶体。
步骤ii:待反应结束后,在 保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和
保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。
溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。
(1)仪器E的名称为________ ;上述装置连接的顺序为________ 。
(2)装置B中发生反应的化学方程式是________ 。
(3)①预测 保护气排除氧气的目的是
保护气排除氧气的目的是________ ;判断装置中的 基本上排尽的方法是
基本上排尽的方法是________ (填实验现象)。
②晶体用无水乙醇代替水洗涤的目的是________ 。
(4)称bg粗品,用 溶液氧化,再除去多余的
溶液氧化,再除去多余的 (方法略),滴入2滴
(方法略),滴入2滴 溶液,最后用
溶液,最后用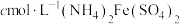 标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为
标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为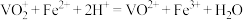 )。
)。
I.配制 标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为
标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为________ (填序号)。 溶液的体积为
溶液的体积为________ ;产品中钒的质量分数为________ %(用含b、c、M的代数式表示)。
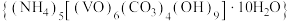 是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。
是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。 溶液
溶液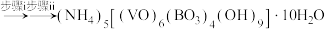
步骤i:用
 排除装置中的氧气,将
排除装置中的氧气,将 溶液缓慢加入足量
溶液缓慢加入足量 溶液中,有气泡产生,析出紫红色晶体。
溶液中,有气泡产生,析出紫红色晶体。步骤ii:待反应结束后,在
 保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和
保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。
溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。
(1)仪器E的名称为
(2)装置B中发生反应的化学方程式是
(3)①预测
 保护气排除氧气的目的是
保护气排除氧气的目的是 基本上排尽的方法是
基本上排尽的方法是②晶体用无水乙醇代替水洗涤的目的是
(4)称bg粗品,用
 溶液氧化,再除去多余的
溶液氧化,再除去多余的 (方法略),滴入2滴
(方法略),滴入2滴 溶液,最后用
溶液,最后用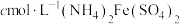 标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为
标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为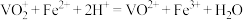 )。
)。I.配制
 标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为
标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为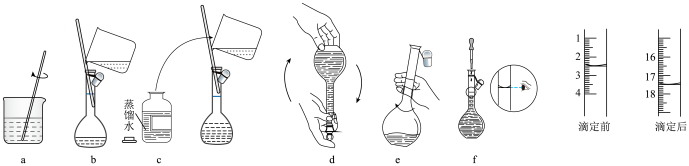
 溶液的体积为
溶液的体积为
您最近一年使用:0次
名校
2 . 配合物在许多尖端领域如激光材料、超导材料、抗癌药物的研究、催化剂的研制、自组装超分子等方面有广泛的应用。回答下列问题:
(1)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。 的核外电子的运动状态有
的核外电子的运动状态有________ 种,配合物X中 的配体有
的配体有________ ,茜素的水溶性较好的主要原因是________ 。
(2)Ni与CO形成的配合物 为无色液体,易溶于
为无色液体,易溶于 、
、 等有机溶剂。
等有机溶剂。 为
为________ (填“极性”或“非极性”)分子,分子中 键与
键与 键的个数之比为
键的个数之比为________ 。
(3)向 溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体
溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体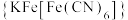 。实验表明,
。实验表明, 、
、 、
、 通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。
通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。________ 实验,可确定该晶体结构。
② 的配位数为
的配位数为________ 。
③若 位于Ⅱ型立方结构的棱心和体心,则
位于Ⅱ型立方结构的棱心和体心,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的________ ;一个Ⅱ型立方结构中含________ 个 ;若该蓝色晶体的密度为
;若该蓝色晶体的密度为 ,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为________ 。
(1)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的
 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。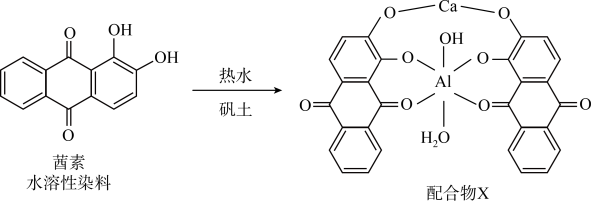
 的核外电子的运动状态有
的核外电子的运动状态有 的配体有
的配体有(2)Ni与CO形成的配合物
 为无色液体,易溶于
为无色液体,易溶于 、
、 等有机溶剂。
等有机溶剂。 为
为 键与
键与 键的个数之比为
键的个数之比为(3)向
 溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体
溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体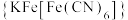 。实验表明,
。实验表明, 、
、 、
、 通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。
通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。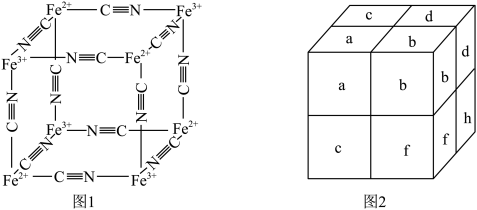
②
 的配位数为
的配位数为③若
 位于Ⅱ型立方结构的棱心和体心,则
位于Ⅱ型立方结构的棱心和体心,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的 ;若该蓝色晶体的密度为
;若该蓝色晶体的密度为 ,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
您最近一年使用:0次
名校
3 . 铁元素在地壳中含量丰富,应用广泛。回答下列问题:
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用 ,则与之相反的用
,则与之相反的用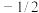 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为______ 。
(2) 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子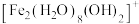 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角______ (填“大于”、“小于”或“等于”) 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是____________ 键(填“a”或“b”)。 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为______ , 的空间构型是
的空间构型是______ ;已知尿素分子所有原子在同一平面且含有与苯类似的“大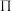 键”,其“大
键”,其“大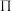 键”可表示为
键”可表示为______ (用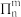 表示,其中
表示,其中 表示参与形成大
表示参与形成大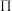 键的原子数,
键的原子数, 表示形成大
表示形成大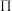 键的电子数);尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是
键的电子数);尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是______ 。
(4) 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为______ , 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为______  (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用
 ,则与之相反的用
,则与之相反的用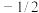 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为(2)
 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子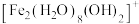 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是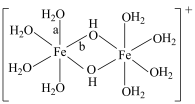
 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为 的空间构型是
的空间构型是 键”,其“大
键”,其“大 键”可表示为
键”可表示为 表示,其中
表示,其中 表示参与形成大
表示参与形成大 键的原子数,
键的原子数, 表示形成大
表示形成大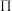 键的电子数);尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是
键的电子数);尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是(4)
 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为 (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。
您最近一年使用:0次
4 . 常温下,PdCO3和Pd(OH)2的沉淀溶解平衡曲线如图所示。下列说法正确的是
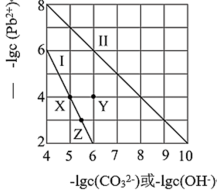
| A.向Z点对应溶液中加入适量的NaOH溶液,有可能得到X点对应溶液 |
| B.Y点对应的PdCO3分散系中,v(溶解)>v(沉淀),固体仍在溶解 |
C.PbCO3(s)+2OH-(aq) Pb(OH)2(s)+ Pb(OH)2(s)+ K=0.01 K=0.01 |
| D.由两者的Ksp可知,Pd(OH)2的溶解度更小 |
您最近一年使用:0次
5 . 缓冲溶液指的是由弱酸及其盐组成的混合溶液。缓冲溶液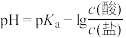 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸(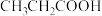 )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,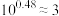 。
。
下列叙述正确的是
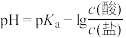 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸(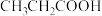 )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,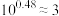 。
。下列叙述正确的是
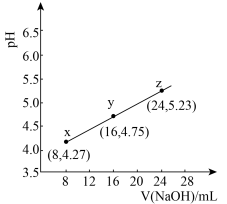
A.常温下,丙酸电离常数 的数量级为 的数量级为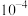 |
| B.在x、y、z点溶液中,缓冲能力最强的是z点 |
C.在z点溶液中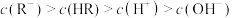 |
| D.若用同体积同浓度HNO2溶液替代HR溶液,则图中曲线竖直上移 |
您最近一年使用:0次
6 . 短周期元素A、B、C、D的原子序数依次增大,A元素原子的核外电子只有一种运动状态:基态B原子s能级的电子总数比p能级的多1;基态C原子中成对电子数是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题
(1)B原子的轨道表示式___________ 。
(2)A和C原子个数比为1∶1的化合物的电子式___________ 。
(3)元素A、B、C中,第一电离能最大的是___________ (填元素名称)。
(4)在B、C、D三种元素的简单离子中,其离子的半径最小的是___________ 。(填离子符号)
(5)C的简单氢化物的键角小于B的简单氢化物,其原因是___________ 。
(6)BC₃的空间结构为___________ 。
(7)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB晶体的密度为a g⋅cm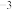 ,则晶体中两个最近D原子之间的距离为
,则晶体中两个最近D原子之间的距离为___________ pm(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
(1)B原子的轨道表示式
(2)A和C原子个数比为1∶1的化合物的电子式
(3)元素A、B、C中,第一电离能最大的是
(4)在B、C、D三种元素的简单离子中,其离子的半径最小的是
(5)C的简单氢化物的键角小于B的简单氢化物,其原因是
(6)BC₃的空间结构为
(7)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB晶体的密度为a g⋅cm
 ,则晶体中两个最近D原子之间的距离为
,则晶体中两个最近D原子之间的距离为 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。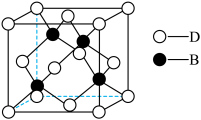
您最近一年使用:0次
解题方法
7 . 肼为二元弱碱,在水中的电离方式与氨相似。常温下,向一定浓度肼 水溶液中通入
水溶液中通入 (忽略溶液体积变化),测得
(忽略溶液体积变化),测得 与
与 [X为
[X为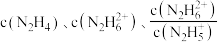 ]的变化关系如图所示。下列说法正确的是
]的变化关系如图所示。下列说法正确的是
 水溶液中通入
水溶液中通入 (忽略溶液体积变化),测得
(忽略溶液体积变化),测得 与
与 [X为
[X为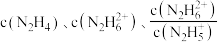 ]的变化关系如图所示。下列说法正确的是
]的变化关系如图所示。下列说法正确的是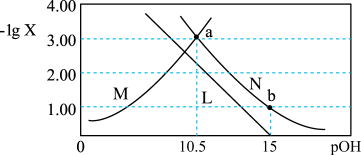
A.曲线N表示 与 与 的变化关系 的变化关系 |
B.常温下,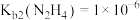 |
C.a点溶液中: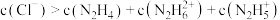 |
D.b点溶液中: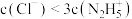 |
您最近一年使用:0次
2024-04-16更新
|
255次组卷
|
2卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
8 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是_____ ;基态Se原子的价电子运动状态有_____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: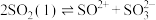 。
。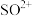 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为__ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和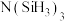 的结构如图所示,
的结构如图所示,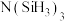 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为_______ ,二者中更易与 形成配位键的是
形成配位键的是_______ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是_______ 。
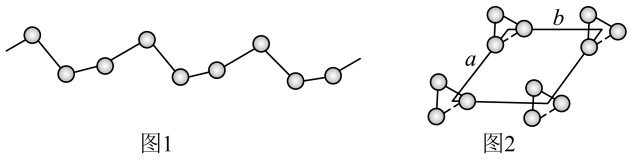
(5) -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、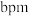 、
、 (其中
(其中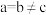 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。_______ 。晶胞中含有Se原子的数目为_______ ;则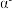 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为______  (列出算式)。
(列出算式)。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
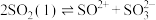 。
。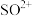 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和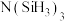 的结构如图所示,
的结构如图所示,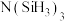 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是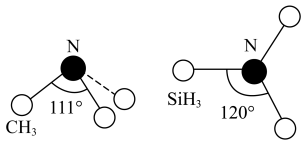
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)
 -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、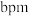 、
、 (其中
(其中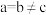 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。
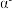 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为 (列出算式)。
(列出算式)。
您最近一年使用:0次
9 . 研究二氧化碳的转化与减排具有重要的社会意义。用 还原
还原 的反应过程如下:
的反应过程如下:
①
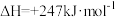
②

回答下列问题:
(1)

_______ 。
(2)同时提高 与
与 的平衡转化率和速率的措施是
的平衡转化率和速率的措施是_______ 。
(3)在密闭容器中分别充入0.1mol 与0.3mol
与0.3mol 。
。
①保持密闭容器体积为10L,只发生①②反应,经10min反应达到平衡,测定出 和
和 均为0.05mol。10min内
均为0.05mol。10min内 的平均反应速率为
的平均反应速率为____ ;该条件下,反应②的平衡常数为_____ 。
②在150℃时,改变密闭容器的体积,测得 和
和 平衡转化率随压强变化如图所示。
平衡转化率随压强变化如图所示。 平衡转化率随压强增大而减小的主要原因是
平衡转化率随压强增大而减小的主要原因是____ ; 后
后 平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是
平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是_______ 。 和
和 ,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下:
,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下: 体积分数很低,主要原因是活化能
体积分数很低,主要原因是活化能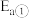
_______ 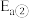 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②随温度升高, 的体积分数变化趋势为先增后减小,其可能原因是
的体积分数变化趋势为先增后减小,其可能原因是_______ 。
 还原
还原 的反应过程如下:
的反应过程如下:①

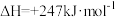
②


回答下列问题:
(1)


(2)同时提高
 与
与 的平衡转化率和速率的措施是
的平衡转化率和速率的措施是(3)在密闭容器中分别充入0.1mol
 与0.3mol
与0.3mol 。
。①保持密闭容器体积为10L,只发生①②反应,经10min反应达到平衡,测定出
 和
和 均为0.05mol。10min内
均为0.05mol。10min内 的平均反应速率为
的平均反应速率为②在150℃时,改变密闭容器的体积,测得
 和
和 平衡转化率随压强变化如图所示。
平衡转化率随压强变化如图所示。 平衡转化率随压强增大而减小的主要原因是
平衡转化率随压强增大而减小的主要原因是 后
后 平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是
平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是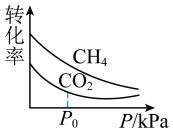
 和
和 ,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下:
,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下: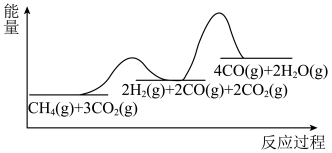
 体积分数很低,主要原因是活化能
体积分数很低,主要原因是活化能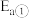
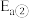 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②随温度升高,
 的体积分数变化趋势为先增后减小,其可能原因是
的体积分数变化趋势为先增后减小,其可能原因是
您最近一年使用:0次
10 . 实验室用废铁屑制取无水氯化铁并测其纯度。实验方案如下:
Ⅰ. 制备
制备
①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是_______ 。
(2)控制温度在40~50℃的原因是_______ 。
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为_______ 。
Ⅱ.无水 制备
制备
已知 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。
(4)按图装置进行实验。锥形瓶中生成无水 的总化学方程式为
的总化学方程式为_______ ;仪器A的作用是_______ 。
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用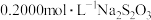 溶液滴定(
溶液滴定(
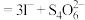 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。
①所制产品的纯度为_______ (以无水 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);
②所制产品中可能含有 杂质,检验
杂质,检验 的试剂为
的试剂为_______ (填化学式)溶液;产生 的原因可能是
的原因可能是_______ 。
Ⅰ.
 制备
制备①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是
(2)控制温度在40~50℃的原因是
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为
Ⅱ.无水
 制备
制备已知
 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。(4)按图装置进行实验。锥形瓶中生成无水
 的总化学方程式为
的总化学方程式为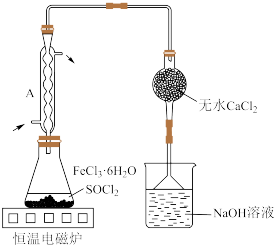
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用
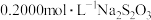 溶液滴定(
溶液滴定(
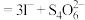 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。①所制产品的纯度为
 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);②所制产品中可能含有
 杂质,检验
杂质,检验 的试剂为
的试剂为 的原因可能是
的原因可能是
您最近一年使用:0次



