解题方法
1 . I.垃圾是放错地方的资源,工业废料也可以再利用,某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液,硝酸铜晶体和铁红(Fe2O3)。实验方案如下:
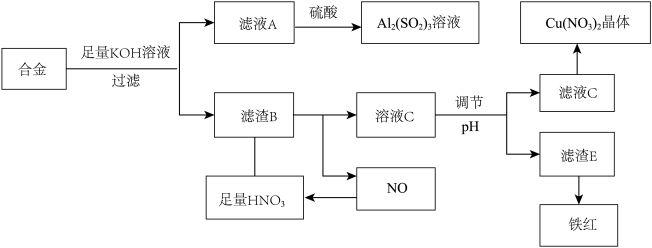
(1)已知Fe(OH)3沉淀的pH范围是3-4,溶液C通过调节pH可以使Fe3+沉淀完全,下列物质中可用作调整溶液C的pH的试剂是___________ (填序号)
A.铜粉 B.氨水 C.氢氧化铜 D.碱式碳酸铜
(2)常温下,若溶液C中金属离子均为1mol/L,Ksp[Fe(OH)3]=1.0×10-39,Ksp[Cu(OH)2]=2.2×10-20,控制pH=4,溶液中c(Fe3+)=___________ ,此时___________ (填“有” 或“无”)Cu(OH)2沉淀生成。
(3)将20mLAl2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,反应的离子方程式为___________ 。
Ⅱ.工业上以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定晶体中,MgSO4的含量,具体过程如下:
将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH值,静置后过滤,除去滤渣将滤液结晶得硫酸镁晶体。
(4)加入H2O2的目的是___________ (用离子方程式解释)
(5)常采用下列方法测定硫酸镁晶体中MgSO4的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2+)原形成配合物。
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来:Zn2++MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.5g加入过量的EDTA配成100mLpH 在9~10之间溶液A
步骤2:准确移取25.00mL:溶液A于锥形瓶中,用0.1000mol/LZn2+标准溶液滴定,滴定到终点时,消耗Zn2+标准溶液的体积为20.00mL
步骤3:另外准确移取25.00mL溶液A于另一只锥形瓶中调节pH在5~6,用0.1000mol/LZn2+标准溶液滴定,滴定至终点时,消耗Zn2+标准溶液的体积为30.00mL。
计算该晶体中MgSO4的质量分数为___________ 。

(1)已知Fe(OH)3沉淀的pH范围是3-4,溶液C通过调节pH可以使Fe3+沉淀完全,下列物质中可用作调整溶液C的pH的试剂是
A.铜粉 B.氨水 C.氢氧化铜 D.碱式碳酸铜
(2)常温下,若溶液C中金属离子均为1mol/L,Ksp[Fe(OH)3]=1.0×10-39,Ksp[Cu(OH)2]=2.2×10-20,控制pH=4,溶液中c(Fe3+)=
(3)将20mLAl2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,反应的离子方程式为
Ⅱ.工业上以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定晶体中,MgSO4的含量,具体过程如下:
将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH值,静置后过滤,除去滤渣将滤液结晶得硫酸镁晶体。
(4)加入H2O2的目的是
(5)常采用下列方法测定硫酸镁晶体中MgSO4的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2+)原形成配合物。
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来:Zn2++MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.5g加入过量的EDTA配成100mLpH 在9~10之间溶液A
步骤2:准确移取25.00mL:溶液A于锥形瓶中,用0.1000mol/LZn2+标准溶液滴定,滴定到终点时,消耗Zn2+标准溶液的体积为20.00mL
步骤3:另外准确移取25.00mL溶液A于另一只锥形瓶中调节pH在5~6,用0.1000mol/LZn2+标准溶液滴定,滴定至终点时,消耗Zn2+标准溶液的体积为30.00mL。
计算该晶体中MgSO4的质量分数为
您最近一年使用:0次



