解题方法
1 . 奥美拉唑可用于治疗十二指肠溃疡等疾病,其合成路线如图。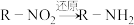
(1)A能与 溶液作用显紫色,A的名称是
溶液作用显紫色,A的名称是_____ 。
(2)A→B的化学方程式是_____ 。
(3)试剂a是_____ 。
(4)满足下列条件的E的同分异构有_____ 种。
i.苯环上有两个取代基 ⅱ.能与 溶液发生反应
溶液发生反应
(5)E→G的过程:_____ (写名称)。
②N与 反应的化学方程式是
反应的化学方程式是_____ 。
(6)合成 的路线如图。
的路线如图。 可由
可由 与
与_____ (填化学式)反应得到。
(1)A能与
 溶液作用显紫色,A的名称是
溶液作用显紫色,A的名称是(2)A→B的化学方程式是
(3)试剂a是
(4)满足下列条件的E的同分异构有
i.苯环上有两个取代基 ⅱ.能与
 溶液发生反应
溶液发生反应(5)E→G的过程:

②N与
 反应的化学方程式是
反应的化学方程式是(6)合成
 的路线如图。
的路线如图。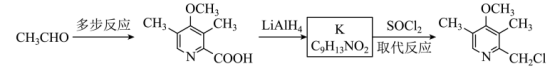
 可由
可由 与
与②已知 的结构简式为
的结构简式为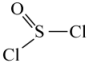 ,K转化为
,K转化为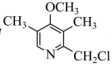 为取代反应,该反应的化学方程式是
为取代反应,该反应的化学方程式是
您最近一年使用:0次
2 . 室温下,向Mg(NO3)2溶液、HF溶液、CH3CH2COOH溶液中分别滴加NaOH溶液,测得溶液中pH与pX[pX=-lgX,X代表 、
、 、
、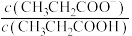 ]的关系如图所示。
]的关系如图所示。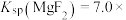
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是
已知:
 、
、 、
、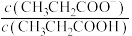 ]的关系如图所示。
]的关系如图所示。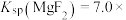
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是已知:

A. 代表的是pH与 代表的是pH与 的关系 的关系 |
B. 的 的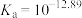 |
C.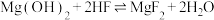 的 的 |
| D.含相同浓度NaF、HF的混合溶液的pH>7 |
您最近一年使用:0次
2024-04-01更新
|
452次组卷
|
5卷引用:内蒙古自治区赤峰第四中学2023-2024学年高三下学期开学考试理综试题-高中化学
3 . 由哈工大和香港中文大学联合研发的基于非牛顿流体的磁驱动“黏液机器人”,由聚乙烯醇、硼砂和钕磁铁等材料混合制成。因具有导电和强大的变形功能,未来有望用于医疗保健、精准货物运输及电子修复等领域。
(1)聚乙烯醇( )可溶于水,原因是
)可溶于水,原因是________ 。
(2)硼砂 阴离子是由两个
阴离子是由两个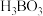 和两个
和两个 缩合而成的双六元环,结构如图所示。
缩合而成的双六元环,结构如图所示。

①硼砂的组成元素中,第一电离能由大到小顺序是________ ;硼砂晶体中存在的化学键类型有________ 。
A.离子键 B.共价键 C.氢键 D.配位键 E.金属键
②硼砂阴离子中,硼原子杂化轨道类型为________ 。
(3)钕磁铁又称为钕铁硼磁铁,因其超强的磁性被誉为“永磁之王”。基态钕原子价电子排布式为 ,钕位于元素周期表的
,钕位于元素周期表的________ 区;基态二价铁离子M层电子排布式为________ 。
(4)硼、铝同主族,晶体硼的熔点为2300℃,而金属铝的熔点为660.3℃,原因是________ 。
(5)钕(Nd)是最活泼的稀土金属之一,晶体结构属于六方晶系,晶胞结构如图所示(α=β=90°,γ=120°)。

①原子坐标参数A为 ,C为
,C为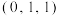 ,B为
,B为________ 。
②该晶胞中含有________ 个钕原子;该晶体的密度为 ,
, 为阿伏加德罗常数的值,则Nd的摩尔质量M=
为阿伏加德罗常数的值,则Nd的摩尔质量M=________  。(列出表达式,不必计算结果)
。(列出表达式,不必计算结果)
(1)聚乙烯醇(
 )可溶于水,原因是
)可溶于水,原因是(2)硼砂
 阴离子是由两个
阴离子是由两个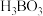 和两个
和两个 缩合而成的双六元环,结构如图所示。
缩合而成的双六元环,结构如图所示。
①硼砂的组成元素中,第一电离能由大到小顺序是
A.离子键 B.共价键 C.氢键 D.配位键 E.金属键
②硼砂阴离子中,硼原子杂化轨道类型为
(3)钕磁铁又称为钕铁硼磁铁,因其超强的磁性被誉为“永磁之王”。基态钕原子价电子排布式为
 ,钕位于元素周期表的
,钕位于元素周期表的(4)硼、铝同主族,晶体硼的熔点为2300℃,而金属铝的熔点为660.3℃,原因是
(5)钕(Nd)是最活泼的稀土金属之一,晶体结构属于六方晶系,晶胞结构如图所示(α=β=90°,γ=120°)。

①原子坐标参数A为
 ,C为
,C为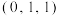 ,B为
,B为②该晶胞中含有
 ,
, 为阿伏加德罗常数的值,则Nd的摩尔质量M=
为阿伏加德罗常数的值,则Nd的摩尔质量M= 。(列出表达式,不必计算结果)
。(列出表达式,不必计算结果)
您最近一年使用:0次
解题方法
4 . 1,2-二氯乙烷( )是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:
)是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:

已知:①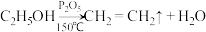
②

回答下列问题:
(1)仪器C的名称是________ ,装置甲中橡皮管的作用是________ 。
(2)装置甲中发生反应的离子方程式为________ 。
(3)制取1,2-二氯乙烷的装置接口顺序为(箭头为气流方向,部分装置可重复使用):________ 。
a→________→________→________→________→h-i←b←c←f←g←j
(4)装置丁中水的作用是________ 。
(5)相比酒精灯加热,己中采用甘油浴加热的优点是________ 。
(6)相比浓硫酸,用 脱水制乙烯的优点是
脱水制乙烯的优点是________ 。
(7)产品纯度的测定:量取5.5mL逐出 和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应:
和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应: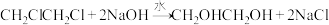 所得溶液先用稀硝酸中和至酸性,然后加入
所得溶液先用稀硝酸中和至酸性,然后加入 的
的 标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为
标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为________ 。
 )是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:
)是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:
已知:①
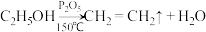
②


回答下列问题:
(1)仪器C的名称是
(2)装置甲中发生反应的离子方程式为
(3)制取1,2-二氯乙烷的装置接口顺序为(箭头为气流方向,部分装置可重复使用):
a→________→________→________→________→h-i←b←c←f←g←j
(4)装置丁中水的作用是
(5)相比酒精灯加热,己中采用甘油浴加热的优点是
(6)相比浓硫酸,用
 脱水制乙烯的优点是
脱水制乙烯的优点是(7)产品纯度的测定:量取5.5mL逐出
 和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应:
和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应: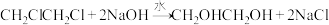 所得溶液先用稀硝酸中和至酸性,然后加入
所得溶液先用稀硝酸中和至酸性,然后加入 的
的 标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为
标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为
您最近一年使用:0次
5 . 重铬酸钠(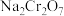 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有 、
、 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:

已知: ,
,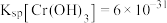
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是________ (填标号)
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式________ 。
(3)为提高铬的“浸出”率,可采取的措施为________ ;浸出液中溶质除 、
、 外,还含有
外,还含有________ (填化学式)。
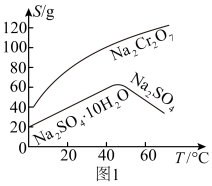
(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是 ,则“操作a”为
,则“操作a”为________ 、________ 、洗涤、干燥。
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
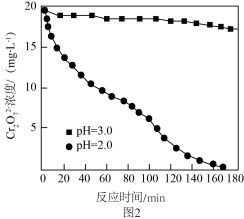
①初始pH为2.0,用铝粉还原 的离子方程式为
的离子方程式为________ 。
②初始pH为3.0,反应180min后,溶液中 浓度仍较高的可能原因是
浓度仍较高的可能原因是________ 。
③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中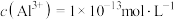 ,则残留的
,则残留的
________  。
。
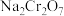 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有 、
、 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
已知:
 ,
,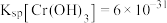
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将
 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式(3)为提高铬的“浸出”率,可采取的措施为
 、
、 外,还含有
外,还含有(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是
 ,则“操作a”为
,则“操作a”为
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有
 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
①初始pH为2.0,用铝粉还原
 的离子方程式为
的离子方程式为②初始pH为3.0,反应180min后,溶液中
 浓度仍较高的可能原因是
浓度仍较高的可能原因是③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中
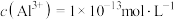 ,则残留的
,则残留的
 。
。
您最近一年使用:0次
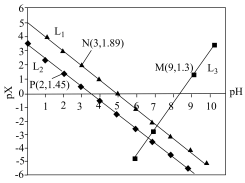
6 . 室温下,用HCl调节 Na3R溶液的 pH,混合溶液的 pH与离子浓度的关系如图所示。下列说法正确的是
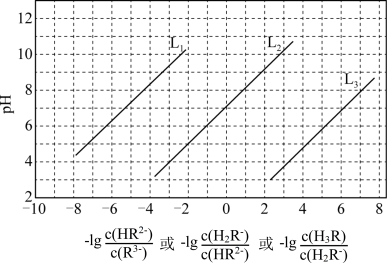

A.L1表示 pH与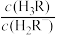 的关系曲线 的关系曲线 |
| B.NaH2R溶液呈酸性 |
| C.电离常数[Ka1(H3R)]的数量级为10-3 |
D.混合溶液的pH=7时,存在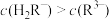 |
您最近一年使用:0次
7 . 胆矾CuSO4·5H2O可写[Cu(H2O)]SO4·H2O,其结构示意图如下:
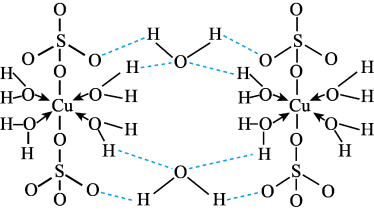
下列有关胆矾的说法正确的是

下列有关胆矾的说法正确的是
| A.Cu2+的价电子排布式为3d84s1 |
| B.所有氧原子都采取sp3杂化 |
| C.氧原子参与形成离子键、配位键、σ键和氢键四种化学键 |
| D.第二周期的元素中第一电离能比氧原子大的元素有三种 |
您最近一年使用:0次
名校
解题方法
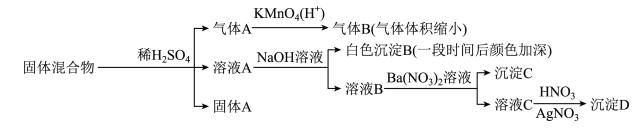
8 . 某固体混合物可能由 、
、 、FeS、
、FeS、 、
、 、
、 中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
 、
、 、FeS、
、FeS、 、
、 、
、 中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
A.气体A中一定含有 | B.固体A中一定含有S和 |
C.该固体混合物至少含 和FeS中的一种 和FeS中的一种 | D.该固体混合物中一定含有 、 、 、 、 |
您最近一年使用:0次
2023-09-27更新
|
672次组卷
|
5卷引用:内蒙古部分名校2023-2024学年高三上学期期中联合考试化学试题
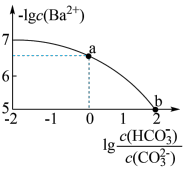
9 . 室温下,向Na2CO3和NaHCO3的混合溶液中逐滴加入BaCl2溶液,溶液中-1gc(Ba2+)与 的关系如图所示(已知:
的关系如图所示(已知: 、
、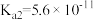 ;
; )。下列说法正确的是
)。下列说法正确的是
 的关系如图所示(已知:
的关系如图所示(已知: 、
、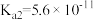 ;
; )。下列说法正确的是
)。下列说法正确的是
| A.a对应溶液pH=6.5 |
B.b对应溶液的c(HCO )=0.05mol/L )=0.05mol/L |
C.a→b的过程中,溶液中 一直增大 一直增大 |
D.a对应的溶液中一定存在: |
您最近一年使用:0次
2023-09-01更新
|
1153次组卷
|
3卷引用:内蒙古赤峰二中2023-2024学年高三上学期10月月考化学试题
内蒙古赤峰二中2023-2024学年高三上学期10月月考化学试题辽宁省鞍山市2023-2024学年高三上学期第一次质量监测化学试题(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
解题方法
10 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)Ag元素在元素周期表分区中属于_______ 区,基态Ag原子的价电子排布式为_______ 。
(2)硫代硫酸银(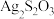 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。
①依据 理论推测
理论推测 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
②在 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ 。
(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
_______  (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是_______ 。
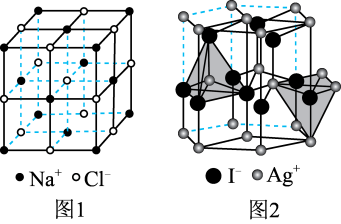
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
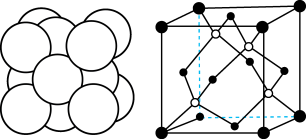
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______ ;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______ (储氢能力 )
)
(1)Ag元素在元素周期表分区中属于
(2)硫代硫酸银(
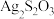 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。①依据
 理论推测
理论推测 的空间构型为
的空间构型为②在
 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有
 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为a.几何因素 b.电荷因素 c.键性因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为
 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )
)
您最近一年使用:0次
2022-04-25更新
|
1244次组卷
|
4卷引用:内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题
内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)【直抵名校】01-备战2022年高考化学名校进阶模拟卷(通用版)河南省南阳市2021-2022学年高二下学期期末考试化学试题



