1 . 铜是人类最早发现的金属之一,铜及其化合物在生活和生产中有着广泛的应用。根据信息回答下列问题:
(1)基态铜原子价层电子的轨道表达式为__________ 。
(2)农药波尔多液的有效杀菌成分是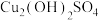 (碱式硫酸铜),
(碱式硫酸铜),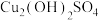 中非金属元素电负性由小到大的顺序是
中非金属元素电负性由小到大的顺序是__________ ,写出与 互为等电子体的一种分子的化学式
互为等电子体的一种分子的化学式__________ 。
(3)氨缩脲( )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为__________ , 键与
键与 键的数目之比为
键的数目之比为__________ 。氨缩脲与胆矾溶液反应得到如图所示的离子, 该离子中含配位键的数目为
该离子中含配位键的数目为__________ 。
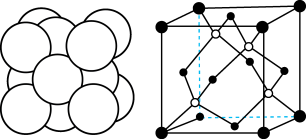
(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为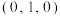 。原子B的坐标参数为
。原子B的坐标参数为__________ ;若该晶体密度为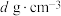 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为__________ pm。
(1)基态铜原子价层电子的轨道表达式为
(2)农药波尔多液的有效杀菌成分是
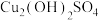 (碱式硫酸铜),
(碱式硫酸铜),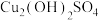 中非金属元素电负性由小到大的顺序是
中非金属元素电负性由小到大的顺序是 互为等电子体的一种分子的化学式
互为等电子体的一种分子的化学式(3)氨缩脲(
 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为 键与
键与 键的数目之比为
键的数目之比为 该离子中含配位键的数目为
该离子中含配位键的数目为
A. | B. |
C. | D. |
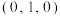 。原子B的坐标参数为
。原子B的坐标参数为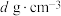 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为
您最近一年使用:0次
解题方法
2 . 奥美拉唑可用于治疗十二指肠溃疡等疾病,其合成路线如图。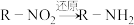
(1)A能与 溶液作用显紫色,A的名称是
溶液作用显紫色,A的名称是_____ 。
(2)A→B的化学方程式是_____ 。
(3)试剂a是_____ 。
(4)满足下列条件的E的同分异构有_____ 种。
i.苯环上有两个取代基 ⅱ.能与 溶液发生反应
溶液发生反应
(5)E→G的过程:_____ (写名称)。
②N与 反应的化学方程式是
反应的化学方程式是_____ 。
(6)合成 的路线如图。
的路线如图。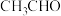 可由
可由 与
与_____ (填化学式)反应得到。
(1)A能与
 溶液作用显紫色,A的名称是
溶液作用显紫色,A的名称是(2)A→B的化学方程式是
(3)试剂a是
(4)满足下列条件的E的同分异构有
i.苯环上有两个取代基 ⅱ.能与
 溶液发生反应
溶液发生反应(5)E→G的过程:

②N与
 反应的化学方程式是
反应的化学方程式是(6)合成
 的路线如图。
的路线如图。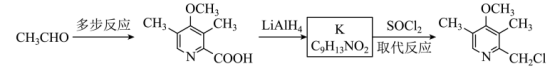
 可由
可由 与
与②已知 的结构简式为
的结构简式为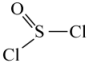 ,K转化为
,K转化为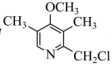 为取代反应,该反应的化学方程式是
为取代反应,该反应的化学方程式是
您最近一年使用:0次
3 . 由哈工大和香港中文大学联合研发的基于非牛顿流体的磁驱动“黏液机器人”,由聚乙烯醇、硼砂和钕磁铁等材料混合制成。因具有导电和强大的变形功能,未来有望用于医疗保健、精准货物运输及电子修复等领域。
(1)聚乙烯醇( )可溶于水,原因是
)可溶于水,原因是________ 。
(2)硼砂 阴离子是由两个
阴离子是由两个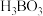 和两个
和两个 缩合而成的双六元环,结构如图所示。
缩合而成的双六元环,结构如图所示。

①硼砂的组成元素中,第一电离能由大到小顺序是________ ;硼砂晶体中存在的化学键类型有________ 。
A.离子键 B.共价键 C.氢键 D.配位键 E.金属键
②硼砂阴离子中,硼原子杂化轨道类型为________ 。
(3)钕磁铁又称为钕铁硼磁铁,因其超强的磁性被誉为“永磁之王”。基态钕原子价电子排布式为 ,钕位于元素周期表的
,钕位于元素周期表的________ 区;基态二价铁离子M层电子排布式为________ 。
(4)硼、铝同主族,晶体硼的熔点为2300℃,而金属铝的熔点为660.3℃,原因是________ 。
(5)钕(Nd)是最活泼的稀土金属之一,晶体结构属于六方晶系,晶胞结构如图所示(α=β=90°,γ=120°)。

①原子坐标参数A为 ,C为
,C为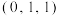 ,B为
,B为________ 。
②该晶胞中含有________ 个钕原子;该晶体的密度为 ,
, 为阿伏加德罗常数的值,则Nd的摩尔质量M=
为阿伏加德罗常数的值,则Nd的摩尔质量M=________  。(列出表达式,不必计算结果)
。(列出表达式,不必计算结果)
(1)聚乙烯醇(
 )可溶于水,原因是
)可溶于水,原因是(2)硼砂
 阴离子是由两个
阴离子是由两个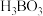 和两个
和两个 缩合而成的双六元环,结构如图所示。
缩合而成的双六元环,结构如图所示。
①硼砂的组成元素中,第一电离能由大到小顺序是
A.离子键 B.共价键 C.氢键 D.配位键 E.金属键
②硼砂阴离子中,硼原子杂化轨道类型为
(3)钕磁铁又称为钕铁硼磁铁,因其超强的磁性被誉为“永磁之王”。基态钕原子价电子排布式为
 ,钕位于元素周期表的
,钕位于元素周期表的(4)硼、铝同主族,晶体硼的熔点为2300℃,而金属铝的熔点为660.3℃,原因是
(5)钕(Nd)是最活泼的稀土金属之一,晶体结构属于六方晶系,晶胞结构如图所示(α=β=90°,γ=120°)。

①原子坐标参数A为
 ,C为
,C为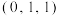 ,B为
,B为②该晶胞中含有
 ,
, 为阿伏加德罗常数的值,则Nd的摩尔质量M=
为阿伏加德罗常数的值,则Nd的摩尔质量M= 。(列出表达式,不必计算结果)
。(列出表达式,不必计算结果)
您最近一年使用:0次
解题方法
4 . 1,2-二氯乙烷( )是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:
)是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:

已知:①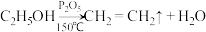
②

回答下列问题:
(1)仪器C的名称是________ ,装置甲中橡皮管的作用是________ 。
(2)装置甲中发生反应的离子方程式为________ 。
(3)制取1,2-二氯乙烷的装置接口顺序为(箭头为气流方向,部分装置可重复使用):________ 。
a→________→________→________→________→h-i←b←c←f←g←j
(4)装置丁中水的作用是________ 。
(5)相比酒精灯加热,己中采用甘油浴加热的优点是________ 。
(6)相比浓硫酸,用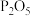 脱水制乙烯的优点是
脱水制乙烯的优点是________ 。
(7)产品纯度的测定:量取5.5mL逐出 和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应:
和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应: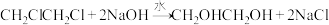 所得溶液先用稀硝酸中和至酸性,然后加入
所得溶液先用稀硝酸中和至酸性,然后加入 的
的 标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为
标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为________ 。
 )是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:
)是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:
已知:①
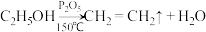
②


回答下列问题:
(1)仪器C的名称是
(2)装置甲中发生反应的离子方程式为
(3)制取1,2-二氯乙烷的装置接口顺序为(箭头为气流方向,部分装置可重复使用):
a→________→________→________→________→h-i←b←c←f←g←j
(4)装置丁中水的作用是
(5)相比酒精灯加热,己中采用甘油浴加热的优点是
(6)相比浓硫酸,用
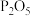 脱水制乙烯的优点是
脱水制乙烯的优点是(7)产品纯度的测定:量取5.5mL逐出
 和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应:
和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应: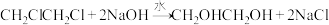 所得溶液先用稀硝酸中和至酸性,然后加入
所得溶液先用稀硝酸中和至酸性,然后加入 的
的 标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为
标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为
您最近一年使用:0次
5 . 重铬酸钠(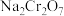 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有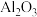 、
、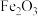 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:

已知: ,
,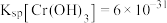
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是________ (填标号)
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式________ 。
(3)为提高铬的“浸出”率,可采取的措施为________ ;浸出液中溶质除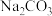 、
、 外,还含有
外,还含有________ (填化学式)。
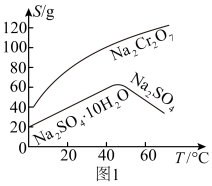
(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是 ,则“操作a”为
,则“操作a”为________ 、________ 、洗涤、干燥。
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
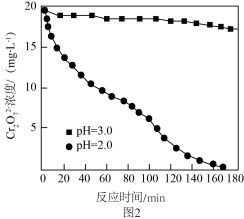
①初始pH为2.0,用铝粉还原 的离子方程式为
的离子方程式为________ 。
②初始pH为3.0,反应180min后,溶液中 浓度仍较高的可能原因是
浓度仍较高的可能原因是________ 。
③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中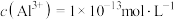 ,则残留的
,则残留的
________  。
。
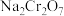 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有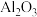 、
、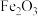 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
已知:
 ,
,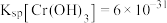
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将
 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式(3)为提高铬的“浸出”率,可采取的措施为
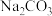 、
、 外,还含有
外,还含有(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是
 ,则“操作a”为
,则“操作a”为
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有
 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
①初始pH为2.0,用铝粉还原
 的离子方程式为
的离子方程式为②初始pH为3.0,反应180min后,溶液中
 浓度仍较高的可能原因是
浓度仍较高的可能原因是③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中
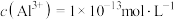 ,则残留的
,则残留的
 。
。
您最近一年使用:0次
解题方法
6 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)Ag元素在元素周期表分区中属于_______ 区,基态Ag原子的价电子排布式为_______ 。
(2)硫代硫酸银(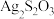 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成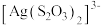 等络阴离子。
等络阴离子。
①依据 理论推测
理论推测 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
②在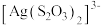 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ 。
(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有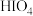 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和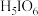 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性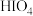
_______ 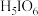 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是_______ 。
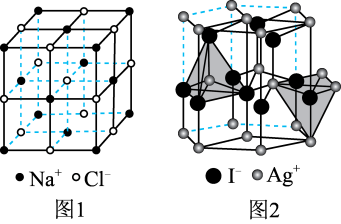
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为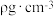 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______ ;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______ (储氢能力 )
)
(1)Ag元素在元素周期表分区中属于
(2)硫代硫酸银(
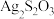 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成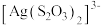 等络阴离子。
等络阴离子。①依据
 理论推测
理论推测 的空间构型为
的空间构型为②在
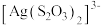 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有
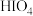 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和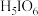 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性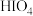
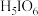 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为a.几何因素 b.电荷因素 c.键性因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为
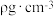 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )
)
您最近一年使用:0次
2022-04-25更新
|
1266次组卷
|
4卷引用:内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题
内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)【直抵名校】01-备战2022年高考化学名校进阶模拟卷(通用版)河南省南阳市2021-2022学年高二下学期期末考试化学试题
7 . MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):不正确 的是

| A.ΔH1(MgCO3)>ΔH1(CaCO3)>0 |
| B.ΔH2(MgCO3)=ΔH2(CaCO3)>0 |
| C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) |
| D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3 |
您最近一年使用:0次
2019-04-12更新
|
7414次组卷
|
49卷引用:内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题
内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题2019年4月浙江省普通高校招生选考科目考试化学试题天津市第一中学2018-2019学年高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2020届高三11月月考化学试题(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高二上学期期中化学试题浙江省宁波市余姚中学2019-2020学年高二上学期期中考试化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用河南省洛阳市2019-2020学年高三上学期尖子生第一次考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第二节 反应热的计算 高考帮安徽省池州市第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过高考 3年真题强化闯关人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过高考 3年真题强化闯关(已下线)【浙江新东方】97(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练选择性必修1(SJ)专题1专题培优专练(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)选择性必修1 专题1 素养检测(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题(已下线)专题10.化学反应中的能量变化-十年(2012-2021)高考化学真题分项汇编(浙江专用)四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题湖北省石首市2021-2022学年高二上学期期中考试化学试题(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题7 盖斯定律专练(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)河南省信阳市2021-2022学年高二上学期期中考试化学试题第一章 综合拔高练(已下线)高中化学-高二上-9(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题黑龙江省大庆市肇州县第二中学2022-2023学年高三上学期第二次月考化学试题湖南省长沙市第一中学2022-2023学年高三上学期月考卷(五)化学试题湖南省攸县第二中学2022-2023学年高三第六次月考化学试题(已下线)第六章 化学反应与能量 第34讲 反应热的计算黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题天津市区重点中学2023届高三毕业班联考(一)化学试题广东省揭阳市惠来县第一中学2022-2023学年高二下学期第一次月考化学试题山西省孝义市2022-2023学年高二4月月考化学试卷(已下线)专题08 化学反应中的能量变化(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)黑龙江省哈尔滨第三中学2023-2024学年高二上学期第二次验收考试化学试题
8 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是________ 。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____ (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______ (填离子符号),由此可以证明该氧化还原反应为______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________ ;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______ ;生成沉淀的原因是______ (用平衡移动原理解释)。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
5626次组卷
|
40卷引用:内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题
内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省双流中学高三上学期10月月考化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届海南省海南中学高三上学期月考三化学试卷2016-2017学年广东省清远三中高二上第二次月考化学卷2017届四川省泸州市泸化中学高三上10月月考化学卷2016-2017学年北京五十六中九高三上学期期中考试化学试卷天津市南开区2017届高三高考二模化学试卷黑龙江省大庆实验中学2018届高三上学期第一次月考理科综合化学试题内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题甘肃省会宁县第一中学2018届高三上学期第三次月考理科综合化学试题青海省西宁二十一中2018届高三上学期12月月考化学试卷黑龙江省哈尔滨市第九中学2017-2018学年高一上学期期末考试化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【校级联考】福建省龙岩市非一级达标校2018-2019学年高二上学期期末教学质量检查化学试题2016年全国普通高等学校招生统一考试化学(全国2卷参考版)吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测广东省韶关市2019-2020学年高二下学期期末考试化学试题(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测黑龙江省牡丹江市第一高级中学2021届高三上学期开学考试化学试题(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)四川省邻水实验学校2022届高三上学期入学考试理综化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)第三章 金属及其化合物 第13讲 铁及其重要化合物(已下线)题型31 Fe2+、Fe3+的检验与性质探究(已下线)第一部分 化学综合实验 热点6 物质性质探究实验
11-12高三上·辽宁铁岭·阶段练习
名校
9 . 将m g含氧化铁、氧化铜和氧化亚铁的样品投入物质的量浓度为1 mol/L的2 L盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是
| A.16g | B.(m+16)g | C.(m-32)g | D.(m-16)g |
您最近一年使用:0次
2018-01-16更新
|
1515次组卷
|
19卷引用:内蒙古包头市一机一中2021-2022学年高一上学期10月月考化学试题
内蒙古包头市一机一中2021-2022学年高一上学期10月月考化学试题(已下线)2012届辽宁省铁岭中学高三上学期第三次月考化学试卷2015-2016河北石家庄第一中学高一上期中考试化学试卷2015-2016学年天津静海一中高一上12月学业调研化学卷2017届河北省定州中学高三上第一次月考化学试卷2016-2017学年湖南省娄底市双峰一中等五校高一上期中化学卷2016-2017学年宁夏育才中学高一上月考二化学卷22016-2017学年河北省张家口第一中学高一下学期开学检测(衔接班)化学试卷2018届高三一轮复习化学:考点21-铜及其化合物性质探究湖南省衡阳市第八中学2017-2018学年高一上学期期中考试化学试题黑龙江省大庆市东风中学2017-2018学年高一上学期期中考试化学试题山东省曲阜市2018届高三上学期期中考试化学试题黑龙江省双鸭山市第一中学2017-2018学年高一上学期期末考试化学试题【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高一上学期期中考试化学试题2020届高三化学无机化学二轮专题复习——铜的氧化物的性质【选择精编26题】人教版(2019)高一必修第一册第三章 铁 金属材料 高考挑战区(苏教版2019)必修第二册专题9 金属与人类文明 C 高考挑战区江西省吉安市遂川中学2021-2022学年高一上学期第一次月考化学(A卷)试题云南省澄江市第一中学2021-2022学年高一下学期3月份考试化学试题
名校
10 . 阿伏加德罗常数的值为NA,下列叙述中错误的是
①标准状况下,2.24 L水中含有0.1 NA个水分子
②常温常压下,32g SO2 含有的分子数约为3.01×1023
③2 mol NaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤标况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2 L氯气中含有 NA个氯原子
①标准状况下,2.24 L水中含有0.1 NA个水分子
②常温常压下,32g SO2 含有的分子数约为3.01×1023
③2 mol NaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤标况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2 L氯气中含有 NA个氯原子
| A.①③④⑥⑧ | B.①④⑤⑥⑧ | C.①②④⑥⑧ | D.②③④⑤⑦ |
您最近一年使用:0次
2017-02-17更新
|
2985次组卷
|
16卷引用:内蒙古包头稀土高新区二中2019-2020学年高一10月月考化学试题
内蒙古包头稀土高新区二中2019-2020学年高一10月月考化学试题2016-2017学年黑龙江大庆铁人中学高一上期中化学卷陕西省西安市长安区第一中学2017-2018学年高一(实验班)上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高一上学期期中考试化学试题(A)河北省高阳中学2017-2018学年高一1月月考化学试题湖北省黄冈市浠水实验高中2019-2020学年高一10月月考化学试题青海省海东市第二中学2019-2020学年高一上学期期中考试化学试题福建省龙海市程溪中学2019-2020学年高一上学期期中考试化学试题福建省泉州市永春第一中学2020届高三上学期期初考试化学试题湖北省黄冈市浠水县实验高级中学2019-2020学年高一上学期9月月考化学试题福建省泰宁第一中学2018-2019学年高一上学期第二阶段考试化学试题(已下线)【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二6月阶段性测试化学试题(已下线)【南昌新东方】5.莲塘一中 曹永康 程秀丽广东省中山市第一中学丰山学部2019-2020学年高一上学期第三次段化学试题福建省福州市八县(市、区)协作校 2021-2022学年高一上学期11月份期中联考化学试题黑龙江省佳木斯市第一中学2021-2022学年高一上学期12月月考化学试题



