名校
1 . 已知常温下水溶液中 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如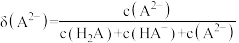 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中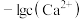 和
和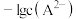 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
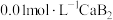 溶液,下列说法错误的是
溶液,下列说法错误的是
 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如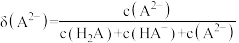 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中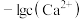 和
和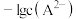 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
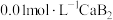 溶液,下列说法错误的是
溶液,下列说法错误的是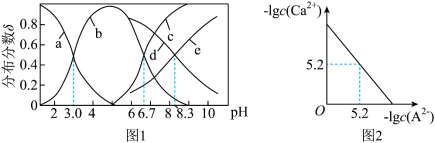
A.曲线b表示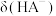 |
B. 溶液中存在: 溶液中存在: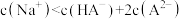 |
C.反应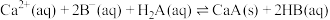 的平衡常数 的平衡常数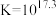 |
D.滴定过程中始终存在: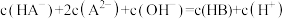 |
您最近一年使用:0次
7日内更新
|
119次组卷
|
2卷引用:2024届河南省信阳市高三下学期高考考前押题理科综合试卷-高中化学
2 . 甲醇水蒸气重整制氢转换条件温和、副产物少,成为了诸多富氢燃料的首选之一。甲醇水蒸气重整制氢过程中的化学反应如下:
ⅰ.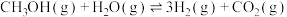

ⅱ.

ⅲ.
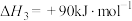
(1)
______  ,若反应ⅰ正反应的活化能
,若反应ⅰ正反应的活化能 ,则逆反应的活化能
,则逆反应的活化能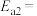
______  。
。
(2)下图为含碳产物的选择性(CO的选择性是指反应生成CO的甲醇占转化的甲醇的百分比)及产氢率随水醇物质的量之比( )的变化图像,曲线
)的变化图像,曲线______ 是 选择性曲线。由图可知,下列最优水醇物质的量之比是
选择性曲线。由图可知,下列最优水醇物质的量之比是______ 。
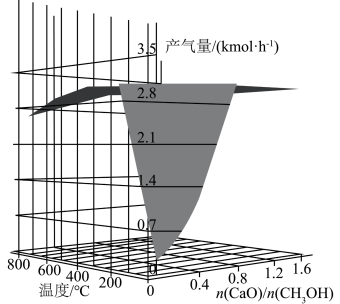
(3)若甲醇水蒸气重整反应是在吸附剂CaO存在的情况下进行的,产氢量随温度和 之比的影响如下图所示。已知吸附剂CaO的碳酸化反应为:
之比的影响如下图所示。已知吸附剂CaO的碳酸化反应为:
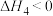 。
。 一定时,温度小于230℃,随温度升高产氢量增加;温度大于300℃时,产氢量随温度升高而降低,降低的原因
一定时,温度小于230℃,随温度升高产氢量增加;温度大于300℃时,产氢量随温度升高而降低,降低的原因______ 。
②在温度为T℃的恒容密闭的石英管中,加入碳酸钙,加热至反应完全后(碳酸钙始终有剩余),测得二氧化碳压强为a kPa。在相同温度下的恒容密闭石英管中按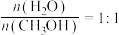 通入水蒸气和甲醇,并加入适量CaO,测得压强为
通入水蒸气和甲醇,并加入适量CaO,测得压强为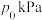 ,待反应达平衡后,测得二氧化碳的选择性为80%,氢气的分压为b kPa,若氧化钙对二氧化碳的吸收率为50%,则
,待反应达平衡后,测得二氧化碳的选择性为80%,氢气的分压为b kPa,若氧化钙对二氧化碳的吸收率为50%,则 的平衡分压为
的平衡分压为______ kPa,反应ⅲ的
______ 。若继续加入甲醇,则
______ (填“增大”、“减小”或“不变”)。
ⅰ.
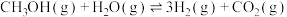

ⅱ.


ⅲ.

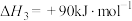
(1)

 ,若反应ⅰ正反应的活化能
,若反应ⅰ正反应的活化能 ,则逆反应的活化能
,则逆反应的活化能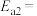
 。
。(2)下图为含碳产物的选择性(CO的选择性是指反应生成CO的甲醇占转化的甲醇的百分比)及产氢率随水醇物质的量之比(
 )的变化图像,曲线
)的变化图像,曲线 选择性曲线。由图可知,下列最优水醇物质的量之比是
选择性曲线。由图可知,下列最优水醇物质的量之比是
(3)若甲醇水蒸气重整反应是在吸附剂CaO存在的情况下进行的,产氢量随温度和
 之比的影响如下图所示。已知吸附剂CaO的碳酸化反应为:
之比的影响如下图所示。已知吸附剂CaO的碳酸化反应为:
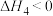 。
。
 一定时,温度小于230℃,随温度升高产氢量增加;温度大于300℃时,产氢量随温度升高而降低,降低的原因
一定时,温度小于230℃,随温度升高产氢量增加;温度大于300℃时,产氢量随温度升高而降低,降低的原因②在温度为T℃的恒容密闭的石英管中,加入碳酸钙,加热至反应完全后(碳酸钙始终有剩余),测得二氧化碳压强为a kPa。在相同温度下的恒容密闭石英管中按
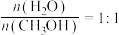 通入水蒸气和甲醇,并加入适量CaO,测得压强为
通入水蒸气和甲醇,并加入适量CaO,测得压强为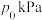 ,待反应达平衡后,测得二氧化碳的选择性为80%,氢气的分压为b kPa,若氧化钙对二氧化碳的吸收率为50%,则
,待反应达平衡后,测得二氧化碳的选择性为80%,氢气的分压为b kPa,若氧化钙对二氧化碳的吸收率为50%,则 的平衡分压为
的平衡分压为

您最近一年使用:0次
2024-06-11更新
|
177次组卷
|
4卷引用:2024届河南省漯河市高级中学高三下学期三模理综试题-高中化学
名校
3 . 常温下,用NaOH溶液分别滴定等物质的量浓度的HX(弱酸)、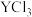 (可溶性盐)和
(可溶性盐)和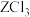 (可溶性盐)三种溶液。
(可溶性盐)三种溶液。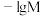 [M表示
[M表示 、
、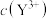 、
、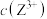 ]随溶液pH的变化如图所示。已知:
]随溶液pH的变化如图所示。已知: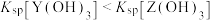 。下列说法错误的是
。下列说法错误的是
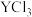 (可溶性盐)和
(可溶性盐)和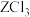 (可溶性盐)三种溶液。
(可溶性盐)三种溶液。 [M表示
[M表示 、
、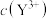 、
、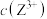 ]随溶液pH的变化如图所示。已知:
]随溶液pH的变化如图所示。已知: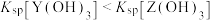 。下列说法错误的是
。下列说法错误的是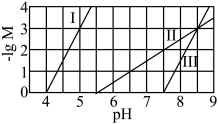
A.曲线I代表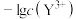 随溶液pH的变化关系 随溶液pH的变化关系 |
B. 的数量级是 的数量级是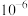 |
C. 固体能完全溶解在 固体能完全溶解在 溶液中 溶液中 |
D.滴定HX溶液至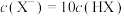 时,溶液中: 时,溶液中: |
您最近一年使用:0次
2024-06-11更新
|
127次组卷
|
2卷引用:2024届河南省漯河市高级中学高三下学期三模理综试题-高中化学
4 . 利用 可消除废水中
可消除废水中 、
、 造成的污染。若保持通入到废水中的
造成的污染。若保持通入到废水中的 不变,通过调节废水的
不变,通过调节废水的 使
使 、
、 形成硫化物沉淀而分离开,此过程中各离子浓度的对数
形成硫化物沉淀而分离开,此过程中各离子浓度的对数 (
( 为
为 、
、 、
、 、
、 )与废水的
)与废水的 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
 可消除废水中
可消除废水中 、
、 造成的污染。若保持通入到废水中的
造成的污染。若保持通入到废水中的 不变,通过调节废水的
不变,通过调节废水的 使
使 、
、 形成硫化物沉淀而分离开,此过程中各离子浓度的对数
形成硫化物沉淀而分离开,此过程中各离子浓度的对数 (
( 为
为 、
、 、
、 、
、 )与废水的
)与废水的 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是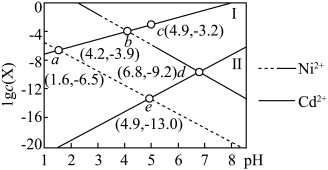
A.相同温度下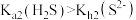 |
B.可用 溶液除去 溶液除去 中的杂质 中的杂质 |
C.随着 增大,氢硫酸中 增大,氢硫酸中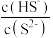 增大 增大 |
D.相同温度下,纯 饱和溶液中的 饱和溶液中的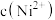 可能与 可能与 点废水中的 点废水中的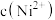 相等 相等 |
您最近一年使用:0次
5 .  NaOH溶液滴定20.00mL
NaOH溶液滴定20.00mL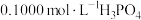 溶液时,
溶液时,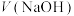 、各含磷元素微粒的
、各含磷元素微粒的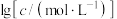 和pH的关系如图。下列说法错误的是
和pH的关系如图。下列说法错误的是
 NaOH溶液滴定20.00mL
NaOH溶液滴定20.00mL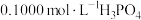 溶液时,
溶液时,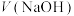 、各含磷元素微粒的
、各含磷元素微粒的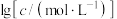 和pH的关系如图。下列说法错误的是
和pH的关系如图。下列说法错误的是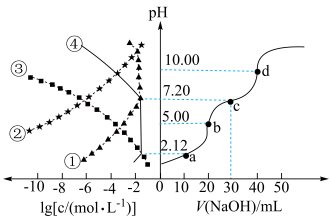
A. 的 的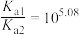 |
| B.水的电离程度:d>c>b>a |
C.③为 的 的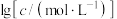 与pH的关系 与pH的关系 |
D.c点时,溶液中存在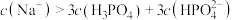 |
您最近一年使用:0次
2024-06-08更新
|
175次组卷
|
4卷引用:河南省新乡市2024届高三第三次模拟考试理综-化学试题
6 . 常温下,向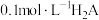 溶液中,逐渐加入
溶液中,逐渐加入 固体,体系中部分微粒含量随溶液
固体,体系中部分微粒含量随溶液 的变化如图所示,已知
的变化如图所示,已知 。下列叙述正确的是
。下列叙述正确的是
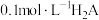 溶液中,逐渐加入
溶液中,逐渐加入 固体,体系中部分微粒含量随溶液
固体,体系中部分微粒含量随溶液 的变化如图所示,已知
的变化如图所示,已知 。下列叙述正确的是
。下列叙述正确的是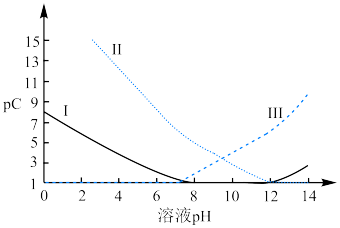
A.曲线Ⅰ代表 ,曲线Ⅱ代表 ,曲线Ⅱ代表 ,曲线Ⅲ代表 ,曲线Ⅲ代表 |
B. 的电离常数 的电离常数 约为 约为 , , 约为 约为 |
C. 溶液中存在 溶液中存在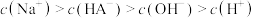 |
D.若反应中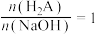 ,则存在 ,则存在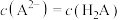 |
您最近一年使用:0次
7 . 乙醛 是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:
是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:
(1)已知:①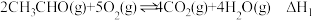
②
③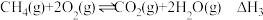
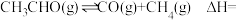
_______ 。
(2)在镍催化下,乙醛与氢气反应生成乙醇。在恒温恒容反应器中充入一定量 和
和 发生反应:
发生反应: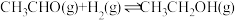 。下列叙述错误的是_______(填标号)。
。下列叙述错误的是_______(填标号)。
(3) 速率方程
速率方程 (k为速率常数,只与温度、催化剂有关;n为反应级数)。
(k为速率常数,只与温度、催化剂有关;n为反应级数)。
①阿伦尼乌斯就关于速率常数与活化能 、温度(T)的关系提出经验关系式:
、温度(T)的关系提出经验关系式: (R为常数,k为速率常数,
(R为常数,k为速率常数, 为活化能,T为温度)。一定温度下,在
为活化能,T为温度)。一定温度下,在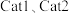 (催化剂)作用下,
(催化剂)作用下, 与
与 关系如图所示。
关系如图所示。_______ (填“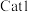 ”或“
”或“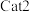 ”),判断依据是
”),判断依据是_______ 。
②为了测定反应级数(n),实验测得 在一系列不同浓度时的初始反应速率数据如下:
在一系列不同浓度时的初始反应速率数据如下:
已知:一步进行的反应称为基元反应,基元反应中反应级数等于反应物的化学计量数之和。下列叙述正确的是_______ (填标号)。
A.该总反应为二级反应
B.速率常数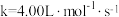
C.上述反应不是基元反应
D.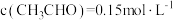 时
时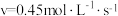
(4)一定温度下,保持总压强为 ,向反应器充入
,向反应器充入 和
和 的混合气体(
的混合气体( 不参与反应)发生反应
不参与反应)发生反应 ,测得
,测得 平衡转化率与起始投料比
平衡转化率与起始投料比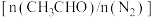 的关系如图所示。
的关系如图所示。 的平衡转化率随着投料比增大而减小的原因是
的平衡转化率随着投料比增大而减小的原因是_______ 。该温度下,上述反应M点平衡常数
_______  。(
。( 为用分压计算的平衡常数,分压=总压×物质的量分数)
为用分压计算的平衡常数,分压=总压×物质的量分数)
(5) 时,向反应器充入一定量
时,向反应器充入一定量 发生反应
发生反应 ,测得单位时间内
,测得单位时间内 转化率与压强关系如图所示。解释
转化率与压强关系如图所示。解释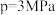 时
时 的转化率达到峰值的原因:
的转化率达到峰值的原因:_______ 。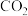 制备乙醛,其阴极的电极反应式为
制备乙醛,其阴极的电极反应式为_______ 。
 是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:
是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:(1)已知:①
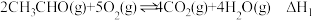
②

③
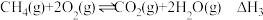
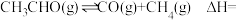
(2)在镍催化下,乙醛与氢气反应生成乙醇。在恒温恒容反应器中充入一定量
 和
和 发生反应:
发生反应: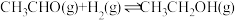 。下列叙述错误的是_______(填标号)。
。下列叙述错误的是_______(填标号)。| A.气体压强不随时间变化时达到平衡状态 |
| B.平衡后充入氖气,平衡向逆反应方向移动 |
| C.上述可逆反应的正反应是嫡增反应 |
D.平衡后,充入少量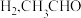 平衡转化率增大 平衡转化率增大 |
(3)
 速率方程
速率方程 (k为速率常数,只与温度、催化剂有关;n为反应级数)。
(k为速率常数,只与温度、催化剂有关;n为反应级数)。①阿伦尼乌斯就关于速率常数与活化能
 、温度(T)的关系提出经验关系式:
、温度(T)的关系提出经验关系式: (R为常数,k为速率常数,
(R为常数,k为速率常数, 为活化能,T为温度)。一定温度下,在
为活化能,T为温度)。一定温度下,在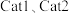 (催化剂)作用下,
(催化剂)作用下, 与
与 关系如图所示。
关系如图所示。
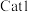 ”或“
”或“ ”),判断依据是
”),判断依据是②为了测定反应级数(n),实验测得
 在一系列不同浓度时的初始反应速率数据如下:
在一系列不同浓度时的初始反应速率数据如下: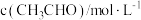 | 0.1 | 0.2 | 0.3 | 0.4 |
 | 0.020 | 0.080 | 0.182 | 0.318 |
A.该总反应为二级反应
B.速率常数
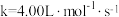
C.上述反应不是基元反应
D.
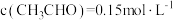 时
时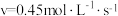
(4)一定温度下,保持总压强为
 ,向反应器充入
,向反应器充入 和
和 的混合气体(
的混合气体( 不参与反应)发生反应
不参与反应)发生反应 ,测得
,测得 平衡转化率与起始投料比
平衡转化率与起始投料比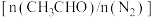 的关系如图所示。
的关系如图所示。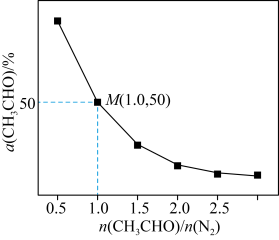
 的平衡转化率随着投料比增大而减小的原因是
的平衡转化率随着投料比增大而减小的原因是
 。(
。( 为用分压计算的平衡常数,分压=总压×物质的量分数)
为用分压计算的平衡常数,分压=总压×物质的量分数)(5)
 时,向反应器充入一定量
时,向反应器充入一定量 发生反应
发生反应 ,测得单位时间内
,测得单位时间内 转化率与压强关系如图所示。解释
转化率与压强关系如图所示。解释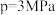 时
时 的转化率达到峰值的原因:
的转化率达到峰值的原因: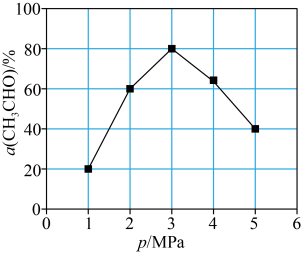
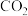 制备乙醛,其阴极的电极反应式为
制备乙醛,其阴极的电极反应式为
您最近一年使用:0次
名校
8 . 为了达到“碳中和”的目的,科学家利用化学反应进行 的捕捉生成
的捕捉生成 ,利用甲醇制取低碳烯烃(DMTO)技术在工业上有一定的经济价值。回答下列问题:
,利用甲醇制取低碳烯烃(DMTO)技术在工业上有一定的经济价值。回答下列问题:
(1)用 制备甲醇可实现碳循环,涉及的热化学反应如下:
制备甲醇可实现碳循环,涉及的热化学反应如下:
反应Ⅰ:
 ;
;
反应Ⅱ:
 ;
;
反应Ⅲ:
 。
。
反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数K随温度T变化关系如图1所示。 的平衡产率
的平衡产率____________ (填“增大”“减小”或“不变”)。
② 的数值范围是
的数值范围是__________ (填字母)。
A.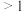 B.
B. C.
C. D.
D.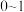
(2)一定温度下,将
 加入恒容密闭容器中,若只发生反应
加入恒容密闭容器中,若只发生反应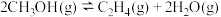
 。
。
①下列条件能判断反应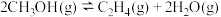 达到平衡状态的是
达到平衡状态的是__________ (填字母)。
A.容器内气体的压强不变 B.混合气体的密度保持不变
C. 的体积分数保持不变 D.
的体积分数保持不变 D. 与
与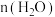 之和保持不变
之和保持不变
②若平衡后,向密闭容器再加入
 ,则平衡
,则平衡__________ (填“正向”“逆向”或“不”)移动,达到新平衡时 的体积分数
的体积分数__________ (填“增大”“减少”或“不变”)。
(3)甲醇催化制低碳烯烃时若同时发生如下反应i、ii、iii:
反应i.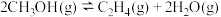
 ;
;
反应ii.
 ;
;
反应iii.
 。
。
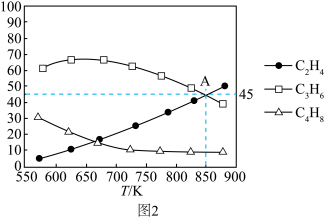
只考虑低碳烯烃之间的相对含量,不同温度下达到平衡甲醇制低碳烯烃相对含量(体积分数,y)如图2所示:______________________________ 。
②一定压强下,向初始体积为 的密闭容器中加入
的密闭容器中加入
 ,
,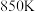 时,测得平衡时体积增大
时,测得平衡时体积增大 ,平衡时低碳烯烃相对含量如图2中
,平衡时低碳烯烃相对含量如图2中 点,则平衡时
点,则平衡时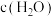 为
为__________  ,反应
,反应 与反应ii的平衡常数之比
与反应ii的平衡常数之比
__________ (用最简分数表示即可)。
③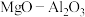 是一种甲醇脱水的保化剂。
是一种甲醇脱水的保化剂。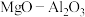 晶胞结构如图3所示(
晶胞结构如图3所示( 中美原子未画出)。请用“●”标记出B中的镁原子:
中美原子未画出)。请用“●”标记出B中的镁原子:__________ 。
 的捕捉生成
的捕捉生成 ,利用甲醇制取低碳烯烃(DMTO)技术在工业上有一定的经济价值。回答下列问题:
,利用甲醇制取低碳烯烃(DMTO)技术在工业上有一定的经济价值。回答下列问题:(1)用
 制备甲醇可实现碳循环,涉及的热化学反应如下:
制备甲醇可实现碳循环,涉及的热化学反应如下:反应Ⅰ:

 ;
;反应Ⅱ:

 ;
;反应Ⅲ:

 。
。反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数K随温度T变化关系如图1所示。

 的平衡产率
的平衡产率②
 的数值范围是
的数值范围是A.
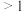 B.
B. C.
C. D.
D.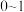
(2)一定温度下,将

 加入恒容密闭容器中,若只发生反应
加入恒容密闭容器中,若只发生反应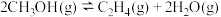
 。
。①下列条件能判断反应
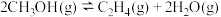 达到平衡状态的是
达到平衡状态的是A.容器内气体的压强不变 B.混合气体的密度保持不变
C.
 的体积分数保持不变 D.
的体积分数保持不变 D. 与
与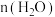 之和保持不变
之和保持不变②若平衡后,向密闭容器再加入

 ,则平衡
,则平衡 的体积分数
的体积分数(3)甲醇催化制低碳烯烃时若同时发生如下反应i、ii、iii:
反应i.
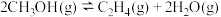
 ;
;反应ii.

 ;
;反应iii.

 。
。只考虑低碳烯烃之间的相对含量,不同温度下达到平衡甲醇制低碳烯烃相对含量(体积分数,y)如图2所示:
②一定压强下,向初始体积为
 的密闭容器中加入
的密闭容器中加入
 ,
,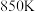 时,测得平衡时体积增大
时,测得平衡时体积增大 ,平衡时低碳烯烃相对含量如图2中
,平衡时低碳烯烃相对含量如图2中 点,则平衡时
点,则平衡时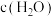 为
为 ,反应
,反应 与反应ii的平衡常数之比
与反应ii的平衡常数之比
③
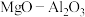 是一种甲醇脱水的保化剂。
是一种甲醇脱水的保化剂。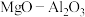 晶胞结构如图3所示(
晶胞结构如图3所示( 中美原子未画出)。请用“●”标记出B中的镁原子:
中美原子未画出)。请用“●”标记出B中的镁原子: 
您最近一年使用:0次
2024-05-26更新
|
70次组卷
|
2卷引用:2024届河南省信阳市高三下学期高考考前押题理科综合试卷-高中化学
名校
9 . 将一定量的锌、镁合金与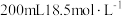 浓硫酸充分反应后,固体完全溶解,同时生成气体
浓硫酸充分反应后,固体完全溶解,同时生成气体 (生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到
(生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到 ,测得稀释后溶液中的
,测得稀释后溶液中的 浓度为
浓度为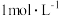 。向反应后的溶液中加入
。向反应后的溶液中加入 溶液
溶液 时,所得沉淀质量最大,其质量为
时,所得沉淀质量最大,其质量为 。下列叙述中错误的是
。下列叙述中错误的是
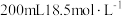 浓硫酸充分反应后,固体完全溶解,同时生成气体
浓硫酸充分反应后,固体完全溶解,同时生成气体 (生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到
(生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到 ,测得稀释后溶液中的
,测得稀释后溶液中的 浓度为
浓度为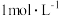 。向反应后的溶液中加入
。向反应后的溶液中加入 溶液
溶液 时,所得沉淀质量最大,其质量为
时,所得沉淀质量最大,其质量为 。下列叙述中错误的是
。下列叙述中错误的是A.气体A中 和 和 的体积比为 的体积比为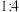 | B.该合金中锌、镁的物质的量之比为 |
C.该实验所有 的浓度是 的浓度是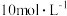 | D.沉淀质量最大时,溶液中所含溶质的质量为 |
您最近一年使用:0次
10 . 二氧化铈 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成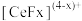 ,也能与
,也能与 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)氧化焙烧中氧化的目的是_______ 。
(2)“萃取”时存在反应: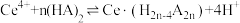 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比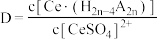 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因:_______ 。 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:_______ 。
(4)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于_______ 时, 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)
(5)“氧化”步骤中氧化剂与还原剂物质的量之比为_______ 。
(6) 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式_______ 。
(7)氧化铈 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率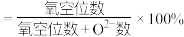 )
) 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
② 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为_______ 。
③ 晶体的密度为
晶体的密度为_______ (只需列出表达式)。
④若掺杂 后得到
后得到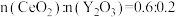 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为_______ 。
 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: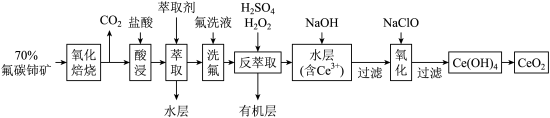
 能与
能与 结合成
结合成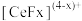 ,也能与
,也能与 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)氧化焙烧中氧化的目的是
(2)“萃取”时存在反应:
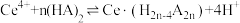 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比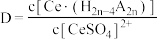 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因: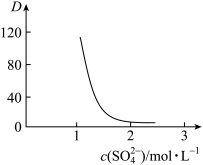
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(4)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)(5)“氧化”步骤中氧化剂与还原剂物质的量之比为
(6)
 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式(7)氧化铈
 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率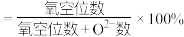 )
)
 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为②
 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为③
 晶体的密度为
晶体的密度为④若掺杂
 后得到
后得到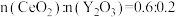 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近一年使用:0次
2024-04-24更新
|
380次组卷
|
3卷引用:2024届河南省漯河市高级中学高三下学期三模理综试题-高中化学
2024届河南省漯河市高级中学高三下学期三模理综试题-高中化学福建省福建师范大学附属中学2023-2024学年高三下学期综合测试三(4月月考)化学试题(已下线)化学(福建卷02)-2024年高考押题预测卷



