名校
解题方法
1 . 1994年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V形,键角116.5o,与SO2近似,三个原子以一个O原子为中心,与另外两个O原子分别构成一个极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个大π键——三个O原子均等地享有这4个电子。在1.01×105Pa,273K时,O3在催化剂作用下能迅速转化为O2,当生成该状态下22.4L O2时,转移电子数的物质的量为
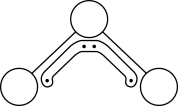
| A.1 mol | B.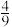 mol mol | C.0 mol | D.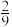 mol mol |
您最近一年使用:0次
2 . S8与NH3在无水条件下反应,得到一种二元化合物A,元素分析可知,A中含S元素69.60%。A进行如下反应:
(1)A、B、C、D的化学式分别为___________ 、___________ 、___________ 、___________ 。
(2)A与SnCl2的乙醇溶液反应除生成B外,还生成一种含Sn(IV)化合物,试写出A→B的化学方程式___________ 。
(3)D与一种无色液体(该液体是由常见的红棕色气体在加压下形成的)互为等电子体,但D与无色液体的几何构型完全不同,为环状结构,试画出D的最稳定的Lewis结构式___________ ,理由是___________ ,该Lewis结构式中,S原子的电子构型是___________ 。

(1)A、B、C、D的化学式分别为
(2)A与SnCl2的乙醇溶液反应除生成B外,还生成一种含Sn(IV)化合物,试写出A→B的化学方程式
(3)D与一种无色液体(该液体是由常见的红棕色气体在加压下形成的)互为等电子体,但D与无色液体的几何构型完全不同,为环状结构,试画出D的最稳定的Lewis结构式
您最近一年使用:0次
名校
解题方法
3 . 石墨和金刚石均属于碳的同素异形体,物理性质相差很大,归根结底是晶体结构不同造成的。已知石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如下图所示,图中用虚线标出了石墨的一个六方晶胞。___________ 。
(2)已知石墨的层间距为334.8 pm,C-C键长为142 pm,计算石墨晶体的密度为___________ (单位:g·cm-3)。
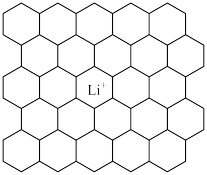
(3)石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
Ⅰ.下图给出了一个Li+沿C轴投影在A层上的位置,试在下图上标出与该离子临近的其他6个Li+的投影位置___________ 。
Ⅱ.在LiC6中,Li+与相邻石墨六元环的作用力属于何种键型___________ ?
Ⅲ.某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式___________ 。
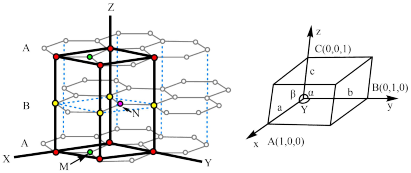
(2)已知石墨的层间距为334.8 pm,C-C键长为142 pm,计算石墨晶体的密度为
(3)石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
Ⅰ.下图给出了一个Li+沿C轴投影在A层上的位置,试在下图上标出与该离子临近的其他6个Li+的投影位置
Ⅱ.在LiC6中,Li+与相邻石墨六元环的作用力属于何种键型
Ⅲ.某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式
您最近一年使用:0次
名校
4 . 向两份20 ml 0.1 mol/LBa(OH)2溶液中各加入定量的KAl(SO4)2和Al2(SO4)3溶液的导电性随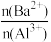 (混合前)的变化关系如图所示,下列分析不正确的是
(混合前)的变化关系如图所示,下列分析不正确的是
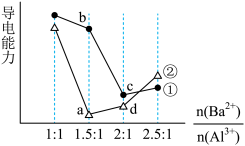
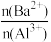 (混合前)的变化关系如图所示,下列分析不正确的是
(混合前)的变化关系如图所示,下列分析不正确的是
| A.a点溶液的pH值约为7 | B.b点溶液中大量存在的阳离子有Al3+和Ba2+ |
| C.c、d两点溶液中OH-均已完全反应 | D.②代表加入Al2(SO4)3的变化曲线 |
您最近一年使用:0次
2023-01-05更新
|
984次组卷
|
3卷引用:河南省鹤壁市高中2022-2023学年高二下学期精英对抗赛化学试题
名校
解题方法
5 . “84消毒液”广泛应用于杀菌消毒,其有效成分是 。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
资料:i. 的电离常数为
的电离常数为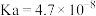 ;
; 的电离常数为
的电离常数为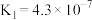 、
、
ii.碘的化合物主要以 和
和 的形式存在,
的形式存在, 。
。
iii.碘单质能与 反应:
反应: (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。
I.制备消毒液(夹持装置略)

(1)制备 的离子反应方程式
的离子反应方程式_______ 。
(2)结合资料i,写出D中反应的化学方程式_______ 。
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(3)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设1成立,实验a的操作及现象是_______ 。
假设2:过量的 将反应生成的
将反应生成的 氧化为
氧化为 。
。
设计实验b证实了假设2成立。 氧化
氧化 生成
生成 的离子方程式是
的离子方程式是_______ 。
(4)某小组检验烧杯3所得溶液中含 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的 溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由_______ 。
(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据_______ 。
(6)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是_______ 。
 。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
。实验小组制备消毒液,并利用其性质探究制备碘水的方法。资料:i.
 的电离常数为
的电离常数为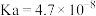 ;
; 的电离常数为
的电离常数为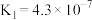 、
、
ii.碘的化合物主要以
 和
和 的形式存在,
的形式存在, 。
。iii.碘单质能与
 反应:
反应: (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。I.制备消毒液(夹持装置略)

(1)制备
 的离子反应方程式
的离子反应方程式(2)结合资料i,写出D中反应的化学方程式
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9g 固体 固体 | 溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9g 固体,再加入1 固体,再加入1 盐酸10mL 盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量 固体(小于0.5g) 固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
假设1:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设1成立,实验a的操作及现象是
假设2:过量的
 将反应生成的
将反应生成的 氧化为
氧化为 。
。设计实验b证实了假设2成立。
 氧化
氧化 生成
生成 的离子方程式是
的离子方程式是(4)某小组检验烧杯3所得溶液中含
 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的 溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
(6)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是
您最近一年使用:0次
2022-12-30更新
|
1184次组卷
|
4卷引用:河南省鹤壁市高中2022-2023学年高二下学期精英对抗赛化学试题
6 . 钪(Sc)是一种重要的稀土金属,常用来制特种玻璃、轻质耐高温合金。从“赤泥”矿(主要成分为 、
、 、
、 、
、 )中回收钪,同时生产聚合氯化铁铝[
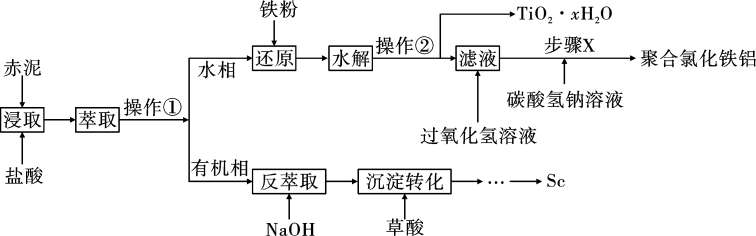
)中回收钪,同时生产聚合氯化铁铝[ ]具有极其重要的工业价值,一种工艺流程如图所示:
]具有极其重要的工业价值,一种工艺流程如图所示:
已知:钪离子可以在不同pH下生成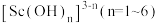 。请回答以下问题:
。请回答以下问题:
(1)基态钪原子的核外电子排布式为______ ,草酸的沸点比醋酸______ (填“高”或“低”)。
(2)操作①的名称为______ 。
(3)“反萃取”时若加入的氢氧化钠过量则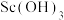 沉淀会溶解。写出
沉淀会溶解。写出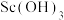 与过量NaOH溶液反应生成
与过量NaOH溶液反应生成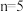 的含钪产物的离子方程式:
的含钪产物的离子方程式:_______ 。
(4)水解步骤中利于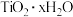 形成的措施有
形成的措施有________ 。(写两条即可)
(5)步骤X中生成聚合氯化铁铝[ ]的化学方程式为
]的化学方程式为_______ 。
(6)已知:常温下,在有 存在时,三价Sc的存在形式与
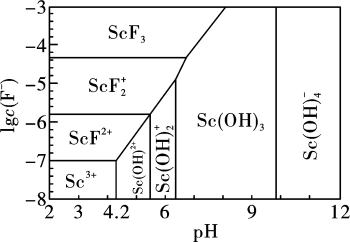
存在时,三价Sc的存在形式与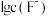 、pH的关系如图所示。请判断当
、pH的关系如图所示。请判断当 ,
, 时三价Sc的存在形式为
时三价Sc的存在形式为______ (填化学式)( )。
)。
(7)常用 将
将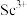 转化为草酸钪沉淀。向含
转化为草酸钪沉淀。向含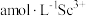 溶液中加入一定量
溶液中加入一定量 溶液,调节溶液的
溶液,调节溶液的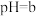 ,当
,当 浓度为
浓度为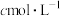 -时,
-时,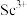 开始沉淀,则
开始沉淀,则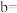
______ 。{已知: 的
的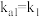 ,
,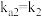 ;
;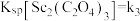 (用含a、c、
(用含a、c、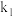 、
、 和
和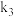 的计算式表示)
的计算式表示)
 、
、 、
、 、
、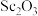 )中回收钪,同时生产聚合氯化铁铝[
)中回收钪,同时生产聚合氯化铁铝[ ]具有极其重要的工业价值,一种工艺流程如图所示:
]具有极其重要的工业价值,一种工艺流程如图所示:
已知:钪离子可以在不同pH下生成
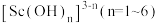 。请回答以下问题:
。请回答以下问题:(1)基态钪原子的核外电子排布式为
(2)操作①的名称为
(3)“反萃取”时若加入的氢氧化钠过量则
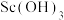 沉淀会溶解。写出
沉淀会溶解。写出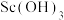 与过量NaOH溶液反应生成
与过量NaOH溶液反应生成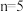 的含钪产物的离子方程式:
的含钪产物的离子方程式:(4)水解步骤中利于
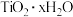 形成的措施有
形成的措施有(5)步骤X中生成聚合氯化铁铝[
 ]的化学方程式为
]的化学方程式为(6)已知:常温下,在有
 存在时,三价Sc的存在形式与
存在时,三价Sc的存在形式与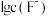 、pH的关系如图所示。请判断当
、pH的关系如图所示。请判断当 ,
, 时三价Sc的存在形式为
时三价Sc的存在形式为 )。
)。
(7)常用
 将
将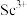 转化为草酸钪沉淀。向含
转化为草酸钪沉淀。向含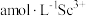 溶液中加入一定量
溶液中加入一定量 溶液,调节溶液的
溶液,调节溶液的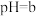 ,当
,当 浓度为
浓度为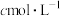 -时,
-时,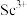 开始沉淀,则
开始沉淀,则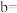
 的
的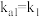 ,
,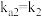 ;
;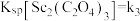 (用含a、c、
(用含a、c、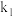 、
、 和
和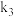 的计算式表示)
的计算式表示)
您最近一年使用:0次
2022-08-16更新
|
766次组卷
|
2卷引用:河南省鹤壁市高中2022-2023学年高二下学期精英对抗赛化学试题
7 . 电位滴定法(potentiometric titration)是在滴定过程中通过测量电位变化以确定滴定终点的方法,当电极电位(ERC)产生了突跃,被测离子浓度产生突跃,进而确定滴定终点。向10mL 0.1
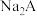 溶液(
溶液( 为二元弱酸)中逐滴滴加0.1
为二元弱酸)中逐滴滴加0.1 二元酸
二元酸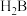 溶液,第一个电位突跃时消耗a mL
溶液,第一个电位突跃时消耗a mL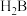 溶液,第二个电位突跃时又消耗b mL
溶液,第二个电位突跃时又消耗b mL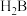 溶液,根据消耗
溶液,根据消耗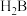 溶液体积,可判断
溶液体积,可判断 和
和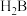 各级电离常数大小关系。下列说法错误的是
各级电离常数大小关系。下列说法错误的是

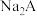 溶液(
溶液( 为二元弱酸)中逐滴滴加0.1
为二元弱酸)中逐滴滴加0.1 二元酸
二元酸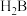 溶液,第一个电位突跃时消耗a mL
溶液,第一个电位突跃时消耗a mL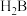 溶液,第二个电位突跃时又消耗b mL
溶液,第二个电位突跃时又消耗b mL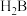 溶液,根据消耗
溶液,根据消耗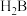 溶液体积,可判断
溶液体积,可判断 和
和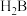 各级电离常数大小关系。下列说法错误的是
各级电离常数大小关系。下列说法错误的是A.若a=5mL、b=5mL,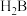 可能为强酸 可能为强酸 |
B.若a=5mL、b=15mL,则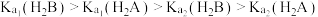 |
C.若a=5mL、b=15mL,第一个电位突跃时,溶液中: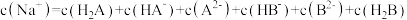 |
D.若a=10mL、b=10mL,则用0.1  溶液滴定10mL 0.1 溶液滴定10mL 0.1 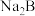 溶液,只有一个电位突跃 溶液,只有一个电位突跃 |
您最近一年使用:0次
2022-05-20更新
|
1760次组卷
|
6卷引用:河南省鹤壁市高中2022-2023学年高二下学期精英对抗赛化学试题
8 . 磷酸是生产磷肥和饲料营养剂的原料,同时还是常用的食品添加剂。常温下H3PO4在水中各级电离的过程如下图所示。已知:pK=-1gK
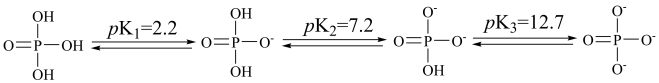
下列相关说法正确的是
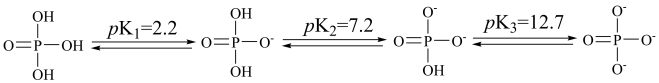
下列相关说法正确的是
A.反应 H3PO4+2PO  3HPO 3HPO pK=16 pK=16 |
B.Na2HPO4溶液中:[PO ]>2[H3PO4]+[H2PO ]>2[H3PO4]+[H2PO ] ] |
| C.用NaOH溶液滴定NaH2PO4溶液时宜选用甲基橙做指示剂 |
D.H3PO4和Na3PO4组成的混合溶液pH=6时,溶液中:[H2PO ]>[HPO ]>[HPO ]>[H3PO4] ]>[H3PO4] |
您最近一年使用:0次
2022-03-31更新
|
1263次组卷
|
2卷引用:河南省鹤壁市高中2022-2023学年高二下学期精英对抗赛化学试题
9 . 已知:①离子浓度为10-5mol/L时可认为沉淀完全;② 。向
。向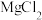 和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
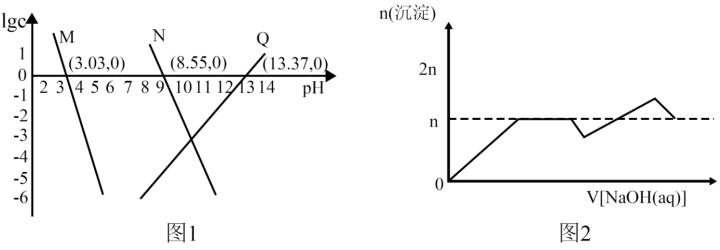
下列说法正确的是:
 。向
。向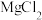 和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
下列说法正确的是:
| A.图1中M代表Mg2+ |
B. |
| C.[Al(OH)4]-完全沉淀时,溶液pH=6.37 |
| D.该实验中,沉淀的物质的量随NaOH溶液体积变化图象如图2 |
您最近一年使用:0次
2021-10-13更新
|
2317次组卷
|
2卷引用:河南省鹤壁市高中2022-2023学年高二下学期精英对抗赛化学试题
名校
解题方法
10 . 某溶液中可能含有Na+、NH 、SO
、SO 、SO
、SO 、Cl-、Fe2+、Fe3+、CO
、Cl-、Fe2+、Fe3+、CO 中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:
中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:
①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,过滤
②向①中的滤液中加入足量的NaOH溶液,有沉淀产生,微热,有气体产生
下列说法正确的是
 、SO
、SO 、SO
、SO 、Cl-、Fe2+、Fe3+、CO
、Cl-、Fe2+、Fe3+、CO 中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:
中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,过滤
②向①中的滤液中加入足量的NaOH溶液,有沉淀产生,微热,有气体产生
下列说法正确的是
A.无法确定原溶液中是否存在SO |
| B.是否存在Na+需要通过焰色反应来确定 |
C.CO 肯定不存在,Fe2+、Fe3+至少有一种 肯定不存在,Fe2+、Fe3+至少有一种 |
D.溶液中存在NH 、SO 、SO 、Cl-、Fe2+ 、Cl-、Fe2+ |
您最近一年使用:0次
2021-02-04更新
|
2511次组卷
|
5卷引用:河南省洛阳市宜阳县第一高级中学2023-2024学年高一下学期竞赛选拔赛化学试题



