1 . 利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢萘(1-MD)的副反应,涉及反应如图:
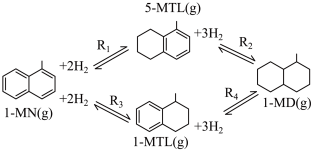
回答下列问题:
(1)1-甲基萘(1-MN)的组成元素电负性由小到大的顺序为___________ 。
(2)已知一定条件下反应 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为___________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(3)四个平衡体系的平衡常数与温度的关系如图甲所示。
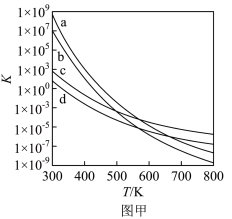
①c、d分别为反应 和
和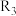 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为___________ 。
②已知反应 的速率方程
的速率方程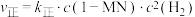 ,
,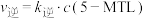 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时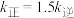 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③下列说法不正确的是___________ (填标号)。
A.四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成四氢萘类物质
D.由上述信息可知,400K时反应 速率最快
速率最快
(4)1-MN在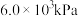 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性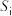 (某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数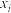 (
(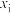 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应 的平衡常数
的平衡常数
___________  (列出计算式)。
(列出计算式)。

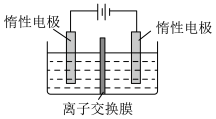
(5)利用膜电解技术(装置如图所示),以 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: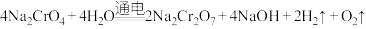 。则
。则 在
在___________ (填“阴”或“阳”)极室制得,电解时通过膜的离子主要为___________ 。

回答下列问题:
(1)1-甲基萘(1-MN)的组成元素电负性由小到大的顺序为
(2)已知一定条件下反应
 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为 、
、 、
、 的代数式表示)。
的代数式表示)。(3)四个平衡体系的平衡常数与温度的关系如图甲所示。

①c、d分别为反应
 和
和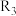 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为②已知反应
 的速率方程
的速率方程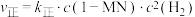 ,
,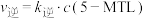 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时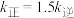 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③下列说法不正确的是
A.四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成四氢萘类物质
D.由上述信息可知,400K时反应
 速率最快
速率最快(4)1-MN在
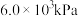 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性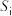 (某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数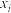 (
(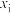 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应 的平衡常数
的平衡常数
 (列出计算式)。
(列出计算式)。
(5)利用膜电解技术(装置如图所示),以
 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: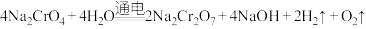 。则
。则 在
在
您最近一年使用:0次
2 . 将1.95gNa2O2加入水中,反应后配成50mL溶液A,进行如下实验。下列说法错误的是
| 编号 | ① | ② | ③ | ④ |
| 操作 | 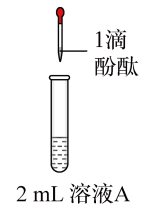 | 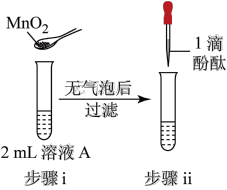 | 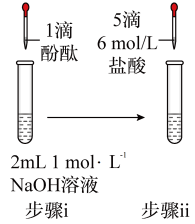 | 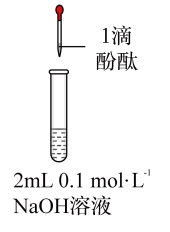 |
| 现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量使带火星的木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.溶液变红色 | 溶液变红色,2小时后无明显变化 |
| A.由实验可知,Na2O2与水反应有H2O2生成 |
B.②、③溶液褪色与 浓度较大有关 浓度较大有关 |
C.若向①褪色后的溶液中滴加5滴 盐酸,溶液将变红 盐酸,溶液将变红 |
D.若向④中继续滴加 盐酸或 盐酸或 溶液,溶液均可能褪色 溶液,溶液均可能褪色 |
您最近一年使用:0次
2023-07-07更新
|
1110次组卷
|
6卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
名校
3 . 从含有KI、KNO3等成分的工业废水中回收I2和KNO3,其流程如下:
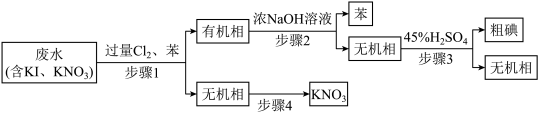
下列说法错误的是

下列说法错误的是
| A.流程中至少发生了5个氧化还原反应 |
| B.步骤1中应将无机相从分液漏斗下端放出 |
| C.步骤3需使用蒸馏烧瓶、温度计、冷凝管 |
| D.步骤4为蒸发浓缩、降温结晶、过滤 |
您最近一年使用:0次
2023-07-07更新
|
831次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
名校
解题方法
4 . 对于反应: ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是| A.该反应中,有三种元素化合价发生改变 |
B.该反应的还原剂为 和 和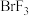 ,氧化产物为 ,氧化产物为 和 和 |
C.1.5mol 参加反应,被 参加反应,被 还原的 还原的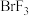 为0.4mol 为0.4mol |
D.1.5mol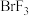 参加反应,有4mol 参加反应,有4mol 转移 转移 |
您最近一年使用:0次
2023-03-11更新
|
1256次组卷
|
4卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题浙江省强基联盟2022-2023学年高三上学期选考仿真密卷化学试题(已下线)化学-2023年高考押题预测卷01(浙江卷)(含考试版、全解全析、参考答案、答题卡)江西省宜春市丰城市第九中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
5 . 钠是一种非常活泼、具有广泛应用的金属。请回答:
(1)将一小块金属钠投入水中,发生反应的离子方程式是_______ ;可观察到的实验现象是_______ (填字母序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d.有嘶嘶声
(2)钠在空气中的燃烧产物Na2O2可用于呼吸面具或潜水艇中氧气的来源,11.6gCO2和H2O的混合物与足量Na2O2充分反应后,固体质量增加了3.6 g,则生成标准状况下O2的体积_______ L;原混合气体的中CO2和H2O的分子数比为_______ 。
(3)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是_______
(1)将一小块金属钠投入水中,发生反应的离子方程式是
a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d.有嘶嘶声
(2)钠在空气中的燃烧产物Na2O2可用于呼吸面具或潜水艇中氧气的来源,11.6gCO2和H2O的混合物与足量Na2O2充分反应后,固体质量增加了3.6 g,则生成标准状况下O2的体积
(3)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是_______
| A.取a g混合物充分加热,质量减少b g |
| B.取a g混合物与足量NaOH溶液充分反应,得到b g溶液 |
| C.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到b g固体 |
| D.取a g混合物与足量稀硫酸反应,逸出气体经干燥后用碱石灰吸收,质量增加b g |
您最近一年使用:0次
2022-11-29更新
|
538次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
6 . Ⅰ.某废水中可能大量含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、 、
、 、
、 、
、 、
、 。现进行如下实验:
。现进行如下实验:
①取少量溶液,加入KSCN溶液,无明显变化
②另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
③向②中所得溶液中加入BaCl2溶液,有白色沉淀生成
④向②中所得溶液中加入过量浓氨水,仅有红褐色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
请回答下列问题:
(1)该废水一定含有的阳离子是_______ ;
(2)实验Ⅱ中无色气体遇空气变成红棕色的化学方程式是_______ ;
(3)过滤除去Ⅳ中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为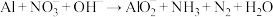 (未配平)。若除去1mol
(未配平)。若除去1mol ,消耗铝
,消耗铝_______ g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入的物质的量的关系分别如图所示:
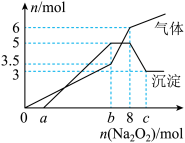
(4)写出加入 与水反应的离子方程式
与水反应的离子方程式_______ 。
(5)该溶液中一定含有的阳离子是_______ ,其对应物质的量浓度之比为_______ ,溶液中可能大量存在的阴离子是_______ 。
 、
、 、
、 、
、 、
、 。现进行如下实验:
。现进行如下实验:①取少量溶液,加入KSCN溶液,无明显变化
②另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
③向②中所得溶液中加入BaCl2溶液,有白色沉淀生成
④向②中所得溶液中加入过量浓氨水,仅有红褐色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
请回答下列问题:
(1)该废水一定含有的阳离子是
(2)实验Ⅱ中无色气体遇空气变成红棕色的化学方程式是
(3)过滤除去Ⅳ中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为
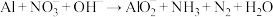 (未配平)。若除去1mol
(未配平)。若除去1mol ,消耗铝
,消耗铝Ⅱ.某混合液中,可能大量含有的离子如下表:
| 阳离子 | 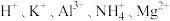 |
| 阴离子 |  |

(4)写出加入
 与水反应的离子方程式
与水反应的离子方程式(5)该溶液中一定含有的阳离子是
您最近一年使用:0次
2022-10-09更新
|
763次组卷
|
3卷引用:湖南省2022-2023学年第十五届中学生数理化生综合实践活动高一化学应用知识展示A卷
名校
解题方法
7 . 如图所示,在注射器里吸入20mL NO,然后吸入5mL水。若再吸入30mL空气(按O2体积占1/5计算),夹住弹簧夹,观察现象(不考虑摩擦力)。已知常温常压下,气体摩尔体积为24.5 L·mol-1,则下列叙述不正确的是
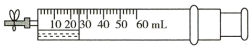

| A.最终剩余气体体积约为36mL |
| B.可观察到注射器的活塞缓缓向右移动 |
| C.可观察到注射器内气体由无色变成红棕色,最后变成无色 |
| D.若反应前后液体体积不变,所得硝酸溶液的浓度约为0.07mol/L |
您最近一年使用:0次
2022-05-03更新
|
1814次组卷
|
6卷引用:湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
名校
8 . 赖氨酸[H3N+(CH2)4CH(NH2)COO-,用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+ H2R+
H2R+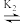 HR
HR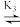 R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)=
R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)= ,下列表述
,下列表述正确 的是

 H2R+
H2R+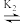 HR
HR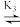 R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)=
R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)= ,下列表述
,下列表述
A. > >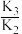 |
| B.M点,c(Cl-)+c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+) |
C.O点,pH=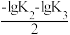 |
| D.P点,c(Na+)>c(Cl-)>c(H+)>c(OH-) |
您最近一年使用:0次
2022-01-03更新
|
1214次组卷
|
3卷引用:湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题浙江省杭州学军中学2021-2022学年高三上学期12月适应性考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第51讲 反应过程溶液粒子浓度变化的图像分析
9 . 回答下列问题
(1)最近报道,在一100℃低温下合成了化合物X,元素分析仪得出其分子式为C5H4,红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,而碳的化学环境却有两种,温度升高将迅速分解,X的可能结构式是___________ 、___________ 、___________ ;
(2)如果分子中有三种环境不同的氢,有四种环境不同的碳,该烃的可能结构式为___________ 、___________ ;
(3)如果氢有两种环境,碳有四种环境,该烃可能结构式为___________ 、___________ ;
(4)如果氢有两种环境,碳有三种环境,该烃的结构简式可能为___________ 、___________ 、___________ 。
(1)最近报道,在一100℃低温下合成了化合物X,元素分析仪得出其分子式为C5H4,红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,而碳的化学环境却有两种,温度升高将迅速分解,X的可能结构式是
(2)如果分子中有三种环境不同的氢,有四种环境不同的碳,该烃的可能结构式为
(3)如果氢有两种环境,碳有四种环境,该烃可能结构式为
(4)如果氢有两种环境,碳有三种环境,该烃的结构简式可能为
您最近一年使用:0次
19-20高一·浙江·期中
名校
10 . 下列说法不正确的是
| A.某硝酸密度为1.42g·cm-3,质量分数为63%,此硝酸物质的量浓度为14.2 mol·L-1 |
| B.100 g浓度为c mol·L-1 的硫酸中加入一定的水稀释成0.5c mol·L-1, 则加入水的体积大于100 mL(已知硫酸的浓度越大,其密度越大) |
| C.将a%的氨水和(100-a)%的氨水等体积混合后,所得溶液的质量分数可能为小于或等于50%(已知氨水的浓度越大,其密度越小) |
D.VLAl2(SO4)3溶液中含Al3+mg,则溶液中 的物质的量浓度为 的物质的量浓度为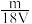 mol·L-1 mol·L-1 |
您最近一年使用:0次
2020-12-16更新
|
2363次组卷
|
4卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题



