解题方法
1 . 25℃时,向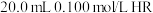 溶液中滴加
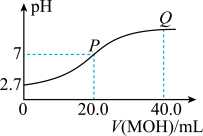
溶液中滴加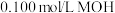 溶液,混合溶液的pH与加入MOH溶液体积的变化关系如图所示。下列说法错误的是
溶液,混合溶液的pH与加入MOH溶液体积的变化关系如图所示。下列说法错误的是
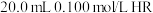 溶液中滴加
溶液中滴加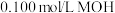 溶液,混合溶液的pH与加入MOH溶液体积的变化关系如图所示。下列说法错误的是
溶液,混合溶液的pH与加入MOH溶液体积的变化关系如图所示。下列说法错误的是
A.HR的电离常数的数量级为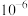 |
B.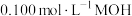 溶液的电离度大于1% 溶液的电离度大于1% |
C.P点溶液中水电离出的 浓度一定大于 浓度一定大于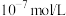 |
D.Q点溶液中存在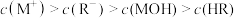 |
您最近一年使用:0次
解题方法
2 . 草酸( )是一种二元弱酸。常温下,用
)是一种二元弱酸。常温下,用 溶液滴定
溶液滴定
 溶液(忽略滴定过程中溶液体积变化),得到
溶液(忽略滴定过程中溶液体积变化),得到 、
、 和
和 三种粒子的分布分数
三种粒子的分布分数 (平衡时某种含碳微粒浓度占各种含碳微粒浓度之和的分数)随溶液
(平衡时某种含碳微粒浓度占各种含碳微粒浓度之和的分数)随溶液 变化的曲线如图所示。下列说法正确的是
变化的曲线如图所示。下列说法正确的是

 )是一种二元弱酸。常温下,用
)是一种二元弱酸。常温下,用 溶液滴定
溶液滴定
 溶液(忽略滴定过程中溶液体积变化),得到
溶液(忽略滴定过程中溶液体积变化),得到 、
、 和
和 三种粒子的分布分数
三种粒子的分布分数 (平衡时某种含碳微粒浓度占各种含碳微粒浓度之和的分数)随溶液
(平衡时某种含碳微粒浓度占各种含碳微粒浓度之和的分数)随溶液 变化的曲线如图所示。下列说法正确的是
变化的曲线如图所示。下列说法正确的是
A. 的电离程度小于其水解程度 的电离程度小于其水解程度 |
B.Q点溶液中: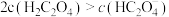 |
C. 时,混合溶液中: 时,混合溶液中: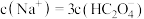 |
D.整个滴定过程中存在: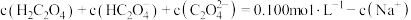 |
您最近一年使用:0次
名校
解题方法
3 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。请回答下列有关平衡的问题。
Ⅰ.在一定温度下,向一个容积不变(1L)的密闭容器中,加入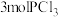 和
和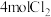 使之发生反应
使之发生反应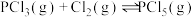 ,起始时压强为
,起始时压强为 ,平衡时容器内压强为起始时的6/7。计算并回答:
,平衡时容器内压强为起始时的6/7。计算并回答:
(1)已知:可逆反应的平衡常数可以用平衡分压代替平衡浓度(称为分压平衡常数,用 表示)计算,分压=总压×物质的量分数,则上述反应的
表示)计算,分压=总压×物质的量分数,则上述反应的
_______ (用含 的代数式表示)。
的代数式表示)。
(2)保持同一反应温度和体积,若将起始物改为amolPCl3,bmolCl2,cmol 。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为
。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为_______ 。
Ⅱ.某三元羧酸在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向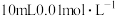 的溶液中滴入等浓度的NaOH溶液,H3A、
的溶液中滴入等浓度的NaOH溶液,H3A、 、
、 、
、 的物质的量分数与溶液的pH的关系如图所示。
的物质的量分数与溶液的pH的关系如图所示。
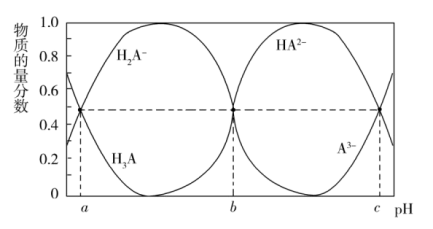
(3)常温时, 的
的 溶液的pH约为
溶液的pH约为_______ 。(已知 )
)
(4)常温时,反应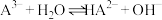 的平衡常数为K=
的平衡常数为K=_______ (用含a或b或c的代数式表示)
(5)当滴入30mLNaOH溶液时,下列溶液中微粒浓度关系正确的是_______
Ⅲ.含有 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
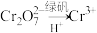 、
、
(6)该废水加硫酸酸化后,再加入绿矾( ),发生反应的离子方程式为
),发生反应的离子方程式为_______ 。
(7)若处理后的废水中残留的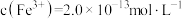 ,则残留的
,则残留的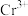 的浓度为
的浓度为_______ mol/L。(已知: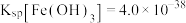 ,
,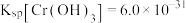 )。
)。
Ⅰ.在一定温度下,向一个容积不变(1L)的密闭容器中,加入
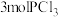 和
和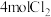 使之发生反应
使之发生反应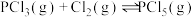 ,起始时压强为
,起始时压强为 ,平衡时容器内压强为起始时的6/7。计算并回答:
,平衡时容器内压强为起始时的6/7。计算并回答:(1)已知:可逆反应的平衡常数可以用平衡分压代替平衡浓度(称为分压平衡常数,用
 表示)计算,分压=总压×物质的量分数,则上述反应的
表示)计算,分压=总压×物质的量分数,则上述反应的
 的代数式表示)。
的代数式表示)。(2)保持同一反应温度和体积,若将起始物改为amolPCl3,bmolCl2,cmol
 。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为
。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为Ⅱ.某三元羧酸在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向
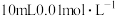 的溶液中滴入等浓度的NaOH溶液,H3A、
的溶液中滴入等浓度的NaOH溶液,H3A、 、
、 、
、 的物质的量分数与溶液的pH的关系如图所示。
的物质的量分数与溶液的pH的关系如图所示。
(3)常温时,
 的
的 溶液的pH约为
溶液的pH约为 )
)(4)常温时,反应
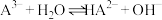 的平衡常数为K=
的平衡常数为K=(5)当滴入30mLNaOH溶液时,下列溶液中微粒浓度关系正确的是_______
A.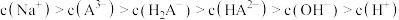 |
B.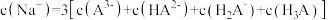 |
C.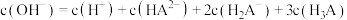 |
D.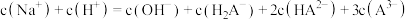 |
Ⅲ.含有
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含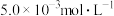 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理: 、
、
(6)该废水加硫酸酸化后,再加入绿矾(
 ),发生反应的离子方程式为
),发生反应的离子方程式为(7)若处理后的废水中残留的
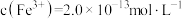 ,则残留的
,则残留的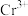 的浓度为
的浓度为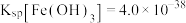 ,
,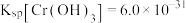 )。
)。
您最近一年使用:0次
2023-02-09更新
|
440次组卷
|
3卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期末考试化学试题
名校
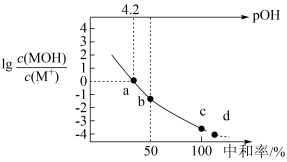
4 . 常温下,向 某一元碱
某一元碱 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液中
溶液,溶液中 、
、 、中和率的变化如图所示。
、中和率的变化如图所示。 为
为 的电离常数,
的电离常数,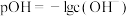 ,中和率
,中和率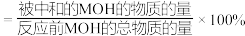 。下列说法正确的是
。下列说法正确的是
 某一元碱
某一元碱 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液中
溶液,溶液中 、
、 、中和率的变化如图所示。
、中和率的变化如图所示。 为
为 的电离常数,
的电离常数,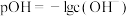 ,中和率
,中和率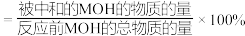 。下列说法正确的是
。下列说法正确的是
A.根据a点数据计算,常温下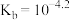 |
| B.溶液中水的电离程度从a点到d点逐渐增大 |
C.b点时, |
D.c点溶液中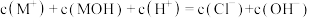 |
您最近一年使用:0次
2022-05-20更新
|
894次组卷
|
2卷引用:湖南省湘西州吉首市2022年基础教育综合实践改革成果展示活动检测高二化学试题
名校
解题方法
5 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积[V(NO)](已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
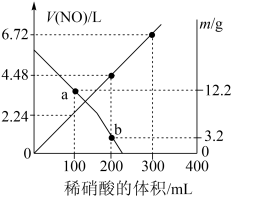

| A.稀硝酸的浓度为0.4mol·L-1 |
| B.a点时,100mL稀硝酸中溶解了Fe和Cu共8.4g |
| C.b点对应的溶液中可能含有的金属阳离子为Fe2+、Fe3+、Cu2+ |
| D.加入稀硝酸至400mL时,收集到的V(NO)约为6.91L |
您最近一年使用:0次
2022-05-03更新
|
3631次组卷
|
14卷引用:湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题
湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题江西省重点2021-2022学年高一下学期5月联考化学试题山西省长治市2021-2022学年高一下学期期末联合考化学试题山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题辽宁省县级重点高中协作体2021-2022学年高一下学期期中考试化学试题(已下线)微专题23 金属与硝酸反应的规律与计算-备战2023年高考化学一轮复习考点微专题(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)辽宁省沈阳实验中学2022-2023学年高二上学期开学考试化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期第一次验收考试化学试题江西省上饶市民校考试联盟2022—2023学年高一下学期阶段测试(四)化学试题新疆维吾尔自治区和田地区策勒县2022-2023学年高三上学期11月期中考试化学试题
解题方法
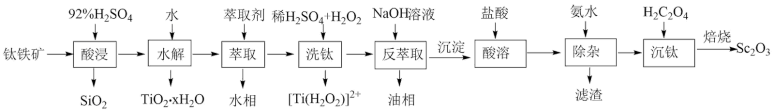
6 . 钪( )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为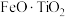 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取 的流程如下:
的流程如下:
已知:①当离子浓度减小至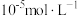 时可认为沉淀完全
时可认为沉淀完全
②室温下,溶液中离子沉淀完全的 如下表所示:
如下表所示:
③ ,
,
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的化学方程式是
,其水解反应的化学方程式是___________ 。
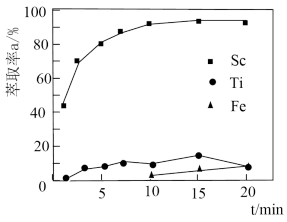
(2)“萃取”时,使用 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________  。
。
(3)“洗钛”所得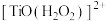 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是___________ 。(写出两点)
(4)“酸溶”后滤液中存在的阳离子 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是___________ 。
(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。
 )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为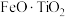 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取 的流程如下:
的流程如下:
已知:①当离子浓度减小至
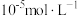 时可认为沉淀完全
时可认为沉淀完全②室温下,溶液中离子沉淀完全的
 如下表所示:
如下表所示:| 离子 |  |  |  |
沉淀完全的 | 3.2 | 9.0 | 1.05 |
 ,
,回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的化学方程式是
,其水解反应的化学方程式是(2)“萃取”时,使用
 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为 。
。
(3)“洗钛”所得
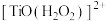 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是(4)“酸溶”后滤液中存在的阳离子
 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 某试液中只可能含有K+、NH 、Fe2+、Al3+、Cl-、SO
、Fe2+、Al3+、Cl-、SO 、CO
、CO 、AlO
、AlO 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:下列说法正确的是
中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:下列说法正确的是
 、Fe2+、Al3+、Cl-、SO
、Fe2+、Al3+、Cl-、SO 、CO
、CO 、AlO
、AlO 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:下列说法正确的是
中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:下列说法正确的是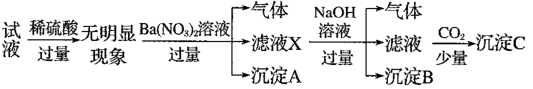
A.无法确定原试液中是否含有SO |
B.滤液X中大量存在的阳离子有NH 、Fe2+和Ba2+ 、Fe2+和Ba2+ |
| C.沉淀C为Al(OH)3 |
| D.原试液中一定不含有K+ |
您最近一年使用:0次
2020-12-17更新
|
1761次组卷
|
6卷引用:湖南省湘西州吉首市2022年基础教育综合实践改革成果展示活动检测高二化学试题
名校
解题方法
8 . 某化学实验小组将装有铜与浓硫酸烧瓶加热一段时间后,取出烧瓶中固体,探究其成分。查资料可知,浓硫酸与铜反应可能生成CuS或Cu2S,它们都难溶于水,能溶于稀硝酸。实验如下:
(i)用蒸馏水洗涤固体,得到蓝色溶液,固体呈黑色。
(ii)取少量黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变为蓝色,产生无色气泡。取少量上层清液于试管,滴加氯化钡溶液,产生白色沉淀。
①根据实验(i)得到蓝色溶液可知,固体中含____________ (填化学式)
②根据实验(ii)的现象_______ (填“能”或“不能”)确定黑色固体是CuS还是Cu2S,理由是__________________________________________________________________________ 。
写出Cu2S与稀硝酸反应的化学方程式____________________________________________
③为了进一步探究黑色固体的成分,将实验(i)中黑色固体洗涤、烘干,再称取48.0g黑色固体进行如下实验,通入足量O2,使硬质玻璃管中黑色固体充分反应,观察到F瓶中品红溶液褪色。
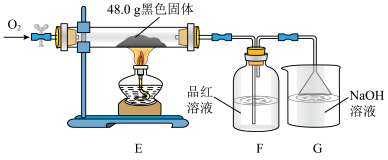
根据上表实验数据推测:实验I中黑色固体的化学式为_____________________________ ;实验Ⅱ中黑色固体的成分及质量为_______________________________________________ 。
(i)用蒸馏水洗涤固体,得到蓝色溶液,固体呈黑色。
(ii)取少量黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变为蓝色,产生无色气泡。取少量上层清液于试管,滴加氯化钡溶液,产生白色沉淀。
①根据实验(i)得到蓝色溶液可知,固体中含
②根据实验(ii)的现象
写出Cu2S与稀硝酸反应的化学方程式
③为了进一步探究黑色固体的成分,将实验(i)中黑色固体洗涤、烘干,再称取48.0g黑色固体进行如下实验,通入足量O2,使硬质玻璃管中黑色固体充分反应,观察到F瓶中品红溶液褪色。

| 实验序号 | 反应前黑色固体质量/g | 充分反应后黑色固体质量/g |
| I | 48.0 | 48.0 |
| Ⅱ | 48.0 | 44.0 |
| Ⅲ | 48.0 | 40.0 |
您最近一年使用:0次
2019-07-05更新
|
657次组卷
|
3卷引用:湖南省湘东六校2018-2019学年高二下学期期末联考化学试题
名校
9 . 汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
| A.生成44.8L N2(标准状况) |
| B.有0.25 mol KNO3被还原 |
| C.转移电子的物质的量为1.75mol |
| D.被氧化的N原子的物质的量为3.75mol |
您最近一年使用:0次
2019-07-05更新
|
9182次组卷
|
8卷引用:湖南省湘东六校2018-2019学年高二下学期期末联考化学试题
名校
10 . 在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HCl溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
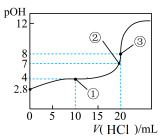
| A.图中②点所示溶液的导电能力弱于①点 |
| B.③点处水电离出的c(H+)=1×10-8mol·L-1 |
| C.图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| D.25℃时氨水的Kb约为5×10-5.6mol·L-1 |
您最近一年使用:0次
2019-05-24更新
|
3124次组卷
|
13卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题
湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题黑龙江省齐齐哈尔市2023-2024学年高二上学期1月期末化学试题【市级联考】山东省烟台市、菏泽市2019届高三下学期5月高考适应性练习(一)理科综合化学试题四川省泸县第五中学2020届高三上学期开学考试理综化学试题备考突破2020高三化学专题强化集训——盐类水解中三大守恒的应用安徽省定远县重点中学2020届高三下学期3月线上模拟考试理科综合化学试题山西省实验中学2023-2024学年高二上学期期中考试化学试题江西省宜春市上高中学2023-2024学年高二上学期第二次月考化学试卷 黑龙江省双鸭山市第一中学2023-2024学年高二下学期开学化学试题四川省绵阳中学2023-2024学年高二下学期开学化学试题2024年江西省宜春市第一中学高三下学期第三次模拟考试化学试卷四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题



