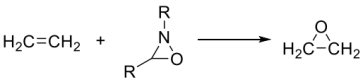
1 . 请为以下转化提供合理的中间体和过渡态结构,并根据相关过渡态的立体化学模型确定产物中手性中心的立体化学___________ 。


您最近一年使用:0次
2 . 完成下列问题。
(1)画出下面反应过渡态的前线轨道示意图___________ 。
(2)试比较下列各组中两个化合物的第一电离势(IP1)大小,并简述理由。
(i) :
:___________ 。
(ii) :
:___________ 。
(iii) :
:___________ 。
(iv) :
:___________ 。
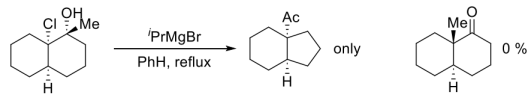
(3)为以下反应结果给出一个合适的解释(最好画出反应的过渡态)___________ 。
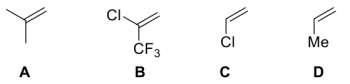
(4)下列烯烃与BH3发生硼氢化反应的速率从快到慢的排序为___________ 。
(5)下列二醇被高碘酸氧化的速率从快到慢的排序为___________ 。

(6)为什么负离子亲核试剂,例如碳负离子,在DMSO中的亲核性会显著增强___________ ?
(7)相比于四氢呋喃中,碘负离子的亲核性在甲醇中是更强还是更弱,为什么___________ ?
(1)画出下面反应过渡态的前线轨道示意图

(2)试比较下列各组中两个化合物的第一电离势(IP1)大小,并简述理由。
(i)
 :
:(ii)
 :
:(iii)
 :
:(iv)
 :
:(3)为以下反应结果给出一个合适的解释(最好画出反应的过渡态)

(4)下列烯烃与BH3发生硼氢化反应的速率从快到慢的排序为

(5)下列二醇被高碘酸氧化的速率从快到慢的排序为

(6)为什么负离子亲核试剂,例如碳负离子,在DMSO中的亲核性会显著增强
(7)相比于四氢呋喃中,碘负离子的亲核性在甲醇中是更强还是更弱,为什么
您最近一年使用:0次
解题方法
3 . 硅可以和多种金属形成组成各异、结构丰富的二元化合物。例如,在Ca-Si体系中,有Ca₅Si,Ca2Si,CaSi2,CaSi3等等。随着高压科学和技术的发展,总来越多的新物相新结构得以发现且呈现出有趣的成键特点。在20GPa条件下得到的二元Ca-Si化合物D属四方晶系,晶胞参数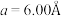 ,
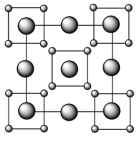
,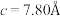 ,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表
,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表 ,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为
,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为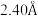 。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
(1)写出化合物D晶体的点阵型式和结构基元___________ 。(提示:注意同号电荷相斥!)
(2)若将晶胞原点取在四聚硅簇平面正方形的中心,写出晶胞中所有原子的坐标参数_______ 。
(3)写出Si的氧化数并画出四聚硅阴离子的经典Lewis结构___________ 。
(4)化学物D不稳定,大气压下可发生分解。其产物之一便是CaSi2.CaSi2也有丰富的结构,其中一种结构中,硅通过三连接方式形成二维延伸,硅只有一种化学环境且所有硅原子的价层均满足八电子。画出该结构的示意图___________ 。(要求:示出结构特征,至少包含20个硅原子,并勾勒出二维晶胞)
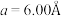 ,
,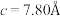 ,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表
,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表 ,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为
,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为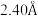 。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
(1)写出化合物D晶体的点阵型式和结构基元
(2)若将晶胞原点取在四聚硅簇平面正方形的中心,写出晶胞中所有原子的坐标参数
(3)写出Si的氧化数并画出四聚硅阴离子的经典Lewis结构
(4)化学物D不稳定,大气压下可发生分解。其产物之一便是CaSi2.CaSi2也有丰富的结构,其中一种结构中,硅通过三连接方式形成二维延伸,硅只有一种化学环境且所有硅原子的价层均满足八电子。画出该结构的示意图
您最近一年使用:0次
4 . 以乳糖、 玉米浆为原料在微生物作用下得到含青霉素(~ 8mg/L)的溶液,过滤掉微生物后,溶液经下列萃取和反萃取过程(已略去所加试剂),可得到青霉素钠盐(~8g/L)。 流程为:滤液打入萃取釜,先调节pH=2后加入溶剂,再调节pH=7.5,加入水;反复此过程,最后加丁醇,得到产物纯的青霉素钠盐。(如下流程图)_______ 。为什么不用便宜的乙酸乙酯_______ 。
(2)在pH=7.5时,加水的原因是_______ 。
(3)加丁醇的原因是_______ 。

已知青霉素结构式: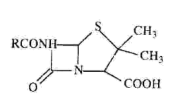
(2)在pH=7.5时,加水的原因是
(3)加丁醇的原因是
您最近一年使用:0次
解题方法
5 . 类阴离子型层状化合物,其主体层板由二元(或多元)金属氢氧化物构成,最典型的例子是水滑石结构。
(1)下图代表了氢氧化镁的层板结构。图中黑线连接的菱形是一个最小二维晶胞,其中晶胞参数a=b=a0, α= 120°。一个晶胞中含有___________ 个OH- ,Mg2+的配位数是___________ 。

(2)将上图氢氧化镁的层板结构中的部分Mg2+用Al3+取代,可得化学式为Mg2Al(OH)6(CO3)x·H2O的一、种水滑石层板(结构如下图所示),x=______ ,其层板带 ____________ 电荷,____________ 进入层间平衡电荷。请在下图中画出最小二维晶胞(以图中Al为顶点) ______ 。每个镁氧八面体周围有_____ 个相邻铝氧八面体和 ______ 个相邻镁氧八面体。 忽略Al3+取代Mg2+对层板结构的影响,则天然的水滑石晶胞参数a'=_______ a0。
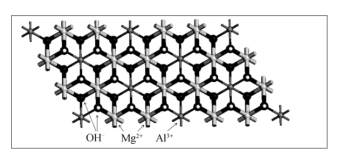
(3)层状复合金属氢氧化物在Z方向的堆积方式有两种,其中一种如下图所示。假设两个层板之间的距离为d0,层板厚度为田l0,则 此种堆积方式的晶胞参数c为___________ 。

(4)水滑石层间的阴离子可以被其他阴离子取代,因此水滑石可以作为离子交换剂,去除水体中阴离子。去除效果依次为: PO >CrO
>CrO > NO
> NO ,其原因是
,其原因是___________ 。
(1)下图代表了氢氧化镁的层板结构。图中黑线连接的菱形是一个最小二维晶胞,其中晶胞参数a=b=a0, α= 120°。一个晶胞中含有

(2)将上图氢氧化镁的层板结构中的部分Mg2+用Al3+取代,可得化学式为Mg2Al(OH)6(CO3)x·H2O的一、种水滑石层板(结构如下图所示),x=

(3)层状复合金属氢氧化物在Z方向的堆积方式有两种,其中一种如下图所示。假设两个层板之间的距离为d0,层板厚度为田l0,则 此种堆积方式的晶胞参数c为

(4)水滑石层间的阴离子可以被其他阴离子取代,因此水滑石可以作为离子交换剂,去除水体中阴离子。去除效果依次为: PO
 >CrO
>CrO > NO
> NO ,其原因是
,其原因是
您最近一年使用:0次
解题方法
6 . 卡尔-费休(Karl-Fischer) 法是测定有机溶剂中的微量水含量的经典方法。所用试剂由碘、二氧化硫、吡啶(C5H5N,有机碱,与H+反应生成C5H5NH+)和无水甲醇按一定比例配制而成。该试剂与待测溶剂中的水反应后,产物的含量用库仑滴定法来测定。
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为___________ 。
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是___________ 。
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:___________ 。。
(4)测定20.0 mL有机溶剂含水量____ 。库仑滴定时,以24.8 mA恒定电流通电302s时达到反应终点(电极反应: 2I-- 2e = I2)。求该有机溶剂的含水量(mg·L-1) ____ 。已知: 1 mol电子的电量为9.65× 104C,电量计算公式Q=It
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:
(4)测定20.0 mL有机溶剂含水量
您最近一年使用:0次
7 . 化合物I是一种抗癫痫药物,我国科学家近来发现I对消除由蜈蚣叮咬产生的严重临床症状有良好效果。I的两条合成路线如下图所示。___________ 。
(2) G的分子式是C9H11N3O4, 写出D、F、H、K、I的结构简式:_______
(3)由E生成F,和由B生成J的反应类型都是芳香取代反应,它们之间的不同之处是___________ 。
(4) 写出由B生成J反应中的中间体的各共振式(写出4个)_______ 。
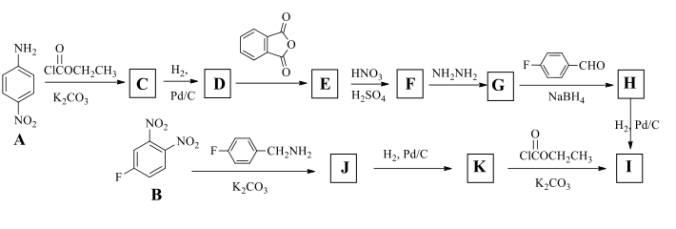
(2) G的分子式是C9H11N3O4, 写出D、F、H、K、I的结构简式:
(3)由E生成F,和由B生成J的反应类型都是芳香取代反应,它们之间的不同之处是
(4) 写出由B生成J反应中的中间体的各共振式(写出4个)
您最近一年使用:0次
8 .
(1)质谱中同位素带来的特征峰可用来鉴定某些元素。某氯代烃或溴代烃的质谱中分子离子峰如图所示。

氯和溴的天然同位素丰度比分别为35Cl:37C1≈3: 1;79Br:8lBr≈1 : 1,该有机物是___________ 代烃;其分子式是___________ 。
(2)如下图是水的相图,每一条线表示两相共存,比如,OC表示冰-水共存。

I.冰-气共存线是___________ ;
II.夏天将衣服晾干,请在图中用虚线画出水的状态变化(g 点是湿衣服中水的起始状态,此时空气中水的蒸气压为fPa)___________ 。
(3)已知:配合物CuSO4·5H2O的结构式为Cu(H2O)4SO4·H2O。某同学测定下列在水中的摩尔电导率如下表所示,试从结构角度说明下列各配合物摩尔导电率变化的原因___________ 。
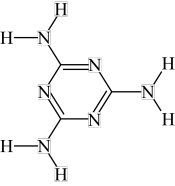
(4)多重氢键在生命体、分子自组装和响应型功能材料领域都有重要应用。三聚氰酸和三聚氰胺(1:1) 可以通过多重氢键自组装构成二维片状结构,被形象地称为“分子饼”。请用虚线在下图中直接画出两个分子间存在的氢键___________ ,并画出二维片状结构中的一个环的结构___________ (分别以× 和 表示三聚氰酸和三聚氰胺分子)。
表示三聚氰酸和三聚氰胺分子)。

(5)查文献知: 25 ℃时,PbCrO4在不同条件下的溶解度如下:
分别说明PbCrO4在三种溶液中的溶解度都比在水中的大的原因_______ 。
(1)质谱中同位素带来的特征峰可用来鉴定某些元素。某氯代烃或溴代烃的质谱中分子离子峰如图所示。

氯和溴的天然同位素丰度比分别为35Cl:37C1≈3: 1;79Br:8lBr≈1 : 1,该有机物是
(2)如下图是水的相图,每一条线表示两相共存,比如,OC表示冰-水共存。

I.冰-气共存线是
II.夏天将衣服晾干,请在图中用虚线画出水的状态变化(g 点是湿衣服中水的起始状态,此时空气中水的蒸气压为fPa)
(3)已知:配合物CuSO4·5H2O的结构式为Cu(H2O)4SO4·H2O。某同学测定下列在水中的摩尔电导率如下表所示,试从结构角度说明下列各配合物摩尔导电率变化的原因
| 配合物 | 摩尔电导率/ S·m2·mol-l |
| PtCl4·6NH3 | 523 |
| PtCl4·5NH3 | 404 |
| PtCl4·4NH3 | 229 |
| PtCl4·3NH3 | 97 |
| PtCl4·2NH3 | 0 |
(4)多重氢键在生命体、分子自组装和响应型功能材料领域都有重要应用。三聚氰酸和三聚氰胺(1:1) 可以通过多重氢键自组装构成二维片状结构,被形象地称为“分子饼”。请用虚线在下图中直接画出两个分子间存在的氢键
 表示三聚氰酸和三聚氰胺分子)。
表示三聚氰酸和三聚氰胺分子)。

(5)查文献知: 25 ℃时,PbCrO4在不同条件下的溶解度如下:
| 溶媒 | H2O | 0.1 mol·L-1的CH3COONH4 | 0.1 mol·L-1的HClO4. | 0.9 mol·L-1的KOH |
| 溶解度/ mol·L-1 | 5.3×10-7 | 4.3×10-6 | 1.3×10-4 | 3.7×10-2 |
分别说明PbCrO4在三种溶液中的溶解度都比在水中的大的原因
您最近一年使用:0次
9 . 下图是一种染料敏化太阳能电池的示意图,电池的一个电极由吸附光敏染料(D)的TiO2。纳米晶体涂敷在导电玻璃上构成,另一电极由Pt-导电玻璃构成,工作原理为:

①TiO2/D +TiO2/D*(激发态)
+TiO2/D*(激发态)
②TiO2/D*→TiO2/D+e-
③还原剂A+D→D+氧化产物B
④还原剂A再生
回答下列问题:
(1)Pt电极是该电池的_______ 极(填“正”或“负”)。
(2)结合图示写出③的离子方程式(其中染料分子用D表示)_______ 。
(3)电池工作过程中,导带中的e-会与D+发生复合,该反应的速率常数为kˊ,步骤③的速率常数为k,若该电池持续稳定工作,则k_______ kˊ(填“>”或“<”)。
(4)导电玻璃材料的选择非常重要,你认为该材料应具备哪些性能(回答两条即可)_______ 。
(5)一种经典的染料D以金属离子Mx+为中心,2,2ˊ-联吡啶衍生物(用L表示,结构如图,分子式为C12H8N2O4)和SCN-为配体,化学式可用M(L)n(NCS)6-2n表示。
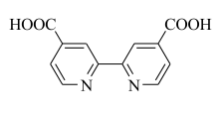
①已知D中C、H、N元素质量分数分别为44.25%、2.27%、11.91%,通过计算判断出金属M的种类_______ ,n=_______ 。
②若D为抗磁性,写出中心离子Mx+价电子的轨道表示式_______ ,其杂化轨道类型为_______ 。
③已知SCN-中N原子与中心离子配位,画出D可能的结构,配体L用 表示
表示_______ 。

①TiO2/D
 +TiO2/D*(激发态)
+TiO2/D*(激发态)②TiO2/D*→TiO2/D+e-
③还原剂A+D→D+氧化产物B
④还原剂A再生
回答下列问题:
(1)Pt电极是该电池的
(2)结合图示写出③的离子方程式(其中染料分子用D表示)
(3)电池工作过程中,导带中的e-会与D+发生复合,该反应的速率常数为kˊ,步骤③的速率常数为k,若该电池持续稳定工作,则k
(4)导电玻璃材料的选择非常重要,你认为该材料应具备哪些性能(回答两条即可)
(5)一种经典的染料D以金属离子Mx+为中心,2,2ˊ-联吡啶衍生物(用L表示,结构如图,分子式为C12H8N2O4)和SCN-为配体,化学式可用M(L)n(NCS)6-2n表示。

①已知D中C、H、N元素质量分数分别为44.25%、2.27%、11.91%,通过计算判断出金属M的种类
②若D为抗磁性,写出中心离子Mx+价电子的轨道表示式
③已知SCN-中N原子与中心离子配位,画出D可能的结构,配体L用
 表示
表示
您最近一年使用:0次
10 . 以FeCl3溶液和不同的强碱弱酸盐溶液作为研究对象,探究盐溶液之间反应的多样性。
(1)①实验I中选用稀盐酸而不用蒸馏水的原因(结合离子方程式解释):_______ 。
②实验I中稀释所得0.1mol/LFeCl3溶液的pH_______ (选填字母序号)。
a.小于1 b.1~2之间 c.大于2
(2)①用光束照射实验II中红褐色液体有丁达尔现象表明其为_______ 分散系。
②取少量实验II中红褐色液体加足量盐酸酸化,再加BaCl2溶液有白色沉淀,由此推断FeCl3溶液与Na2SO3溶液发生反应的离子方程式是_______ 。
(3)一些弱酸的电离常数(Ka)如下表所示
解释实验II和III现象不同的原因:_______ 。
(4)查阅资料:FeS和Fe2S3均为难溶于水的黑色固体,其溶度积常数(Ksp)如下表:
用离子方程式解释实验IV中划线部分现象产生的原因:_______ 。
(5)反思与评价:FeCl3溶液和不同的强碱弱酸盐溶液反应的多样性与_______ 有关(至少答出2种影响因素)。
| 实验 | 现象 |
| I.用FeCl3·6H2O与稀盐酸配制1mol/LFeCl3溶液(pH=1);取部分溶液稀释至0.lmol/L备用 | —— |
| II.取1mL1mol/LFeCl3溶液,加入3mL0.5mol/LNa2SO3溶液 | 黄色溶液转变为红褐色液体 |
| II.取1mL1mol/LFeCl3溶液,加入3mL0.5mol/LNa2CO3溶液 | 迅速产生红褐色沉淀和无色气体 |
| IV.取10mL0.1mol/LFeCl3溶液,滴加0.5mo/LNa2S溶液 | 加入2滴,出现黑色沉淀,振荡后消失,溶液澄清;再加2滴,又出现黑色沉淀,振荡后消失,同时出现少量淡黄色沉淀,并有臭鸡蛋味气体产生 |
(1)①实验I中选用稀盐酸而不用蒸馏水的原因(结合离子方程式解释):
②实验I中稀释所得0.1mol/LFeCl3溶液的pH
a.小于1 b.1~2之间 c.大于2
(2)①用光束照射实验II中红褐色液体有丁达尔现象表明其为
②取少量实验II中红褐色液体加足量盐酸酸化,再加BaCl2溶液有白色沉淀,由此推断FeCl3溶液与Na2SO3溶液发生反应的离子方程式是
(3)一些弱酸的电离常数(Ka)如下表所示
| 化学式 | H2SO3 | H2CO3 | H2S |
| Kal Ka2 | 1.4×10-2 6.3×10-8 | 4.5×10-7 4.7×10-11 | 8.9×10-8 1.2×10-13 |
解释实验II和III现象不同的原因:
(4)查阅资料:FeS和Fe2S3均为难溶于水的黑色固体,其溶度积常数(Ksp)如下表:
| 化学式 | FeS | Fe(OH)3 | Fe2S3 |
| Ksp | 6.3×10-18 | 2.8×10-39 | ~10-88 |
用离子方程式解释实验IV中划线部分现象产生的原因:
(5)反思与评价:FeCl3溶液和不同的强碱弱酸盐溶液反应的多样性与
您最近一年使用:0次



