1 . 在生命体系中,铜元素也发挥着至关重要的作用。其中,双核铜物种存在于细胞色素c和N2O还原酶中。在模拟生命体系进行双核铜物种的研究中,合成得到了如图5.1所示的大环配合物A,A中铜的价态可以发生变化,对应地,整个配合物显示不同的电荷数(n=0,1,2),记作 或
或 ,其中,L代表大环配体,后一表示中分别标识出两个Cu的价态x和y,x和y可取Ⅰ或Ⅱ。A的某些形式可以与气体如CO进一步发生配合作用。A及其可能羰基衍生物可以发生电子内转移、彼此作用,也可以与其他物种之间进行氧化还原反应。
,其中,L代表大环配体,后一表示中分别标识出两个Cu的价态x和y,x和y可取Ⅰ或Ⅱ。A的某些形式可以与气体如CO进一步发生配合作用。A及其可能羰基衍生物可以发生电子内转移、彼此作用,也可以与其他物种之间进行氧化还原反应。

在DMF溶液中,对相关物种的电化学研究得到如下数据:
注:电极电势E可近似当作标准电极电势 使用。
使用。
(1)分别写出n=0,1时A的表达式 及其中金属离子的价层电子组态(用
及其中金属离子的价层电子组态(用 表示),并预测其磁性(顺磁或抗磁)。实验测得,n=2时A的磁矩为
表示),并预测其磁性(顺磁或抗磁)。实验测得,n=2时A的磁矩为 ,简述原因
,简述原因___________ 。
(2)通过计算,确定25℃下反应 平衡常数
平衡常数 =
=___________ 。
(3)通过计算,确定反应 的结合常数
的结合常数 =
=___________ 。
(4)可以形成 和
和 ,但
,但 和CO不络合,简述原因
和CO不络合,简述原因___________ 。(提示:需要考虑金属离子的价态、配位特性、配体的特点等)。
 或
或 ,其中,L代表大环配体,后一表示中分别标识出两个Cu的价态x和y,x和y可取Ⅰ或Ⅱ。A的某些形式可以与气体如CO进一步发生配合作用。A及其可能羰基衍生物可以发生电子内转移、彼此作用,也可以与其他物种之间进行氧化还原反应。
,其中,L代表大环配体,后一表示中分别标识出两个Cu的价态x和y,x和y可取Ⅰ或Ⅱ。A的某些形式可以与气体如CO进一步发生配合作用。A及其可能羰基衍生物可以发生电子内转移、彼此作用,也可以与其他物种之间进行氧化还原反应。
在DMF溶液中,对相关物种的电化学研究得到如下数据:
| 电极反应 | 电极电势E注 | 电极反应 | 电极电势E |
1) | -0.518V | 3) | -0.380V |
2) | -0.908V | 4) | -0.876V |
 使用。
使用。(1)分别写出n=0,1时A的表达式
 及其中金属离子的价层电子组态(用
及其中金属离子的价层电子组态(用 表示),并预测其磁性(顺磁或抗磁)。实验测得,n=2时A的磁矩为
表示),并预测其磁性(顺磁或抗磁)。实验测得,n=2时A的磁矩为 ,简述原因
,简述原因(2)通过计算,确定25℃下反应
 平衡常数
平衡常数 =
=(3)通过计算,确定反应
 的结合常数
的结合常数 =
=(4)可以形成
 和
和 ,但
,但 和CO不络合,简述原因
和CO不络合,简述原因
您最近一年使用:0次
2 . 塑料的发明为现代生活提供了极大的便利,但同时带来了白色污染等诸多环境问题。为了解决可回收问题,研究人员尝试将各种动态共价键作为高分子的交联剂,致力于发展“绿色”的可循环高分子经济。例如,烷基取代的三嗪衍生物中的C-O键,可被作为“休眠”的共价键交联点用于制备完全可回收的热固性聚合物。反应物A在TBD(一种胺,可作为反应的催化剂)存在下与甲醇会发生反应:
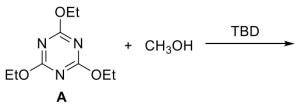
(1)通过气相色谱-质谱联用表征,检测得知反应混合物中有四个化合物,其m/z值分别为171.1,185.1,199.1和213.1。画出所得产物的结构___________ 。
(2)研究该反应的动力学,研究人员将反应物A与氘代甲醇在TBD存在下发生反应,其中氘代甲醇同时起到溶剂的作用,其密度为0.888g/mL。表征结果如图所示。确定该反应条件下的反应级数。计算至少2个温度下的反应速率常数并计算反应的活化能________ 。

(3)参照上述反应思路,研究人员设计了一种合成可回收的热固性聚合物的方法:

完成上述反应方程式___________ 。请提出一种可能的降解回收方式___________ 。

(1)通过气相色谱-质谱联用表征,检测得知反应混合物中有四个化合物,其m/z值分别为171.1,185.1,199.1和213.1。画出所得产物的结构
(2)研究该反应的动力学,研究人员将反应物A与氘代甲醇在TBD存在下发生反应,其中氘代甲醇同时起到溶剂的作用,其密度为0.888g/mL。表征结果如图所示。确定该反应条件下的反应级数。计算至少2个温度下的反应速率常数并计算反应的活化能

(3)参照上述反应思路,研究人员设计了一种合成可回收的热固性聚合物的方法:

完成上述反应方程式
您最近一年使用:0次
3 . 羟胺(H2NOH)是一种常见的化工原料,常用于农药制备。实际生产中,羟胺一般会过量加入以保证反应充分进行。因此,羟胺在废水中或多或少都会有残留。通常需要将废水中的羟胺氧化,才能再进行下一步处置。取25.00mL废水样品,加入过量Fe(III)充分反应(反应1),放出笑气,用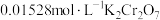 测定产生的Fe(II)(反应2),消耗14.48mL。
测定产生的Fe(II)(反应2),消耗14.48mL。
(1)写出反应1和反应2的方程式___________ 、___________ 。
(2)计算该废水样品中羟胺的浓度___________ 。( )
)
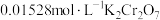 测定产生的Fe(II)(反应2),消耗14.48mL。
测定产生的Fe(II)(反应2),消耗14.48mL。(1)写出反应1和反应2的方程式
(2)计算该废水样品中羟胺的浓度
 )
)
您最近一年使用:0次
解题方法
4 . 水分解制氢是可再生能源领域的重要研究课题,其中一种非常有应用前景的方法是利用热化学循环将水分解成氢气和氧气。直接将水费解成氢气和氧气所需温度很高,利用一些具有氧化还原的物质作为介质,可以构造热化学循环,降低水分解的温度。
(1)经典的S-I循环该热化学物坏以SO2、I2为工质其中第一步反应是SO2、I2和水蒸气反应生成一种含硫的物质A和一种合碘的物质B(反应1),该反应为低温下的放热反应,取少许反应所得溶液加入BaCl2,得到白色沉淀(反应2);而后A在约900℃下发生分解生成氧气(反应3),B在约400℃下即可分解产生氢气(反应4)。反应3和反应4的其他产物可以重新与水反应,实现循环。请写出反应1~4的化学方程式并配平(反应2写离子方程式):___________ 、___________ 、___________ 、___________ 。
(2)氧化物循环体系
S-I循环虽然反应温度较低,但存在中间产物腐蚀性强、产物分离困难等问题。为此,研究者构造了基于可变价氧化物的热化学循环,示意如下(未做配平):
水分解反应:
氧化物还原反应:
(其中MOred代表低价态氧化物,MOox代表高价态氧化物)
总反应:
根据相应反应的Gibbs自由能变随温度的变化,可以判断上述两个反应发生的温度范围,遴选潜在的氧化物体系。下图为H2O、氧化物体系(1)和氧化物体系(2)的生成反应的Gibbs自由能变随温度的变化图,其中M1和M2代指的是两种不同的金属, 表示对应1molO原子(即化学反应式中O2的系数为1/2)时反应的标准Gibbs自由能变,设
表示对应1molO原子(即化学反应式中O2的系数为1/2)时反应的标准Gibbs自由能变,设 在整个温度范围内随温度呈线性变化。
在整个温度范围内随温度呈线性变化。

①从热力学上看,氧化物体系(1)和氧化物体系(2)哪一个体系更适用于热化学循环分解水___________ ?简述理由___________ 。
②对于更适用于热化学循环分解水的氧化物体系,说明发生水分解反应和氧化物还原反应对应的温度范围___________ (提示:注意看图并合理做标记,给出简要的文字说明)。
③氧化物循环体系的改进实例I
850℃下Mn3O4在Na2CO3存在下与水反应生成氢气(反应1),获得的固体产物分散在水中,通入CO2进行离子交换, 全部被
全部被 交换(反应2),而后将反应所得固体物质在850℃下加热处理再生Mn3O4(反应3)。写出反应1~3的化学方程式并配平:
交换(反应2),而后将反应所得固体物质在850℃下加热处理再生Mn3O4(反应3)。写出反应1~3的化学方程式并配平:___________ 、___________ 、___________ 。
④氧化物循环体系的改进实例II
利用金属锂及其氧化物和氢氧化物也可以构成热化学循环,有望进一步降低热化学循环的能耗。其中的一个关键步骤是加热Li2O固体,使之产生两种含锂物质,二者分别通过进一步反应产生氢气和氧气。请写出基于Li的热化学循环分解水制氢反应式并配平___________ 。
(1)经典的S-I循环该热化学物坏以SO2、I2为工质其中第一步反应是SO2、I2和水蒸气反应生成一种含硫的物质A和一种合碘的物质B(反应1),该反应为低温下的放热反应,取少许反应所得溶液加入BaCl2,得到白色沉淀(反应2);而后A在约900℃下发生分解生成氧气(反应3),B在约400℃下即可分解产生氢气(反应4)。反应3和反应4的其他产物可以重新与水反应,实现循环。请写出反应1~4的化学方程式并配平(反应2写离子方程式):
(2)氧化物循环体系
S-I循环虽然反应温度较低,但存在中间产物腐蚀性强、产物分离困难等问题。为此,研究者构造了基于可变价氧化物的热化学循环,示意如下(未做配平):
水分解反应:

氧化物还原反应:

(其中MOred代表低价态氧化物,MOox代表高价态氧化物)
总反应:

根据相应反应的Gibbs自由能变随温度的变化,可以判断上述两个反应发生的温度范围,遴选潜在的氧化物体系。下图为H2O、氧化物体系(1)和氧化物体系(2)的生成反应的Gibbs自由能变随温度的变化图,其中M1和M2代指的是两种不同的金属,
 表示对应1molO原子(即化学反应式中O2的系数为1/2)时反应的标准Gibbs自由能变,设
表示对应1molO原子(即化学反应式中O2的系数为1/2)时反应的标准Gibbs自由能变,设 在整个温度范围内随温度呈线性变化。
在整个温度范围内随温度呈线性变化。
①从热力学上看,氧化物体系(1)和氧化物体系(2)哪一个体系更适用于热化学循环分解水
②对于更适用于热化学循环分解水的氧化物体系,说明发生水分解反应和氧化物还原反应对应的温度范围
③氧化物循环体系的改进实例I
850℃下Mn3O4在Na2CO3存在下与水反应生成氢气(反应1),获得的固体产物分散在水中,通入CO2进行离子交换,
 全部被
全部被 交换(反应2),而后将反应所得固体物质在850℃下加热处理再生Mn3O4(反应3)。写出反应1~3的化学方程式并配平:
交换(反应2),而后将反应所得固体物质在850℃下加热处理再生Mn3O4(反应3)。写出反应1~3的化学方程式并配平:④氧化物循环体系的改进实例II
利用金属锂及其氧化物和氢氧化物也可以构成热化学循环,有望进一步降低热化学循环的能耗。其中的一个关键步骤是加热Li2O固体,使之产生两种含锂物质,二者分别通过进一步反应产生氢气和氧气。请写出基于Li的热化学循环分解水制氢反应式并配平
您最近一年使用:0次
解题方法
5 . 在铋系高温超导材料的探索中,得到样品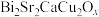 ,其中Cu可能存在的价态为+2和+3,Bi的可能价态为+3和+5.设计如下实验测定两种元素的平均氧化态。
,其中Cu可能存在的价态为+2和+3,Bi的可能价态为+3和+5.设计如下实验测定两种元素的平均氧化态。
实验A:将102.3mg样品(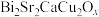 ,式量为760.4+16.00x)溶于100.0mL含有
,式量为760.4+16.00x)溶于100.0mL含有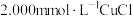 的
的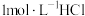 溶液中,以库仑滴定法测定过量的
溶液中,以库仑滴定法测定过量的 ,结果为0.1085mmol。
,结果为0.1085mmol。
实验B:将94.6mg样品溶解于 的酸性溶液中。以库仑滴定法测定过量的
的酸性溶液中。以库仑滴定法测定过量的 ,结果为0.0577mmol。
,结果为0.0577mmol。
(1)写出实验A中样品溶解时涉及氧化还原反应的所有方程式___________ 。
(2)写出实验B中样品溶解时涉及氧化还原反应的所有方程式___________ 。
(3)求算样品中Bi和Cu的氧化数,确定化学式中x的值___________ 。
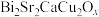 ,其中Cu可能存在的价态为+2和+3,Bi的可能价态为+3和+5.设计如下实验测定两种元素的平均氧化态。
,其中Cu可能存在的价态为+2和+3,Bi的可能价态为+3和+5.设计如下实验测定两种元素的平均氧化态。实验A:将102.3mg样品(
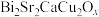 ,式量为760.4+16.00x)溶于100.0mL含有
,式量为760.4+16.00x)溶于100.0mL含有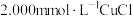 的
的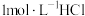 溶液中,以库仑滴定法测定过量的
溶液中,以库仑滴定法测定过量的 ,结果为0.1085mmol。
,结果为0.1085mmol。实验B:将94.6mg样品溶解于
 的酸性溶液中。以库仑滴定法测定过量的
的酸性溶液中。以库仑滴定法测定过量的 ,结果为0.0577mmol。
,结果为0.0577mmol。(1)写出实验A中样品溶解时涉及氧化还原反应的所有方程式
(2)写出实验B中样品溶解时涉及氧化还原反应的所有方程式
(3)求算样品中Bi和Cu的氧化数,确定化学式中x的值
您最近一年使用:0次
6 . 请为以下转化提供合理的中间体和过渡态结构,并根据相关过渡态的立体化学模型确定产物中手性中心的立体化学___________ 。


您最近一年使用:0次
7 . 完成下列问题。
(1)为以下转换提供关键中间体___________ 。
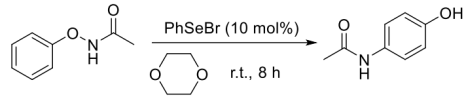
(2)依据所给信息,画出两个中间产物和最终产物的结构式___________ 、___________ ,并画出前两步转换的关键中间体___________ 。
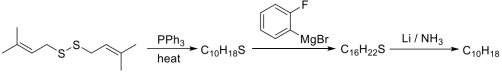
(1)为以下转换提供关键中间体

(2)依据所给信息,画出两个中间产物和最终产物的结构式

您最近一年使用:0次
8 . 含氮杂环的吖啶酮及其衍生物是一类具有重要生理活性、广泛存在与自然界中的化合物。最近,我国有机化学家发展了以下的合成方法:

为了验证该反应的转换机理,他们进行了如下的控制实验:
实验一:加入自由基抑制剂TEMPO或BHT,产物3a的产率分别为72%或75%;

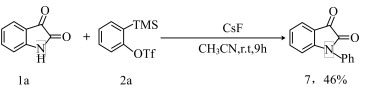
实验二:不加氧化剂过氧叔丁醇(TBHP),生成产物7:
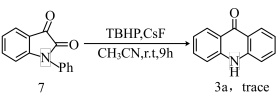
实验三:化合物7在氧化剂过氧叔丁醇作用下产生痕量的产物3a:
(1)请画出化合物1转化为化合物3的所有中间体(R=H)___________ 。
(2)按照你所提供的机理,完成以下反应式:
i.
________
ii.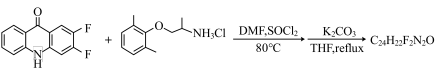
________

为了验证该反应的转换机理,他们进行了如下的控制实验:
实验一:加入自由基抑制剂TEMPO或BHT,产物3a的产率分别为72%或75%;

实验二:不加氧化剂过氧叔丁醇(TBHP),生成产物7:

实验三:化合物7在氧化剂过氧叔丁醇作用下产生痕量的产物3a:

(1)请画出化合物1转化为化合物3的所有中间体(R=H)
(2)按照你所提供的机理,完成以下反应式:
i.

ii.

您最近一年使用:0次
9 . 完成下列问题。
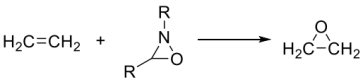
(1)画出下面反应过渡态的前线轨道示意图___________ 。
(2)试比较下列各组中两个化合物的第一电离势(IP1)大小,并简述理由。
(i) :
:___________ 。
(ii) :
:___________ 。
(iii) :
:___________ 。
(iv) :
:___________ 。
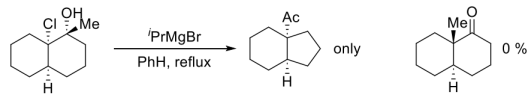
(3)为以下反应结果给出一个合适的解释(最好画出反应的过渡态)___________ 。
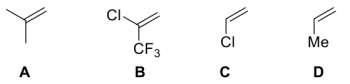
(4)下列烯烃与BH3发生硼氢化反应的速率从快到慢的排序为___________ 。
(5)下列二醇被高碘酸氧化的速率从快到慢的排序为___________ 。

(6)为什么负离子亲核试剂,例如碳负离子,在DMSO中的亲核性会显著增强___________ ?
(7)相比于四氢呋喃中,碘负离子的亲核性在甲醇中是更强还是更弱,为什么___________ ?
(1)画出下面反应过渡态的前线轨道示意图

(2)试比较下列各组中两个化合物的第一电离势(IP1)大小,并简述理由。
(i)
 :
:(ii)
 :
:(iii)
 :
:(iv)
 :
:(3)为以下反应结果给出一个合适的解释(最好画出反应的过渡态)

(4)下列烯烃与BH3发生硼氢化反应的速率从快到慢的排序为

(5)下列二醇被高碘酸氧化的速率从快到慢的排序为

(6)为什么负离子亲核试剂,例如碳负离子,在DMSO中的亲核性会显著增强
(7)相比于四氢呋喃中,碘负离子的亲核性在甲醇中是更强还是更弱,为什么
您最近一年使用:0次
解题方法
10 . 硅可以和多种金属形成组成各异、结构丰富的二元化合物。例如,在Ca-Si体系中,有Ca₅Si,Ca2Si,CaSi2,CaSi3等等。随着高压科学和技术的发展,总来越多的新物相新结构得以发现且呈现出有趣的成键特点。在20GPa条件下得到的二元Ca-Si化合物D属四方晶系,晶胞参数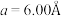 ,
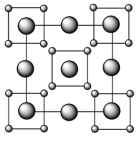
,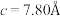 ,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表
,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表 ,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为
,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为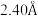 。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
(1)写出化合物D晶体的点阵型式和结构基元___________ 。(提示:注意同号电荷相斥!)
(2)若将晶胞原点取在四聚硅簇平面正方形的中心,写出晶胞中所有原子的坐标参数_______ 。
(3)写出Si的氧化数并画出四聚硅阴离子的经典Lewis结构___________ 。
(4)化学物D不稳定,大气压下可发生分解。其产物之一便是CaSi2.CaSi2也有丰富的结构,其中一种结构中,硅通过三连接方式形成二维延伸,硅只有一种化学环境且所有硅原子的价层均满足八电子。画出该结构的示意图___________ 。(要求:示出结构特征,至少包含20个硅原子,并勾勒出二维晶胞)
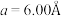 ,
,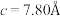 ,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表
,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表 ,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为
,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为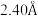 。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
(1)写出化合物D晶体的点阵型式和结构基元
(2)若将晶胞原点取在四聚硅簇平面正方形的中心,写出晶胞中所有原子的坐标参数
(3)写出Si的氧化数并画出四聚硅阴离子的经典Lewis结构
(4)化学物D不稳定,大气压下可发生分解。其产物之一便是CaSi2.CaSi2也有丰富的结构,其中一种结构中,硅通过三连接方式形成二维延伸,硅只有一种化学环境且所有硅原子的价层均满足八电子。画出该结构的示意图
您最近一年使用:0次



