解题方法
1 . 硅材料在生活中占有重要地位。请回答:
(1) 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为___________ ,分子中氮原子的杂化轨道类型是___________ 。 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是___________ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①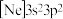 、②
、② 、③
、③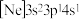 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(1)
 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是(2)由硅原子核形成的三种微粒,电子排布式分别为:①
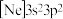 、②
、② 、③
、③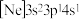 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>②>① | B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ | D.得电子能力:①>② |
您最近一年使用:0次
2 . 很多含巯基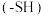 的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。___________ 。
(2)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(3)汞的原子序数为80,位于元素周期表第___________ 周期第ⅡB族
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________。
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是___________ 。
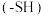 的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。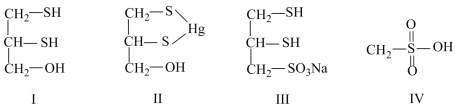
(2)H2S、CH4、H2O的沸点由高到低顺序为
(3)汞的原子序数为80,位于元素周期表第
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________。
A.在Ⅰ中 原子采取 原子采取 杂化 杂化 | B.在Ⅱ中 元素的电负性最大 元素的电负性最大 |
C.在Ⅲ中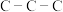 键角是180° 键角是180° | D.在Ⅲ中存在离子键与共价键 |
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是
您最近一年使用:0次
解题方法
3 . 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根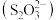 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物。
原子取代的产物。
(1)基态 原子价层电子排布式是
原子价层电子排布式是___________ 。
(2)比较 原子和O原子的第一电离能大小,从原子结构的角度说明理由:
原子和O原子的第一电离能大小,从原子结构的角度说明理由:___________ 。
(3) 的空间结构是
的空间结构是___________ 。
(4)同位素示踪实验可证实 中两个
中两个 原子的化学环境不同,实验过程为
原子的化学环境不同,实验过程为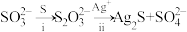 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
断裂的只有硫硫键,若过程ⅰ所用试剂是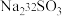 和
和 ,过程ⅱ含硫产物是
,过程ⅱ含硫产物是___________ 。
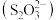 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物。
原子取代的产物。(1)基态
 原子价层电子排布式是
原子价层电子排布式是(2)比较
 原子和O原子的第一电离能大小,从原子结构的角度说明理由:
原子和O原子的第一电离能大小,从原子结构的角度说明理由:(3)
 的空间结构是
的空间结构是(4)同位素示踪实验可证实
 中两个
中两个 原子的化学环境不同,实验过程为
原子的化学环境不同,实验过程为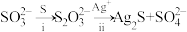 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
断裂的只有硫硫键,若过程ⅰ所用试剂是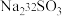 和
和 ,过程ⅱ含硫产物是
,过程ⅱ含硫产物是
您最近一年使用:0次
4 . 氮和氧是构建化合物的常见元素。
(1)下列说法正确的是___________。
(2)①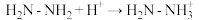 ,其中
,其中 的
的 原子杂化方式为
原子杂化方式为___________ ;比较键角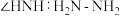 中的-NH2
中的-NH2_____ H2N-NH 中的-NH
中的-NH (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由___________ 。
②将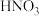 与
与 按物质的量之比
按物质的量之比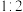 发生化合反应生成A,测得A由2种微粒构成,其中之一是
发生化合反应生成A,测得A由2种微粒构成,其中之一是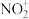 。比较氧化性强弱:NO
。比较氧化性强弱:NO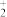
_____ HNO3(填“>”、“<”或“=”);写出A中阴离子的结构式___________ 。
已知: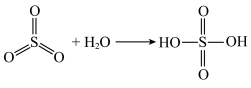
(1)下列说法正确的是___________。
A.电负性: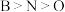 | B.离子半径: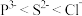 |
C.第一电离能: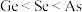 | D.基态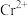 的简化电子排布式: 的简化电子排布式: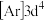 |
(2)①
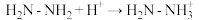 ,其中
,其中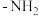 的
的 原子杂化方式为
原子杂化方式为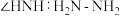 中的-NH2
中的-NH2 中的-NH
中的-NH (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
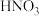 与
与 按物质的量之比
按物质的量之比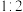 发生化合反应生成A,测得A由2种微粒构成,其中之一是
发生化合反应生成A,测得A由2种微粒构成,其中之一是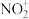 。比较氧化性强弱:NO
。比较氧化性强弱:NO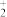
您最近一年使用:0次
真题
名校
5 . 下图所示化合物是制备某些药物的中间体,其中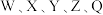 均为短周期元素,且原子序数依次增大,分子中的所有原子均满足稀有气体的稳定电子构型,Z原子的电子数是Q的一半。下列说法正确的是
均为短周期元素,且原子序数依次增大,分子中的所有原子均满足稀有气体的稳定电子构型,Z原子的电子数是Q的一半。下列说法正确的是
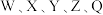 均为短周期元素,且原子序数依次增大,分子中的所有原子均满足稀有气体的稳定电子构型,Z原子的电子数是Q的一半。下列说法正确的是
均为短周期元素,且原子序数依次增大,分子中的所有原子均满足稀有气体的稳定电子构型,Z原子的电子数是Q的一半。下列说法正确的是
A.简单氢化物的稳定性: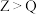 | B.第一电离能: |
C.基态原子的未成对电子数: | D.原子半径: |
您最近一年使用:0次
2024-04-07更新
|
1715次组卷
|
5卷引用:广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题
广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题2023年河北省高考化学试卷江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷 (已下线)通关练06 元素位-构-性推断-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)选择题6-10
真题
名校
6 . 下表列出25℃时不同羧酸的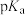 (即
(即 )。根据表中的数据推测,结论正确的是
)。根据表中的数据推测,结论正确的是
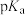 (即
(即 )。根据表中的数据推测,结论正确的是
)。根据表中的数据推测,结论正确的是| 羧酸 |  |  | 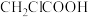 |  |
| pKa | 4.76 | 2.59 | 2.87 | 2.90 |
A.酸性强弱: |
| B.对键合电子的吸引能力强弱:F<Cl<Br |
C.25℃时的pKa大小: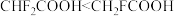 |
D.25℃时0.1mol/L溶液的碱性强弱: |
您最近一年使用:0次
2024-04-07更新
|
1051次组卷
|
4卷引用:广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题
真题
解题方法
7 . 常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国卫生组织(WTO)列为Al级高效安全消毒剂。已知,工业上制备二氧化氯的方法之一是用甲醇在酸性条件下与氯酸钠反应,其反应的化学方程式:CH3OH+6NaClO3+3H2SO4=CO2↑+6ClO2↑+3Na2SO4+5H2O,则下列说法正确的是
| A.CO2是非极性分子 |
B.键角:ClO <ClO <ClO |
| C.NaClO3在反应中做还原剂 |
| D.ClO2分子空间构型为直线形 |
您最近一年使用:0次
2024-04-07更新
|
1238次组卷
|
4卷引用:广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题
广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题2023年天津市高考化学试卷(已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)选择题1-6
8 . 近年来我国航天事业发展迅速,下列对所涉及化学知识的叙述错误的是
| A.“嫦娥五号”取回的月壤样品中含有天然玻璃物质,玻璃是晶体 |
| B.“天舟六号”壳体使用了铝合金,合金是金属材料 |
| C.“长征七号”采用了液氧煤油发动机,煤油是混合物 |
| D.“天宫”空间站新补充了一批氙推进剂,氙是稀有气体 |
您最近一年使用:0次
2024-04-07更新
|
1183次组卷
|
3卷引用:广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题
9 . 有以下物质:①石墨;②钠;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩液态氯化氢。
(1)属于非电解质的是___________ 。
(2)若④和⑤中所含氢原子数相等,则④和⑤的质量之比为___________ 。
(3)写出⑥和⑧在水溶液中的离子反应方程式___________ 。
(4)室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。
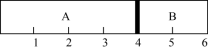
①A室混合气体所含分子总数约为___________ (填数值)。
②实验测得A室混合气体的质量为34g,则该混合气体的密度是同温同压下氢气密度的___________ 倍。
③若将A室H2、O2的混合气体点燃,恢复原温度后,最终活塞停留的位置在___________ 刻度处。
(5)在标准状况下,1L2mol/L氢氧化钠溶液中通入33.6L二氧化碳气体充分反应,所得溶液溶质的成分是___________ 。
(1)属于非电解质的是
(2)若④和⑤中所含氢原子数相等,则④和⑤的质量之比为
(3)写出⑥和⑧在水溶液中的离子反应方程式
(4)室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。

①A室混合气体所含分子总数约为
②实验测得A室混合气体的质量为34g,则该混合气体的密度是同温同压下氢气密度的
③若将A室H2、O2的混合气体点燃,恢复原温度后,最终活塞停留的位置在
(5)在标准状况下,1L2mol/L氢氧化钠溶液中通入33.6L二氧化碳气体充分反应,所得溶液溶质的成分是
您最近一年使用:0次
名校
解题方法
10 . 常温常压下,Cl2在不同溶液中的物质的量浓度c(Cl2)随溶质 M 物质的量浓度[c(M)]的变化曲线如图所示。已知c( )对c(Cl2)无影响。下列说法错误的是
)对c(Cl2)无影响。下列说法错误的是
 )对c(Cl2)无影响。下列说法错误的是
)对c(Cl2)无影响。下列说法错误的是
A.图l 说明c(Cl2)随着 c(NaCl)增大而降低,且发生反应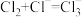 |
| B.图 l 说明在较低浓度 NaCl溶液中Cl2与水反应程度较大 |
| C.图2 说明增大c(Na⁺)和c(H⁺),c(Cl2)都将减小 |
| D.综合分析,Cl2在盐酸中的溶解度一定小于 NaCl溶液 |
您最近一年使用:0次
2023-11-17更新
|
405次组卷
|
4卷引用:广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试



