1 . 酮基布洛芬片具有镇痛、消炎及解热作用,副作用小,毒性低。其合成路线如图所示:
(1)①写出A的名称______________ 。
②写出1个A分子中含有σ键的数目______________ 。
(2)写出B→C反应的化学方程式______________ 。
(3)判断D→E的反应类型______________ 。
(4)写出E→F反应的化学方程式______________ 。
(5)以乙烯和碳酸二甲酯( )为原料(无机试剂任选),设计制备2-甲基丙酸的一种合成路线
)为原料(无机试剂任选),设计制备2-甲基丙酸的一种合成路线______________ 。

(1)①写出A的名称
②写出1个A分子中含有σ键的数目
(2)写出B→C反应的化学方程式
(3)判断D→E的反应类型
(4)写出E→F反应的化学方程式
(5)以乙烯和碳酸二甲酯(
 )为原料(无机试剂任选),设计制备2-甲基丙酸的一种合成路线
)为原料(无机试剂任选),设计制备2-甲基丙酸的一种合成路线
您最近一年使用:0次
2023-05-11更新
|
149次组卷
|
2卷引用:广东省佛山市H7教育共同体2023-2024学年高二下学期学科竞赛化学试题
2 . 有机物Ⅶ是合成新冠病毒3CLpro酶抑制剂的一种中间产物,其合成路线如下:
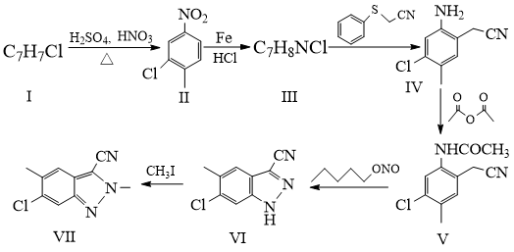
(1)化合物Ⅰ的名称为_______ 。
(2)化合物Ⅱ含有官能团_______ (写名称)。
(3)化合物Ⅱ'是化合物Ⅱ的同系物,其结构简式为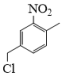 ,请根据化合物Ⅱ'的结构特点,分析预测其可能的化学性质,参考①的示例,完成下表:
,请根据化合物Ⅱ'的结构特点,分析预测其可能的化学性质,参考①的示例,完成下表:
(4)Ⅳ→Ⅴ的反应物按物质的量1:1发生反应,请写出其化学方程式:_______ 。
(5)芳香族化合物Ⅷ是化合物Ⅲ的同分异构体,且满足下列条件:
①含有-NH2结构;②苯环上含有2个取代基。
则化合物Ⅷ可能的结构有_______ 种;核磁共振氢谱图上含有4组峰的结构简式为_______ (写出其中一种即可)。
(6)以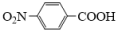 为原料,参考上述信息,写出有机物
为原料,参考上述信息,写出有机物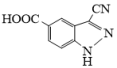 的合成路线(合成路线参照题干)
的合成路线(合成路线参照题干)_______ 。

(1)化合物Ⅰ的名称为
(2)化合物Ⅱ含有官能团
(3)化合物Ⅱ'是化合物Ⅱ的同系物,其结构简式为
 ,请根据化合物Ⅱ'的结构特点,分析预测其可能的化学性质,参考①的示例,完成下表:
,请根据化合物Ⅱ'的结构特点,分析预测其可能的化学性质,参考①的示例,完成下表:| 序号 | 结构特点 | 可反应的试剂 | 反应形成的新结构 | 反应类型 |
| ① | -NO2 | Fe、HCl | -NH2 | 还原反应 |
| ② | -CH3 | 氧化反应 | ||
| ③ |
(5)芳香族化合物Ⅷ是化合物Ⅲ的同分异构体,且满足下列条件:
①含有-NH2结构;②苯环上含有2个取代基。
则化合物Ⅷ可能的结构有
(6)以
 为原料,参考上述信息,写出有机物
为原料,参考上述信息,写出有机物 的合成路线(合成路线参照题干)
的合成路线(合成路线参照题干)
您最近一年使用:0次
2022-12-28更新
|
417次组卷
|
3卷引用:广东省普宁市勤建学校2022-2023学年高二下学期学科竞赛化学试题
广东省普宁市勤建学校2022-2023学年高二下学期学科竞赛化学试题广东省东莞市2022-2023学年高三上学期期末教学质量检查化学试题(已下线)广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(17-20)
解题方法
3 . 丰城是中国长寿之乡,位于丰城董家镇的中国生态硒谷盛产富硒大米、茶油等农产品。硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:___________ 。
(2)关于I~Ⅲ三种反应物,下列说法不正确的有___________ 。
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(3)Ⅳ中不具有孤对电子的原子是___________ 。
(4)Ca是人体中含量最高的金属元素。Se所在周期所有主族元素中第-电离能介于Ca和Se之间的元素是___________ 。
(5)已知Se和S对应的含氧酸的结构相似。分析H2SeO4的酸性强于H2SeO3的原因是______ 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。___________ 。
②设X的最简式的式量为M,晶体密度为ρg·cm-3,则X中相邻K之间的最短距离为___________ nm(列出计算式即可,NA为阿伏加德罗常数的值)。
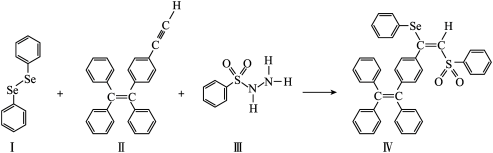
(2)关于I~Ⅲ三种反应物,下列说法不正确的有
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(3)Ⅳ中不具有孤对电子的原子是
(4)Ca是人体中含量最高的金属元素。Se所在周期所有主族元素中第-电离能介于Ca和Se之间的元素是
(5)已知Se和S对应的含氧酸的结构相似。分析H2SeO4的酸性强于H2SeO3的原因是
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
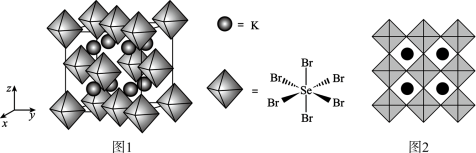
②设X的最简式的式量为M,晶体密度为ρg·cm-3,则X中相邻K之间的最短距离为
您最近一年使用:0次
2023-06-02更新
|
114次组卷
|
2卷引用:广东省佛山市H7教育共同体2023-2024学年高二下学期学科竞赛化学试题
名校
4 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: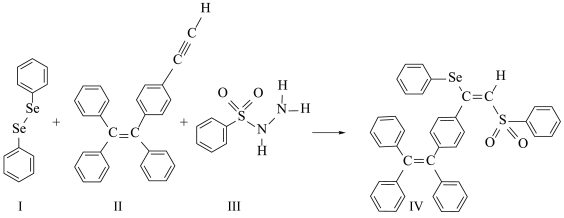
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为
您最近一年使用:0次
2022-10-08更新
|
735次组卷
|
6卷引用:广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题
解题方法
5 . 英国曼彻斯特大学科学家安德烈海姆和康斯坦丁·诺沃肖洛夫因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而荣获2010年诺贝尔物理学奖。石墨烯的结构示意如图A所示,它具有由碳原子构成的单层片状结构。请回答下列问题:

(1)石墨烯中,每个C原子采取_______ 杂化,与相邻的三个C原子以共价σ键相连接,形成平面六边形片状结构;每个C原子未参与杂化的2pz轨道都有一个单电子, 它们形成一个垂直于C原子平面的大π键,其符号为_______ (设有 n个碳原子)。如果将每对相邻原子间的化学键看成是一个化学键,则单层石墨烯内碳原子数与碳碳键数目的比是_______ 。如果选定一个六元环为起点,然后以此六元环向外延伸,分别得到1, 2, 3,…,m,则标记为m的六元环个数的通式为_______ 。
(2)通常情况下,石墨烯在水或有机溶剂中容易发生不可逆的聚集和沉淀,这限制了石墨烯的应用。因此,石墨烯的功能化应用就显得至关重要。
①在一定条件下,石墨烯与氢气充分反应后,可制得一种新型的绝缘材料,其结构如图B所示。该生成物(绝缘材料)的名称是_______ , 化学式是_______ 其生成的反应类型是_______ 。
②2011年,科学家利用如图所示合成路线在石墨烯表面制备了具有光电流响应的石墨烯光敏化的功能纳米复合材料。光电流响应时,石墨烯层的作用是_______ ,从成键方式及电子提供方式看,R基团中共价键的类型有_______ 。

(3)由于石墨烯材料的独特性质,其在电池方面显示出潜在的应用前景。如,以氧化石墨烯和金属锂为电极材料构成的表面介导电池,可使电动汽车的充电时间仅需几分钟。该电池在放电时,正极材料是_______ ,负极的电极反应式为_______ 。

(1)石墨烯中,每个C原子采取
(2)通常情况下,石墨烯在水或有机溶剂中容易发生不可逆的聚集和沉淀,这限制了石墨烯的应用。因此,石墨烯的功能化应用就显得至关重要。
①在一定条件下,石墨烯与氢气充分反应后,可制得一种新型的绝缘材料,其结构如图B所示。该生成物(绝缘材料)的名称是
②2011年,科学家利用如图所示合成路线在石墨烯表面制备了具有光电流响应的石墨烯光敏化的功能纳米复合材料。光电流响应时,石墨烯层的作用是

(3)由于石墨烯材料的独特性质,其在电池方面显示出潜在的应用前景。如,以氧化石墨烯和金属锂为电极材料构成的表面介导电池,可使电动汽车的充电时间仅需几分钟。该电池在放电时,正极材料是
您最近一年使用:0次
6 . 有机化学合成中,大环的构建是科学家们一直研究的课题,而天然的大环分子也是少之又少。其中,Jujuyane是唯一的天然八元环分子,其分子结构如图所示。A是某条Jujuyane全合成路线中的一个中间产物,下列有关说法错误的是
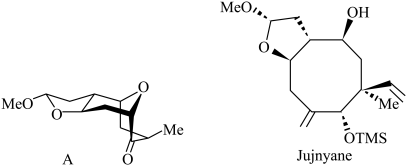

| A.Jujuyane分子中存在并环体系 | B.A的分子式为 |
| C.A分子有三种含O官能团 | D.Jujuyane分子有5个手性碳原子 |
您最近一年使用:0次
7 . nesteretal A是一种从某菌体中提取出来的笼状聚半缩酮,在2021年,化学家Yuichiro Kawamoto等人提出了nesteretal A的一种全合成路线。下面展示了该全合成路线的部分反应。
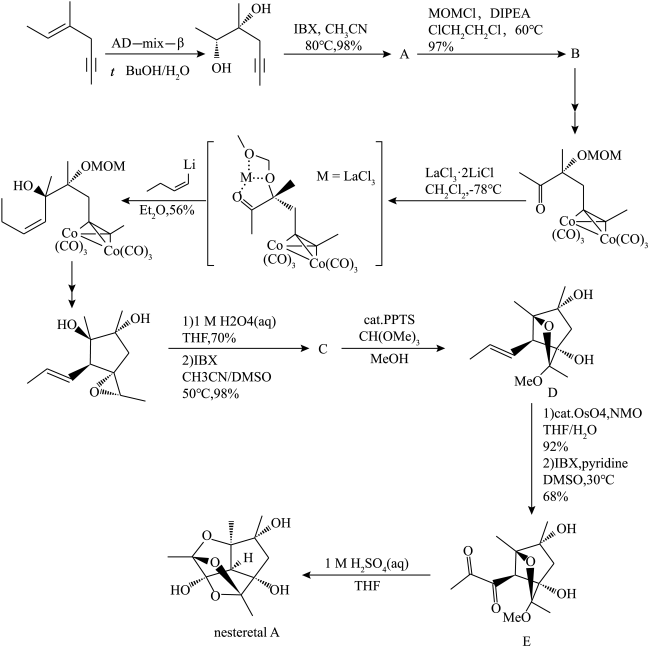
(1)已知IBX是一种氧化剂,可以将醇氧化为酮;环氧乙烷在酸性水溶液中会水解为乙二醇。请画出A、C的键线式______ 、______ 。
(2)根据前后反应,写出MOMCl的键线式______ ,并说明A到B的反应类型______ 。
(3)加入反应物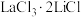 的目的是什么
的目的是什么______ ?
(4)试画出D到E的第一步反应产物的键线式______ 。(不要求立体构型)
(5)请写出nesteretal A的分子式_______ 。

(1)已知IBX是一种氧化剂,可以将醇氧化为酮;环氧乙烷在酸性水溶液中会水解为乙二醇。请画出A、C的键线式
(2)根据前后反应,写出MOMCl的键线式
(3)加入反应物
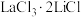 的目的是什么
的目的是什么(4)试画出D到E的第一步反应产物的键线式
(5)请写出nesteretal A的分子式
您最近一年使用:0次
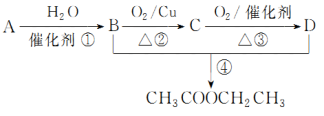
8 . 已知:①A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2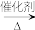 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的结构简式___________ 。
(2)B、D分子中的官能团名称分别是___________ 、___________ 。
(3)写出下列反应的反应类型:①___________ ,②___________ ,④___________ 。
(4)写出下列反应的化学方程式:②___________ ;④___________ 。
 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的结构简式
(2)B、D分子中的官能团名称分别是
(3)写出下列反应的反应类型:①
(4)写出下列反应的化学方程式:②
您最近一年使用:0次
9 . Ni-Cd蓄电池是一类重要的电池,其具有使用寿命长、放电电压稳定、机械性能好等优点,广泛应用于现代军事及航天事业等领域。其中,Ni-Cd蓄电池的正极活性物质为 。资料显示,目前T业上常用化学沉淀法和粉末金属法等方法来制备
。资料显示,目前T业上常用化学沉淀法和粉末金属法等方法来制备 。
。
Ⅰ.化学沉淀法的生产流程图如下所示:
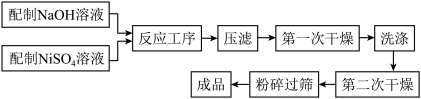
(1)写出该合成方法的化学反应方程式。_______
(2)该反应若在弱碱性条件下进行,则得到碱式硫酸盐 沉淀,请写出该化学反应方程式。
沉淀,请写出该化学反应方程式。_______
(3)在“反应工序”中, 溶液以喷淋形式加入到不断搅拌的过量的NaOH溶液中,搅拌的主要目的是什么?
溶液以喷淋形式加入到不断搅拌的过量的NaOH溶液中,搅拌的主要目的是什么?_______
(4)蒸汽干燥时,干燥温度不能超过200℃,为什么?_______
(5)“洗涤”过程的目的是洗去什么离子?可用什么溶液检验该离子是否洗净?_______
Ⅱ.粉末金属法是以粉末状金属镍为原料,通过镍粉在适当物理化学条件下的氧化水解反应来制备 。
。
(6)写出该方法的化学反应方程式。_______
(7)从动力学角度考虑,通常条件下该反应速度很小,请写出提高反应速率的方法(一条即可)。_______
 。资料显示,目前T业上常用化学沉淀法和粉末金属法等方法来制备
。资料显示,目前T业上常用化学沉淀法和粉末金属法等方法来制备 。
。Ⅰ.化学沉淀法的生产流程图如下所示:

(1)写出该合成方法的化学反应方程式。
(2)该反应若在弱碱性条件下进行,则得到碱式硫酸盐
 沉淀,请写出该化学反应方程式。
沉淀,请写出该化学反应方程式。(3)在“反应工序”中,
 溶液以喷淋形式加入到不断搅拌的过量的NaOH溶液中,搅拌的主要目的是什么?
溶液以喷淋形式加入到不断搅拌的过量的NaOH溶液中,搅拌的主要目的是什么?(4)蒸汽干燥时,干燥温度不能超过200℃,为什么?
(5)“洗涤”过程的目的是洗去什么离子?可用什么溶液检验该离子是否洗净?
Ⅱ.粉末金属法是以粉末状金属镍为原料,通过镍粉在适当物理化学条件下的氧化水解反应来制备
 。
。(6)写出该方法的化学反应方程式。
(7)从动力学角度考虑,通常条件下该反应速度很小,请写出提高反应速率的方法(一条即可)。
您最近一年使用:0次
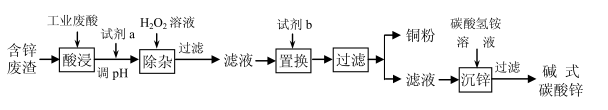
10 . 某研究小组为从一含锌废渣(质量百分组成为: 40.5% ZnO、19.8% CuO、5.7%FeO、7.3% Fe2O3、3.5% MnO,其余为SiO2等灰分)中回收锌和铜,设计出以工业废酸(含15%的H2SO4)为酸浸液的方案,其工艺流程如下图所示(部分条件略):
已知部分离子以氢氧化物形式开始沉淀及完全沉淀时的pH如下表所示:
请回答下列问题:
(1)在1.0 mol/L ZnSO4溶液中, 锌各形态浓度(以Zn2+计) 的对数(lg[c/(mol/L)]) 随溶液pH变化的关系如下图所示:

请根据图中数据计算Zn(OH)2的溶度积Ksp___________ 。
(2)写出流程图中试剂a和b的化学式___________ 。
(3)若酸浸后溶液中c(Zn2+)= 1.0 mol/L,则“调pH”时,应将溶液的pH控制在5.0~5.5,为什么___________ ?
(4)“沉锌”步骤中,要控制溶液的pH不能超过7.写出该步骤中所发生反应的离子方程式___________ ;其后“过滤”所得溶液中的主要溶质是什么___________ ?写出其化学式。
①分解温度对氧化锌催化活性影响的结果见下表:
请分析说明分解温度为800°C时所制氧化锌催化活性下降的原因___________ 。
②在 一定条件下,实验测试不同反应时间对合成DMC的影响见下表:
请分析说明反应时间对合成DMC的影响规律及其原因___________ 。

已知部分离子以氢氧化物形式开始沉淀及完全沉淀时的pH如下表所示:
| 离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀时的pH(离子初始浓度1.0mol/L) | 6.5 | 1.5 | 4.2 | 7.8 |
| 完全沉淀时的pH(离子残余浓度1.0×10-5mol/L) | 9.7 | 3.2 | 6.7 | 10.4 |
请回答下列问题:
(1)在1.0 mol/L ZnSO4溶液中, 锌各形态浓度(以Zn2+计) 的对数(lg[c/(mol/L)]) 随溶液pH变化的关系如下图所示:

请根据图中数据计算Zn(OH)2的溶度积Ksp
(2)写出流程图中试剂a和b的化学式
(3)若酸浸后溶液中c(Zn2+)= 1.0 mol/L,则“调pH”时,应将溶液的pH控制在5.0~5.5,为什么
(4)“沉锌”步骤中,要控制溶液的pH不能超过7.写出该步骤中所发生反应的离子方程式
①分解温度对氧化锌催化活性影响的结果见下表:
| 分解温度/°C | 400 | 600 | 800 |
| DMC产率1% | 1.74 | 8.09 | 3.80 |
请分析说明分解温度为800°C时所制氧化锌催化活性下降的原因
②在 一定条件下,实验测试不同反应时间对合成DMC的影响见下表:
| 反应时间/h | 6 | 8 | 10 | 12 |
| DMC产率1% | 6.02 | 10.89 | 9.85 | 6.53 |
请分析说明反应时间对合成DMC的影响规律及其原因
您最近一年使用:0次



