解题方法
1 . 硅材料在生活中占有重要地位。请回答:
(1) 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为___________ ,分子中氮原子的杂化轨道类型是___________ 。 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是___________ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①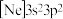 、②
、② 、③
、③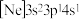 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(1)
 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是(2)由硅原子核形成的三种微粒,电子排布式分别为:①
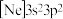 、②
、② 、③
、③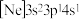 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>②>① | B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ | D.得电子能力:①>② |
您最近一年使用:0次
2 . 很多含巯基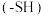 的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。___________ 。
(2)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(3)汞的原子序数为80,位于元素周期表第___________ 周期第ⅡB族
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________。
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是___________ 。
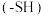 的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。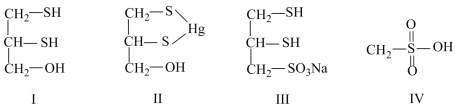
(2)H2S、CH4、H2O的沸点由高到低顺序为
(3)汞的原子序数为80,位于元素周期表第
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________。
A.在Ⅰ中 原子采取 原子采取 杂化 杂化 | B.在Ⅱ中 元素的电负性最大 元素的电负性最大 |
C.在Ⅲ中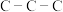 键角是180° 键角是180° | D.在Ⅲ中存在离子键与共价键 |
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是
您最近一年使用:0次
解题方法
3 . 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根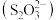 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物。
原子取代的产物。
(1)基态 原子价层电子排布式是
原子价层电子排布式是___________ 。
(2)比较 原子和O原子的第一电离能大小,从原子结构的角度说明理由:
原子和O原子的第一电离能大小,从原子结构的角度说明理由:___________ 。
(3) 的空间结构是
的空间结构是___________ 。
(4)同位素示踪实验可证实 中两个
中两个 原子的化学环境不同,实验过程为
原子的化学环境不同,实验过程为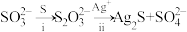 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
断裂的只有硫硫键,若过程ⅰ所用试剂是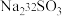 和
和 ,过程ⅱ含硫产物是
,过程ⅱ含硫产物是___________ 。
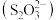 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物。
原子取代的产物。(1)基态
 原子价层电子排布式是
原子价层电子排布式是(2)比较
 原子和O原子的第一电离能大小,从原子结构的角度说明理由:
原子和O原子的第一电离能大小,从原子结构的角度说明理由:(3)
 的空间结构是
的空间结构是(4)同位素示踪实验可证实
 中两个
中两个 原子的化学环境不同,实验过程为
原子的化学环境不同,实验过程为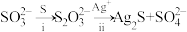 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
断裂的只有硫硫键,若过程ⅰ所用试剂是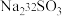 和
和 ,过程ⅱ含硫产物是
,过程ⅱ含硫产物是
您最近一年使用:0次
4 . 有以下物质:①石墨;②钠;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩液态氯化氢。
(1)属于非电解质的是___________ 。
(2)若④和⑤中所含氢原子数相等,则④和⑤的质量之比为___________ 。
(3)写出⑥和⑧在水溶液中的离子反应方程式___________ 。
(4)室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。
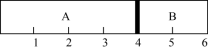
①A室混合气体所含分子总数约为___________ (填数值)。
②实验测得A室混合气体的质量为34g,则该混合气体的密度是同温同压下氢气密度的___________ 倍。
③若将A室H2、O2的混合气体点燃,恢复原温度后,最终活塞停留的位置在___________ 刻度处。
(5)在标准状况下,1L2mol/L氢氧化钠溶液中通入33.6L二氧化碳气体充分反应,所得溶液溶质的成分是___________ 。
(1)属于非电解质的是
(2)若④和⑤中所含氢原子数相等,则④和⑤的质量之比为
(3)写出⑥和⑧在水溶液中的离子反应方程式
(4)室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。

①A室混合气体所含分子总数约为
②实验测得A室混合气体的质量为34g,则该混合气体的密度是同温同压下氢气密度的
③若将A室H2、O2的混合气体点燃,恢复原温度后,最终活塞停留的位置在
(5)在标准状况下,1L2mol/L氢氧化钠溶液中通入33.6L二氧化碳气体充分反应,所得溶液溶质的成分是
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
5 . 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为_______ 。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO 存在于中性溶液中):
存在于中性溶液中):
①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_______ 。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是_______ mg·L-1。
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。
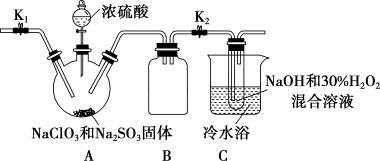
①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:_______ 。
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是_______ 。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO
 存在于中性溶液中):
存在于中性溶液中):①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。

①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是
您最近一年使用:0次
6 . 碳碳键的构建一直是有机合成中重要的一环。
Ⅰ.以下是构建碳碳键 的一种反应和其机理,其中NHC指氮杂卡宾。
的一种反应和其机理,其中NHC指氮杂卡宾。
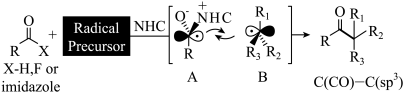
(1)该碳碳键的构建属于___________ 机理。(填字母)
a.极性 b.自由基
(2)已知两中间体A、B的构型为平面三角形,则根据杂化轨道理论,其单电子分别填在什么轨道上?_______
Ⅱ.类比该反应,广东工业大学的科研人员提出了 碳碳键的构建反应,其反应和机理如下:
碳碳键的构建反应,其反应和机理如下:
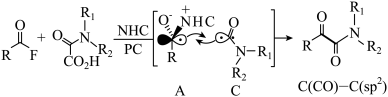
(3)已知两个中间体A、C的构型分别为平面三角形和折线型,则根据杂化轨道理论,其单电子分别填在什么轨道上?_______
Ⅲ.科研人员据此提出了以下具体反应体系:
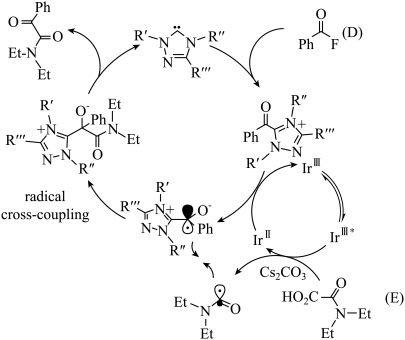
(4)写出该反应的化学方程式(无需标出反应条件)。_______
(5)该反应本质上,物质D被___________ (选填“氧化”或“还原”,下同),物质E被___________ 。
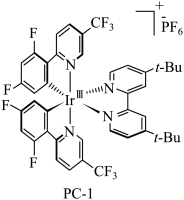
(6)其中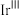 代表PC-1,可表示为
代表PC-1,可表示为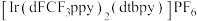 ,已知PC-1的结构如下。若以“M”代表“
,已知PC-1的结构如下。若以“M”代表“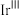 ”,“
”,“ ”代表“
”代表“ ”,“
”,“ ”代表“dtbpy”,画出PC-1的全部立体异构体。
”代表“dtbpy”,画出PC-1的全部立体异构体。_______
Ⅰ.以下是构建碳碳键
 的一种反应和其机理,其中NHC指氮杂卡宾。
的一种反应和其机理,其中NHC指氮杂卡宾。
(1)该碳碳键的构建属于
a.极性 b.自由基
(2)已知两中间体A、B的构型为平面三角形,则根据杂化轨道理论,其单电子分别填在什么轨道上?
Ⅱ.类比该反应,广东工业大学的科研人员提出了
 碳碳键的构建反应,其反应和机理如下:
碳碳键的构建反应,其反应和机理如下:
(3)已知两个中间体A、C的构型分别为平面三角形和折线型,则根据杂化轨道理论,其单电子分别填在什么轨道上?
Ⅲ.科研人员据此提出了以下具体反应体系:

(4)写出该反应的化学方程式(无需标出反应条件)。
(5)该反应本质上,物质D被
(6)其中
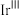 代表PC-1,可表示为
代表PC-1,可表示为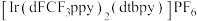 ,已知PC-1的结构如下。若以“M”代表“
,已知PC-1的结构如下。若以“M”代表“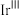 ”,“
”,“ ”代表“
”代表“ ”,“
”,“ ”代表“dtbpy”,画出PC-1的全部立体异构体。
”代表“dtbpy”,画出PC-1的全部立体异构体。
您最近一年使用:0次
7 . 已知第四周期过渡金属元素M,其六氨合M盐与氨化钾溶液在液氨中反应生成棕色非晶态的A[含三种元素,其中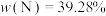 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
(1)请计算推断出M______ 、A______ 、B______ ;
(2)写出反应方程式(Ⅰ)______ 、(Ⅱ)______ 。(提示:可以从最简单的情况开始考虑)
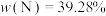 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。(1)请计算推断出M
(2)写出反应方程式(Ⅰ)
您最近一年使用:0次
8 . 分布系数的概念在分析化学中非常重要。在酸碱平衡中,分布系数指酸碱以各种形式存在的平衡浓度与其分析浓度的比值。
(1)请以H3A为例,推导出分布系数公式

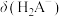
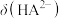
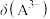
 、
、 、
、 、
、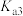 的式子表示,写出表达式即可]。
的式子表示,写出表达式即可]。(2)请用分布系数公式与电荷守恒公式,分别计算出
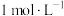 和
和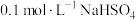 中
中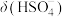 的精确值
的精确值 能否拆为H+和
能否拆为H+和
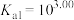 、
、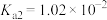 。写出计算过程)
。写出计算过程)
您最近一年使用:0次
解题方法
9 . 化学方程式书写:
(1)氧化银(Ⅰ)被过氧化氢还原______ 。
(2)四氟合金酸(Ⅲ)银遇冷水后,分解出一酸一碱一盐(盐是常见的可溶性盐)______ 。
(3)二氯亚砜与二氧化铅反应制备二氯化铅______ 。
(4)由三氟化氮、氟气及五氟化砷反应制备四氟铵盐______ 。
(5)氯化亚锡在盐酸溶液中还原氯化汞,得到抗磁性的一价汞盐沉淀和六氯合锡酸______ 。
(1)氧化银(Ⅰ)被过氧化氢还原
(2)四氟合金酸(Ⅲ)银遇冷水后,分解出一酸一碱一盐(盐是常见的可溶性盐)
(3)二氯亚砜与二氧化铅反应制备二氯化铅
(4)由三氟化氮、氟气及五氟化砷反应制备四氟铵盐
(5)氯化亚锡在盐酸溶液中还原氯化汞,得到抗磁性的一价汞盐沉淀和六氯合锡酸
您最近一年使用:0次
10 . 请根据要求填空:
(1)工业上常用Fe2+处理含Cr2O 的酸性废水,请写出该反应的离子方程式:
的酸性废水,请写出该反应的离子方程式:___________ 。
(2)实验中常用足量的氢氧化钙溶液检验CO2气体。请写出该反应的离子方程式:___________ 。
(3)黑火药是我国古代的四大发明之一、黑火药着火时,主要发生化学反应:2KNO3+S+3C=K2S+N2↑+3CO2↑。在上述反应中,被还原的元素为(填元素符号)___________ 。
(4)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆ClO2。其变化可表示为:KClO3+HCl(浓)→KCl+ClO2↑+Cl2↑+H2O
①请完成该化学方程式并配平___________ ;
②浓盐酸在反应中显示出来的性质是___________ 。标准状况下,产生33.6L的Cl2,则转移的电子的物质的量为___________ mol。
(1)工业上常用Fe2+处理含Cr2O
 的酸性废水,请写出该反应的离子方程式:
的酸性废水,请写出该反应的离子方程式:(2)实验中常用足量的氢氧化钙溶液检验CO2气体。请写出该反应的离子方程式:
(3)黑火药是我国古代的四大发明之一、黑火药着火时,主要发生化学反应:2KNO3+S+3C=K2S+N2↑+3CO2↑。在上述反应中,被还原的元素为(填元素符号)
(4)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆ClO2。其变化可表示为:KClO3+HCl(浓)→KCl+ClO2↑+Cl2↑+H2O
①请完成该化学方程式并配平
②浓盐酸在反应中显示出来的性质是
您最近一年使用:0次



