1 . 按要求回答下列问题:
(1)基态O2-核外电子排布式为_______ 。
(2)基态P原子核外电子排布式为_______ 。
(3)基态Al原子核外电子排布式为_______ 。
(4)基态As原子核外电子简化的轨道表示式为_______ 。
(5)基态Fe3+核外电子简化的轨道表示式为_______ 。
(6)基态Se原子价电子轨道表示式为_______ 。
(1)基态O2-核外电子排布式为
(2)基态P原子核外电子排布式为
(3)基态Al原子核外电子排布式为
(4)基态As原子核外电子简化的轨道表示式为
(5)基态Fe3+核外电子简化的轨道表示式为
(6)基态Se原子价电子轨道表示式为
您最近一年使用:0次
2 . 元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。
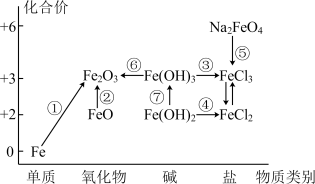
请回答一下问题:
(1) 中
中 的化合价为
的化合价为_______ 。
(2) 是否为碱性氧化物
是否为碱性氧化物_______ (填是或否),理由:_______ 。
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:_______ 。其中检验溶液中 的试剂是
的试剂是_______ 。
(4)电子工业常用 的
的 溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写出此过程的离子方程式
溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写出此过程的离子方程式_______ ;印刷电路板的废液中加入一定量铁粉,充分反应后,准备过滤并收集滤渣。此时,滤渣的成分不可能是_______ 。
aA.没有滤渣 B.有 也有
也有 C.只有
C.只有 D.只有
D.只有

请回答一下问题:
(1)
 中
中 的化合价为
的化合价为(2)
 是否为碱性氧化物
是否为碱性氧化物(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
 的试剂是
的试剂是(4)电子工业常用
 的
的 溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写出此过程的离子方程式
溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写出此过程的离子方程式aA.没有滤渣 B.有
 也有
也有 C.只有
C.只有 D.只有
D.只有
您最近一年使用:0次
解题方法
3 . 铅(Pb)及其化合物广泛用于冶金、蓄电池、印刷、颜料、油漆等领域,常见铅的化合物主要以+2价和+4价的形态存在。经查阅资料:
已知:①Pb与酸反应都得到+2价的化合物。
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因___________ 。
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式___________ 。
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和 ,反应的离子方程式为
,反应的离子方程式为 ___________ ,该反应说明PbO2具有 ___________ (填“氧化性”或“还原性”)。
(4)经查阅,PbO2是两性氧化物,设计实验并验证
| 物质 | PbO | PbO2 | PbCl2 | PbCl+4 |
| 在水中的溶解性(常温) | 难溶于水的黄色固体 | 难溶于水的棕黑色固体 | 微溶于水的白色固体 | 易溶于水的黄色油状液体 |
| 物质 | PbSO4 | Pb(NO3)2 | Na2PbO2 | Na2PbO3 |
| 在水中的溶解性(常温) | 难溶于水的白色固体 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 |
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和
 ,反应的离子方程式为
,反应的离子方程式为 (4)经查阅,PbO2是两性氧化物,设计实验并验证
| 实验步骤 | 实验现象 | 反应的化学方程式 |
| ①向盛有PbO2固体的试管中滴加NaOH溶液 | 棕黑色固体逐渐溶解 | |
| ②向盛有PbO2固体的试管中滴加稀盐酸 |
您最近一年使用:0次
名校
解题方法
4 . 汽车尾气的污染不容忽视,对汽车尾气中污染气体NO和CO的转化是研究热点。回答下列问题:
(1)汽车尾气中的CO是由于汽油在气缸内不均匀、不充分燃烧导致的,而生成NO的可能原因是____ 。
(2)利用铑催化处理汽车尾气中的NO与CO的化学反应方程式为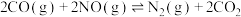
 。
。
①已知该反应的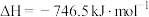 ,逆反应活化能为
,逆反应活化能为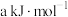 ,则其正反应活化能为
,则其正反应活化能为_____
 。
。
②一定温度下,在恒容密闭容器中充入1mol CO和1mol NO发生上述反应,部分物质的体积分数( )随时间(t)的变化如图所示。下列说法错误的是
)随时间(t)的变化如图所示。下列说法错误的是_______ (填选项字母)。
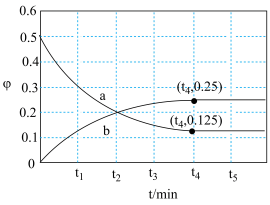
A.上述反应的正反应在高温下才能自发进行
B.曲线b表示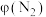 随时间的变化
随时间的变化
C.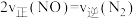 时,反应达到平衡状态
时,反应达到平衡状态
D.气体的平均相对分子质量: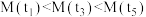
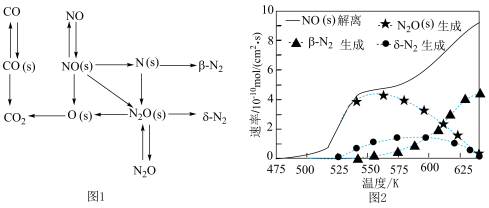
③CO还原NO的反应路径如图1所示,其中(s)指的是物质吸附在铑催化剂上,图2所示为随温度升高NO(s)的解离速率、 (s)的生成速率、
(s)的生成速率、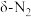 的生成速率以及
的生成速率以及 的生成速率变化曲线,根据图1可知生成
的生成速率变化曲线,根据图1可知生成 的基元反应有两个(
的基元反应有两个( 、
、 代表生成
代表生成 的两种不同路径),结合两图写出温度在550K时生成
的两种不同路径),结合两图写出温度在550K时生成 的主要基元反应方程式:
的主要基元反应方程式:_______ 。
(3)某研究小组探究催化剂对CO、NO转化率的影响。将NO和CO按物质的量之比1∶1以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:

①温度低于200℃时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是_______ 。
②a点是否为对应温度下的平衡脱氮率,说明其理由:_______ 。
③450℃时,平衡脱氮率为50%,压强恒为p,则
_______ ( 为以分压表示的平衡常数,用含p的代数式表示)。
为以分压表示的平衡常数,用含p的代数式表示)。
(1)汽车尾气中的CO是由于汽油在气缸内不均匀、不充分燃烧导致的,而生成NO的可能原因是
(2)利用铑催化处理汽车尾气中的NO与CO的化学反应方程式为
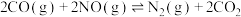
 。
。①已知该反应的
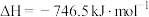 ,逆反应活化能为
,逆反应活化能为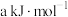 ,则其正反应活化能为
,则其正反应活化能为 。
。②一定温度下,在恒容密闭容器中充入1mol CO和1mol NO发生上述反应,部分物质的体积分数(
 )随时间(t)的变化如图所示。下列说法错误的是
)随时间(t)的变化如图所示。下列说法错误的是
A.上述反应的正反应在高温下才能自发进行
B.曲线b表示
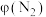 随时间的变化
随时间的变化C.
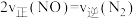 时,反应达到平衡状态
时,反应达到平衡状态D.气体的平均相对分子质量:
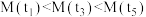
③CO还原NO的反应路径如图1所示,其中(s)指的是物质吸附在铑催化剂上,图2所示为随温度升高NO(s)的解离速率、
 (s)的生成速率、
(s)的生成速率、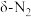 的生成速率以及
的生成速率以及 的生成速率变化曲线,根据图1可知生成
的生成速率变化曲线,根据图1可知生成 的基元反应有两个(
的基元反应有两个( 、
、 代表生成
代表生成 的两种不同路径),结合两图写出温度在550K时生成
的两种不同路径),结合两图写出温度在550K时生成 的主要基元反应方程式:
的主要基元反应方程式:
(3)某研究小组探究催化剂对CO、NO转化率的影响。将NO和CO按物质的量之比1∶1以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:

①温度低于200℃时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是
②a点是否为对应温度下的平衡脱氮率,说明其理由:
③450℃时,平衡脱氮率为50%,压强恒为p,则

 为以分压表示的平衡常数,用含p的代数式表示)。
为以分压表示的平衡常数,用含p的代数式表示)。
您最近一年使用:0次
2023-08-04更新
|
467次组卷
|
3卷引用:广东省河源市2022-2023学年高三下学期开学考试化学试题
名校
5 . 氮循环与人类生活、社会发展息息相关。回答下列问题:
(1)用化学方程式表示实验室制备 的原理:
的原理:___________ 。
(2) 是一种重要的化工原料,工业上利用
是一种重要的化工原料,工业上利用 制备
制备 的流程如图所示:
的流程如图所示:

上述反应中,气体颜色发生变化的是___________ ,反应后分子数增加的是___________ (均填序号)。
(3)在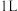 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 ,在不同温度(
,在不同温度( )下发生反应
)下发生反应 ,测得
,测得 的浓度(
的浓度( ,单位:
,单位: )随反应时间(
)随反应时间( )的变化情况如表所示:
)的变化情况如表所示:
①下列说法中,不能说明反应 达到平衡状态的是
达到平衡状态的是___________ (填标号)。
a.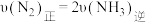 b.断裂
b.断裂 时断裂
时断裂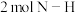
c.混合气体的密度保持不变 d.混合气体的压强保持不变
② 时,在
时,在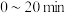 内,
内, 的平均反应速率为
的平均反应速率为___________  ,
,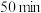 时,
时, 的转化率为
的转化率为___________ %( 的转化率是指已被转化的
的转化率是指已被转化的 的物质的量与其初始的物质的量之比)。
的物质的量与其初始的物质的量之比)。
③由表格中的数据可知, 时,反应达到平衡所需要的时间
时,反应达到平衡所需要的时间
___________ (填“ ”“
”“ ”或“
”或“ ”)
”)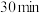 ,说明理由:
,说明理由:___________ 。
(1)用化学方程式表示实验室制备
 的原理:
的原理:(2)
 是一种重要的化工原料,工业上利用
是一种重要的化工原料,工业上利用 制备
制备 的流程如图所示:
的流程如图所示:
上述反应中,气体颜色发生变化的是
(3)在
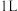 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 ,在不同温度(
,在不同温度( )下发生反应
)下发生反应 ,测得
,测得 的浓度(
的浓度( ,单位:
,单位: )随反应时间(
)随反应时间( )的变化情况如表所示:
)的变化情况如表所示:| 实验序号 |  |  | |||||
| 0 | 10 | 20 | 30 | 40 | 50 | ||
| 1 | 400 | 0 | 0.20 | 0.34 | 0.43 | 0.50 | 0.50 |
| 2 | 500 | 0 | 0.25 | 0.40 | 0.48 | 0.48 | 0.48 |
| 3 | 600 | 0 | 0.28 | 0.45 | 0.45 | ||
 达到平衡状态的是
达到平衡状态的是a.
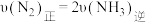 b.断裂
b.断裂 时断裂
时断裂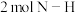
c.混合气体的密度保持不变 d.混合气体的压强保持不变
②
 时,在
时,在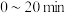 内,
内, 的平均反应速率为
的平均反应速率为 ,
,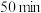 时,
时, 的转化率为
的转化率为 的转化率是指已被转化的
的转化率是指已被转化的 的物质的量与其初始的物质的量之比)。
的物质的量与其初始的物质的量之比)。③由表格中的数据可知,
 时,反应达到平衡所需要的时间
时,反应达到平衡所需要的时间
 ”“
”“ ”或“
”或“ ”)
”)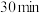 ,说明理由:
,说明理由:
您最近一年使用:0次
2023-07-09更新
|
344次组卷
|
3卷引用:广东省佛山市顺德区第一中学2023-2024学年高二上学期开学考试化学试题
6 .  时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,
_____ (填“增大”“减小”或“不变”)。
(2)用蒸馏水稀释 的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
(3)下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的是_____。
的电离程度增大,而电离平衡常数不变的是_____。
(4)依上表数据写出向NaClO溶液中通少量 的离子方程式:
的离子方程式:_____ 。
 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:| 化学式 | HClO |  |  |
| 电离平衡常数 |  |  | 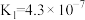 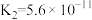 |
(1)一般情况下,当温度升高时,

(2)用蒸馏水稀释
 的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)A. | B. | C.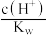 | D. |
 的电离程度增大,而电离平衡常数不变的是_____。
的电离程度增大,而电离平衡常数不变的是_____。| A.升高温度 | B.加水稀释 |
C.加少量的 固体 固体 | D.加少量氢氧化钠浓溶液 |
 的离子方程式:
的离子方程式:
您最近一年使用:0次
2023-06-24更新
|
213次组卷
|
2卷引用:广东省惠州市龙门县高级中学2021-2022学年高二下学期开学测试化学试题
名校
解题方法
7 . 元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。
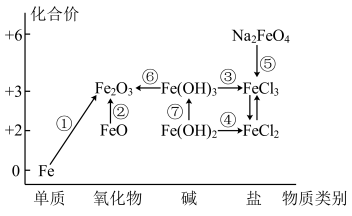
请回答以下问题:
(1)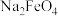 中Fe的化合价为
中Fe的化合价为_______ 。
(2) 是否为碱性氧化物
是否为碱性氧化物_______ (填是或否),理由:_______ 。
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:_______ 。
(4)已知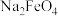 在强碱溶液中稳定存在,PH越小稳定性越差;则制备
在强碱溶液中稳定存在,PH越小稳定性越差;则制备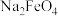 时需要在
时需要在_______ (填“酸性”“碱性”或“中性”)环境中进行: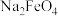 也可以作为净水剂,能与水反应生成具有吸附性的
也可以作为净水剂,能与水反应生成具有吸附性的 胶体,写出其中离子方程式:
胶体,写出其中离子方程式:_______ 。其中检验溶液中 的试剂是
的试剂是_______ 。
(5)FeO、 是合成氨工业生产中所用的
是合成氨工业生产中所用的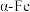 催化剂的主要成分。某FeO、
催化剂的主要成分。某FeO、 混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、
混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、 的物质的量之比为
的物质的量之比为_______ 。

请回答以下问题:
(1)
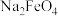 中Fe的化合价为
中Fe的化合价为(2)
 是否为碱性氧化物
是否为碱性氧化物(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(4)已知
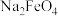 在强碱溶液中稳定存在,PH越小稳定性越差;则制备
在强碱溶液中稳定存在,PH越小稳定性越差;则制备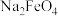 时需要在
时需要在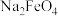 也可以作为净水剂,能与水反应生成具有吸附性的
也可以作为净水剂,能与水反应生成具有吸附性的 胶体,写出其中离子方程式:
胶体,写出其中离子方程式: 的试剂是
的试剂是(5)FeO、
 是合成氨工业生产中所用的
是合成氨工业生产中所用的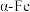 催化剂的主要成分。某FeO、
催化剂的主要成分。某FeO、 混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、
混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2023-02-26更新
|
377次组卷
|
3卷引用:广东省广州市番禺区2022-2023学年高一下学期开学统考测试化学试题
解题方法
8 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物的“价一类”二维图的部分信息如图:
(1)据图中信息,写出Y、Z的化学式:_______ 、_______ 。
(2)已知高氯酸( )是强酸,写出高氯酸溶液与氢氧化钠溶液反应的离子方程式:
)是强酸,写出高氯酸溶液与氢氧化钠溶液反应的离子方程式:_______ 。
(3)氯气既有氧化性又有还原性,结合上图说明理由:_______ 。
(4)二氧化氯( )为新时代绿色消毒剂,制备原理为:
)为新时代绿色消毒剂,制备原理为: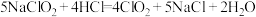
①按照物质类别对上述反应中的各物质进行分类,未涉及的物质类别是_______ (填序号)。
A.金属氧化物 B.非金属氧化物 C.酸 D.盐
② 发生还原反应的产物是
发生还原反应的产物是_______ (写化学式);该反应_______ (填“能”或“不能”)用稀硫酸代替盐酸。

(1)据图中信息,写出Y、Z的化学式:
(2)已知高氯酸(
 )是强酸,写出高氯酸溶液与氢氧化钠溶液反应的离子方程式:
)是强酸,写出高氯酸溶液与氢氧化钠溶液反应的离子方程式:(3)氯气既有氧化性又有还原性,结合上图说明理由:
(4)二氧化氯(
 )为新时代绿色消毒剂,制备原理为:
)为新时代绿色消毒剂,制备原理为: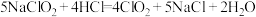
①按照物质类别对上述反应中的各物质进行分类,未涉及的物质类别是
A.金属氧化物 B.非金属氧化物 C.酸 D.盐
②
 发生还原反应的产物是
发生还原反应的产物是
您最近一年使用:0次
2023-01-04更新
|
150次组卷
|
4卷引用:广东省湛江市雷州市第二中学2023-2024学年高一下学期开学化学试题
名校
解题方法
9 . 2021年2月22日,嫦娥五号采样返回器带回的月壤公开亮相。对月壤中化学元素的分析有助于认识月球表面环境。元素周期表揭示了化学元素间的内在联系,部分元素在周期表中的位置如下:
(1)经分析,月壤中含有大量的h元素,h在周期表中的位置为______________________ 。
(2)e和f的单质都是化学家戴维通过电解的方法首次制得。这两种元素化的金属性强弱顺序为:e_______ f(填“>”或“<”),用电子式表示f与i形成离子化合物的过程________________ 。
(3)d和i两种元素的简单氢化物中,熔沸点较高的氢化物为_______ ,导致该氢化物熔沸点偏高的原因是________________________________ 。
(4)《天工开物》记载,“凡火药,以硝石、硫磺为主,草木灰为辅”,由c、d、j三种元素组成的化合物是硝石的主要成分,化学式为_______ 。
(5)i是海水中含量丰富的元素,其单质及其化合物在生产、生活领域应用广泛。在图中相应位置写出2种含i元素物质的化学式______ (要求物质类别各不相同;参照c元素形成的NO的定位及写法)。

a | |||||||||||||||||
b | c | d | |||||||||||||||
e | f | g | h | i | |||||||||||||
j |
(2)e和f的单质都是化学家戴维通过电解的方法首次制得。这两种元素化的金属性强弱顺序为:e
(3)d和i两种元素的简单氢化物中,熔沸点较高的氢化物为
(4)《天工开物》记载,“凡火药,以硝石、硫磺为主,草木灰为辅”,由c、d、j三种元素组成的化合物是硝石的主要成分,化学式为
(5)i是海水中含量丰富的元素,其单质及其化合物在生产、生活领域应用广泛。在图中相应位置写出2种含i元素物质的化学式

您最近一年使用:0次
名校
10 . 氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应的是__________ (填字母)。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)氧化剂过氧化氢(H2O2)在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
①保存过氧化氢的试剂瓶上最适合贴上的一个标签是__________ (填标号)。
A. B.
B. C.
C. D.
D.
②油画中铅白(碱式碳酸铅)与空气中的硫化氢反应生成硫化氢,可H2O2洗涤,发生反应为:PbS+4H2O2=PbSO4+4H2O,则处理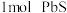 转移电子的物质的量是
转移电子的物质的量是________ 。
③ 向橙红色K2Cr2O7溶液中加入硫酸酸化,再加入足量H2O2,溶液变为蓝色[Cr2(SO4)3],则上述反应中Cr元素化合价______ (填“升高”“降低”或“不变”),H2O2作_______ 剂(填 “氧化”或“还原”),。
(3)某反应体系中有H2O、ClO-、NH 、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式
、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式________________________ 。

(1)下列表述中没有氧化还原反应的是
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)氧化剂过氧化氢(H2O2)在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
①保存过氧化氢的试剂瓶上最适合贴上的一个标签是
A.
 B.
B. C.
C. D.
D.
②油画中铅白(碱式碳酸铅)与空气中的硫化氢反应生成硫化氢,可H2O2洗涤,发生反应为:PbS+4H2O2=PbSO4+4H2O,则处理
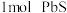 转移电子的物质的量是
转移电子的物质的量是③ 向橙红色K2Cr2O7溶液中加入硫酸酸化,再加入足量H2O2,溶液变为蓝色[Cr2(SO4)3],则上述反应中Cr元素化合价
(3)某反应体系中有H2O、ClO-、NH
 、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式
、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式
您最近一年使用:0次



