解题方法
1 . 钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。
① 是助氧化剂,可处理产生的Na,其中氯元素的化合价是
是助氧化剂,可处理产生的Na,其中氯元素的化合价是___________ 。
② 是主氧化剂,也可处理产生的Na,反应为
是主氧化剂,也可处理产生的Na,反应为 ,反应中
,反应中 是
是___________ (填“还原产物”或“氧化产物”)。
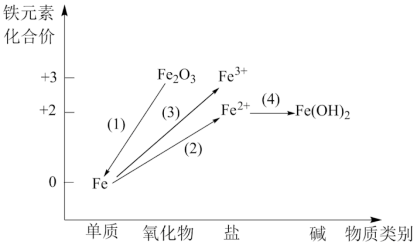
(2)铁及其重要化合物之间的部分转化关系如图所示。___________ (填序号);
a.金红石(TiO2) b.赤铁矿(Fe2O3) c.辉铜矿(Cu2S)
②实现Fe转化为Fe2+可选用足量的___________ (填序号);
a.稀盐酸 b.氢氧化钠溶液 c.稀硝酸
③在点燃的条件下,Fe与足量Cl2剧烈反应后,将产物溶于水,再滴加KSCN溶液,则溶液变为血红色,证明产物为FeCl3,写出氯气和铁反应的化学方程式为___________ 。
④在FeSO4中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为___________ ,此过程中发生的氧化还原反应为(用化学方程式表达)___________ 。
(1)某汽车安全气囊的产气药剂主要含有
 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。①
 是助氧化剂,可处理产生的Na,其中氯元素的化合价是
是助氧化剂,可处理产生的Na,其中氯元素的化合价是②
 是主氧化剂,也可处理产生的Na,反应为
是主氧化剂,也可处理产生的Na,反应为 ,反应中
,反应中 是
是(2)铁及其重要化合物之间的部分转化关系如图所示。
a.金红石(TiO2) b.赤铁矿(Fe2O3) c.辉铜矿(Cu2S)
②实现Fe转化为Fe2+可选用足量的
a.稀盐酸 b.氢氧化钠溶液 c.稀硝酸
③在点燃的条件下,Fe与足量Cl2剧烈反应后,将产物溶于水,再滴加KSCN溶液,则溶液变为血红色,证明产物为FeCl3,写出氯气和铁反应的化学方程式为
④在FeSO4中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为
您最近一年使用:0次
名校
2 . I.请用下列10种物质的序号填空。
①N2 ②NH4Cl ③RbOH ④ ⑤ KCl ⑥
⑤ KCl ⑥ ⑦
⑦ ⑧H2SO4 ⑨
⑧H2SO4 ⑨ ⑩氦气
⑩氦气
(1)既含离子键又含共价键的是___________ ;只含共价键的的是___________ ;④的电子式为___________ ;⑦的空间构型为:___________ 。
II.下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
针对元素①~⑭回答下列问题。
(2)i.⑪~⑭元素的非金属性由强到弱的顺序为:___________ (填元素符号)。
ii.能作为卤素非金属性递变规律的判断依据的是:___________ 。
A.⑪~⑭元素形成的单质熔点逐渐升高
B.⑪~⑭元素形成的简单离子还原性逐渐增强
C.⑪~⑭元素形成的气态氢化物稳定性逐渐减弱
D.⑪~⑭元素形成的无氧酸酸性逐渐增强
iii.从原子结构角度解释卤素非金属性递变的原因___________ 。
(3)下列关于②~⑤元素叙述正确的是___________。
(4)③⑧⑩元素最高价氧化物对应的水化物之间可以两两发生反应,其中能体现水化物呈“两性”的离子方程式分别为___________ 、___________ 。
(5)上述元素形成的最高价氧化物的水化物中酸性最强的是___________ (用化学式表示)。
(6)元素④⑦⑩⑫对应的具有稳定结构的简单离子的半径由大到小的排序为___________ (用相应的离子符号排序)。
(7)用电子式表示①和⑦形成化合物的过程___________ ,该化合物与水反应的化学方程式是___________ 。
①N2 ②NH4Cl ③RbOH ④
 ⑤ KCl ⑥
⑤ KCl ⑥ ⑦
⑦ ⑧H2SO4 ⑨
⑧H2SO4 ⑨ ⑩氦气
⑩氦气(1)既含离子键又含共价键的是
II.下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
| 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ⑨ | ⑪ | |||||
| 3 | ③ | ⑥ | ⑧ | ⑩ | ⑫ | |||
| 4 | ④ | ⑦ | ⑬ | |||||
| 5 | ⑤ | ⑭ |
(2)i.⑪~⑭元素的非金属性由强到弱的顺序为:
ii.能作为卤素非金属性递变规律的判断依据的是:
A.⑪~⑭元素形成的单质熔点逐渐升高
B.⑪~⑭元素形成的简单离子还原性逐渐增强
C.⑪~⑭元素形成的气态氢化物稳定性逐渐减弱
D.⑪~⑭元素形成的无氧酸酸性逐渐增强
iii.从原子结构角度解释卤素非金属性递变的原因
(3)下列关于②~⑤元素叙述正确的是___________。
| A.从上到下②~⑤单质与水反应越来越剧烈 |
| B.②~⑤单质与氧气反应均可生成过氧化物 |
| C.从上到下②~⑤单质熔沸点逐渐升高 |
| D.②~⑤元素的最高价氧化物的水化物碱性增强 |
(5)上述元素形成的最高价氧化物的水化物中酸性最强的是
(6)元素④⑦⑩⑫对应的具有稳定结构的简单离子的半径由大到小的排序为
(7)用电子式表示①和⑦形成化合物的过程
您最近一年使用:0次
名校
解题方法
3 . “化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。根据所学知识,回答下列问题:
(1)沾有水的铁锅在高温火焰上灼烧会发黑,该反应的化学方程式为___________ 。
(2)食用加碘食盐能消除碘缺乏病的困扰,碘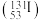 的质量数是
的质量数是___________ 。
(3)臭氧、“84”消毒液、二氧化氯、高铁酸钠等都是生活中常见的消毒剂。
①臭氧和氧气互为___________ (填“同位素”或“同素异形体”)。
②生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是___________ 。
③ 是一种新型含氯消毒剂,在自来水消毒领域已经开始使用。实验室可通过反应
是一种新型含氯消毒剂,在自来水消毒领域已经开始使用。实验室可通过反应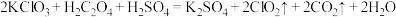 制得
制得 。该反应中产生
。该反应中产生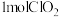 时,转移的电子的物质的量为
时,转移的电子的物质的量为___________ 。
④高铁酸钠 还是一种新型的净水剂。其净水过程中所发生的化学反应主要为
还是一种新型的净水剂。其净水过程中所发生的化学反应主要为 (胶体)
(胶体)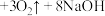 ,证明有
,证明有 胶体生成的实验操作为
胶体生成的实验操作为___________ 。
(4)汽车安全气囊弹出时发生反应: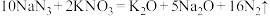 ,该反应中被氧化的N与被还原的N的物质的量之比为
,该反应中被氧化的N与被还原的N的物质的量之比为___________ 。
(5)铝制器具不宜盛放碱性食物,请写出铝与 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
(1)沾有水的铁锅在高温火焰上灼烧会发黑,该反应的化学方程式为
(2)食用加碘食盐能消除碘缺乏病的困扰,碘
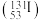 的质量数是
的质量数是(3)臭氧、“84”消毒液、二氧化氯、高铁酸钠等都是生活中常见的消毒剂。
①臭氧和氧气互为
②生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是
③
 是一种新型含氯消毒剂,在自来水消毒领域已经开始使用。实验室可通过反应
是一种新型含氯消毒剂,在自来水消毒领域已经开始使用。实验室可通过反应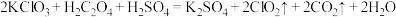 制得
制得 。该反应中产生
。该反应中产生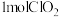 时,转移的电子的物质的量为
时,转移的电子的物质的量为④高铁酸钠
 还是一种新型的净水剂。其净水过程中所发生的化学反应主要为
还是一种新型的净水剂。其净水过程中所发生的化学反应主要为 (胶体)
(胶体)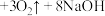 ,证明有
,证明有 胶体生成的实验操作为
胶体生成的实验操作为(4)汽车安全气囊弹出时发生反应:
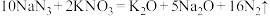 ,该反应中被氧化的N与被还原的N的物质的量之比为
,该反应中被氧化的N与被还原的N的物质的量之比为(5)铝制器具不宜盛放碱性食物,请写出铝与
 溶液反应的离子方程式:
溶液反应的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . 填空题
(一)某同学欲验证 与
与 的金属性强弱,设计实验如下:
的金属性强弱,设计实验如下:
依据上述实验设计,回答下列问题:
(1)铝元素在周期表中的位置为第______ 周期______ 族;
(2)上述实验试管 中的实验现象为
中的实验现象为_________________________ ;
(3)写出试管 中白色沉淀溶解的离子反应方程式
中白色沉淀溶解的离子反应方程式______________________ ;
(4)上述实验现象证明碱性:
______  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(二)某同学欲验证 、
、 、
、 的氧化性强弱,实验操作如下:
的氧化性强弱,实验操作如下:
Ⅰ.向盛有 和
和 混合液的试管
混合液的试管 中通入少量氯气,振荡观察;
中通入少量氯气,振荡观察;
Ⅱ.向盛有淀粉 混合液的试管
混合液的试管 中加入少量
中加入少量 溶液,振荡观察;
溶液,振荡观察;
(5) 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为____________
(6)试管 中通入少量氯气后的实验现象是
中通入少量氯气后的实验现象是______________________________
(7)写出试管 中发生的离子反应
中发生的离子反应______________________________
(一)某同学欲验证
 与
与 的金属性强弱,设计实验如下:
的金属性强弱,设计实验如下:实验操作 | 实验现象 | 反应或结论 |
Ⅰ.向试管 | ① |
|
Ⅱ.向试管 | 试管中先出现白色沉淀,后白色沉淀溶解 | ② |
(1)铝元素在周期表中的位置为第
(2)上述实验试管
 中的实验现象为
中的实验现象为(3)写出试管
 中白色沉淀溶解的离子反应方程式
中白色沉淀溶解的离子反应方程式(4)上述实验现象证明碱性:

 (填“>”“<”或“=”)
(填“>”“<”或“=”) (二)某同学欲验证
 、
、 、
、 的氧化性强弱,实验操作如下:
的氧化性强弱,实验操作如下:Ⅰ.向盛有
 和
和 混合液的试管
混合液的试管 中通入少量氯气,振荡观察;
中通入少量氯气,振荡观察;Ⅱ.向盛有淀粉
 混合液的试管
混合液的试管 中加入少量
中加入少量 溶液,振荡观察;
溶液,振荡观察;(5)
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(6)试管
 中通入少量氯气后的实验现象是
中通入少量氯气后的实验现象是(7)写出试管
 中发生的离子反应
中发生的离子反应
您最近一年使用:0次
5 . 我国硒储量居世界首位,硒广泛用于冶金、陶瓷、电子、太阳能等领域。工业上常将含硒废料处理得到亚硒酸( )和硒酸(
)和硒酸(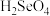 ),进而制备单质硒。
),进而制备单质硒。
(1)基态硒原子核外电子的空间运动状态有________ 种。
(2)甲硒醇(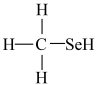 )的熔沸点低于甲醇(
)的熔沸点低于甲醇(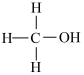 ),原因是
),原因是________________ 。
(3) 亚硒酸溶液中含硒微粒的分布系数
亚硒酸溶液中含硒微粒的分布系数 与溶液
与溶液 的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
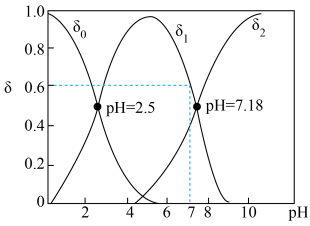
①曲线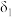 表示的含硒微粒是
表示的含硒微粒是________ 。
②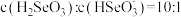 ,溶液
,溶液
________ 。
③向溶液中滴入氨水, 由5.5增大到7.3的过程中,主要反应的离子方程式为
由5.5增大到7.3的过程中,主要反应的离子方程式为________________ , 时,溶液中
时,溶液中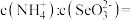
_______ 。
④在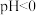 的酸性环境下,向溶液中通入
的酸性环境下,向溶液中通入 制得单质
制得单质 的离子方程式为
的离子方程式为________________ 。
(4) 可以用于测定粗硒中硒的含量,操作步骤如下:
可以用于测定粗硒中硒的含量,操作步骤如下:
Ⅰ.用浓 将样品中的
将样品中的 氧化为
氧化为 ;
;
Ⅱ.用 溶液还原
溶液还原 为
为 ,同时生成
,同时生成 ;
;
Ⅲ.以淀粉为指示剂,用 标准溶液滴定Ⅱ中生成的
标准溶液滴定Ⅱ中生成的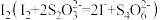 。
。
实验中准确称量 粗硒样品,滴定中消耗
粗硒样品,滴定中消耗 的
的 标准溶液
标准溶液 。
。
①滴定终点的现象为________ 。
②粗硒样品中硒的质量分数为________ 。
 )和硒酸(
)和硒酸(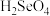 ),进而制备单质硒。
),进而制备单质硒。(1)基态硒原子核外电子的空间运动状态有
(2)甲硒醇(
 )的熔沸点低于甲醇(
)的熔沸点低于甲醇( ),原因是
),原因是(3)
 亚硒酸溶液中含硒微粒的分布系数
亚硒酸溶液中含硒微粒的分布系数 与溶液
与溶液 的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
①曲线
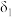 表示的含硒微粒是
表示的含硒微粒是②
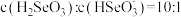 ,溶液
,溶液
③向溶液中滴入氨水,
 由5.5增大到7.3的过程中,主要反应的离子方程式为
由5.5增大到7.3的过程中,主要反应的离子方程式为 时,溶液中
时,溶液中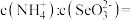
④在
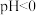 的酸性环境下,向溶液中通入
的酸性环境下,向溶液中通入 制得单质
制得单质 的离子方程式为
的离子方程式为(4)
 可以用于测定粗硒中硒的含量,操作步骤如下:
可以用于测定粗硒中硒的含量,操作步骤如下:Ⅰ.用浓
 将样品中的
将样品中的 氧化为
氧化为 ;
; Ⅱ.用
 溶液还原
溶液还原 为
为 ,同时生成
,同时生成 ;
;Ⅲ.以淀粉为指示剂,用
 标准溶液滴定Ⅱ中生成的
标准溶液滴定Ⅱ中生成的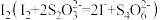 。
。实验中准确称量
 粗硒样品,滴定中消耗
粗硒样品,滴定中消耗 的
的 标准溶液
标准溶液 。
。①滴定终点的现象为
②粗硒样品中硒的质量分数为
您最近一年使用:0次
6 . 书写下列反应的离子方程式。
(1)向澄清石灰水中通入少量二氧化碳气体:___________ 。
(2)氢氧化钡溶液中加入稀硫酸:___________ 。
(3)铝和氢氧化钠溶液反应:___________ 。
(4)氯气使湿润的淀粉碘化钾试纸变蓝:___________ 。
(5) 溶于过量稀硝酸的离子方程式(已知还原产物是
溶于过量稀硝酸的离子方程式(已知还原产物是 气体):
气体):___________ 。
(1)向澄清石灰水中通入少量二氧化碳气体:
(2)氢氧化钡溶液中加入稀硫酸:
(3)铝和氢氧化钠溶液反应:
(4)氯气使湿润的淀粉碘化钾试纸变蓝:
(5)
 溶于过量稀硝酸的离子方程式(已知还原产物是
溶于过量稀硝酸的离子方程式(已知还原产物是 气体):
气体):
您最近一年使用:0次
23-24高二上·广东深圳·期末
名校
7 . 根据所学知识,回答下列问题:
(1)Cu的简化电子排布式为___________ 。Fe2+的价电子轨道表示式为___________ 。
(2)乙炔分子中σ键与π键个数之比为___________ 。
(3)吡啶( )是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的
)是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的 大π键,由此可知,吡啶中N原子的价层孤电子对占据
大π键,由此可知,吡啶中N原子的价层孤电子对占据___________ 轨道。
(4)NH3、PH3、AsH3按照沸点由高到低排序,依次为___________ 。
(5)BF3、SiF4、NF3按照键角由大到小排序,依次为___________ 。
(6)科学家合成了一种新型离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,该物质遇水会发生水解,生成一种一元弱碱和一种单质气体。该反应的化学方程式为___________ 。
(1)Cu的简化电子排布式为
(2)乙炔分子中σ键与π键个数之比为
(3)吡啶(
 )是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的
)是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的 大π键,由此可知,吡啶中N原子的价层孤电子对占据
大π键,由此可知,吡啶中N原子的价层孤电子对占据(4)NH3、PH3、AsH3按照沸点由高到低排序,依次为
(5)BF3、SiF4、NF3按照键角由大到小排序,依次为
(6)科学家合成了一种新型离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,该物质遇水会发生水解,生成一种一元弱碱和一种单质气体。该反应的化学方程式为
您最近一年使用:0次
2024-02-24更新
|
608次组卷
|
4卷引用:广东省深圳中学2023-2024学年高二上学期期末考试化学试题
(已下线)广东省深圳中学2023-2024学年高二上学期期末考试化学试题(已下线)广东省深圳市深圳中学2023-2024学年高二上学期期末考试化学试题广东省潮州市饶平县第二中学2023-2024学年高二下学期第一次月考化学试题名校期末好题汇编-分子结构与性质(非选择题)
名校
解题方法
8 . 碳元素可以形成数量丰富的化合物,如 与
与 等氧化物,
等氧化物, 等无机弱酸及其盐。回答下列问题:
等无机弱酸及其盐。回答下列问题:
(1) 的结构式为
的结构式为___________ 。
(2)氢氰酸的钾盐 在电镀工业中有重要应用,其水溶液呈碱性。用离子方程式解释
在电镀工业中有重要应用,其水溶液呈碱性。用离子方程式解释 水溶液显碱性的原因是
水溶液显碱性的原因是___________ 。
(3)人体内草酸累积过多容易导致结石,其主要成分是草酸钙 ,草酸钙在水中的沉淀溶解平衡可表示为
,草酸钙在水中的沉淀溶解平衡可表示为___________ 。
(4)已知 时,
时, 的电离平衡常数如下表。
的电离平衡常数如下表。
① 时,某
时,某 溶液的
溶液的 ,关于此溶液中的微粒浓度,下列说法正确的是
,关于此溶液中的微粒浓度,下列说法正确的是________ 。
A.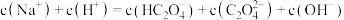
B.
C.
② 时,将
时,将 溶液和
溶液和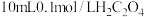 溶液混合并充分反应,所得溶液呈
溶液混合并充分反应,所得溶液呈___________ (选填“酸性”、“中性”或“碱性”)。
③将少量 溶液加入
溶液加入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为___________ 。
(5) 电池可以实现对
电池可以实现对 的利用,该类电池放电的反应方程式为:
的利用,该类电池放电的反应方程式为: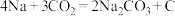 。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式___________ 。

 与
与 等氧化物,
等氧化物, 等无机弱酸及其盐。回答下列问题:
等无机弱酸及其盐。回答下列问题:(1)
 的结构式为
的结构式为(2)氢氰酸的钾盐
 在电镀工业中有重要应用,其水溶液呈碱性。用离子方程式解释
在电镀工业中有重要应用,其水溶液呈碱性。用离子方程式解释 水溶液显碱性的原因是
水溶液显碱性的原因是(3)人体内草酸累积过多容易导致结石,其主要成分是草酸钙
 ,草酸钙在水中的沉淀溶解平衡可表示为
,草酸钙在水中的沉淀溶解平衡可表示为(4)已知
 时,
时, 的电离平衡常数如下表。
的电离平衡常数如下表。 |  |  | |
 | 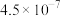 |  | 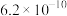 |
 | 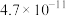 | 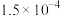 | 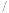 |
 时,某
时,某 溶液的
溶液的 ,关于此溶液中的微粒浓度,下列说法正确的是
,关于此溶液中的微粒浓度,下列说法正确的是A.
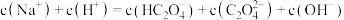
B.

C.

②
 时,将
时,将 溶液和
溶液和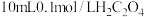 溶液混合并充分反应,所得溶液呈
溶液混合并充分反应,所得溶液呈③将少量
 溶液加入
溶液加入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为(5)
 电池可以实现对
电池可以实现对 的利用,该类电池放电的反应方程式为:
的利用,该类电池放电的反应方程式为: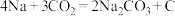 。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
您最近一年使用:0次
名校
解题方法
9 . 如图为元素周期表的一部分,请根据元素①~⑧在表中的位置,回答下列问题:

(1)请写出元素⑦在元素周期表中的位置___________ 。在上述元素的最高价氧化物对应的水化物中,酸性最强的是___________ (用化学式表示)。
(2)由元素①、④、⑤形成的化合物的电子式为___________ ,该物质属于___________ (填“离子”或“共价”)化合物。
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)在发生地震后,地震灾区需要大量的“84消毒液”来消毒杀菌。84消毒液(主要成分为NaClO)和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发生反应的离子方程式:___________ 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
若A、B、C含同一金属元素,X为电解质溶液,可电离出 ,所有反应都在溶液中进行。B的化学式为
,所有反应都在溶液中进行。B的化学式为___________ ,X的化学式为___________ 。

(1)请写出元素⑦在元素周期表中的位置
(2)由元素①、④、⑤形成的化合物的电子式为
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是
(4)在发生地震后,地震灾区需要大量的“84消毒液”来消毒杀菌。84消毒液(主要成分为NaClO)和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发生反应的离子方程式:
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:

若A、B、C含同一金属元素,X为电解质溶液,可电离出
 ,所有反应都在溶液中进行。B的化学式为
,所有反应都在溶液中进行。B的化学式为
您最近一年使用:0次
10 . 2021年10月16日,神舟十三号载人飞船与“天和”核心舱成功径向交会对接。化学助力我国航天事业发展,借助元素周期表可以认识各种材料的组成、结构和性质。a~h8种元素在元素周期表中的位置如下:
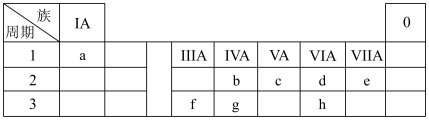
(1)a的单质常用作火箭推进剂,该过程中a单质对应的产物为_______ (填化学式)。
(2)g单质在太阳能电池和芯片制造等领域有着重要应用,g最高价氧化物的化学式为_______ ;b的氧化物含有的化学键类型为_______ 。
(3)飞船的制造使用了f的合金,f的简单离子结构示意图为_______ ,比较f和g原子半径大小:f_______ (填“>”“<”或“=”)g。
(4)请写出b与足量d完全反应生成的化合物的电子式:_______ 。元素c与元素e所形成的简单氢化物的稳定性大小:c_______ (填“>”“<”或“=”)e。

(1)a的单质常用作火箭推进剂,该过程中a单质对应的产物为
(2)g单质在太阳能电池和芯片制造等领域有着重要应用,g最高价氧化物的化学式为
(3)飞船的制造使用了f的合金,f的简单离子结构示意图为
(4)请写出b与足量d完全反应生成的化合物的电子式:
您最近一年使用:0次

 溶液,再逐滴滴入
溶液,再逐滴滴入 溶液,再逐滴滴入
溶液,再逐滴滴入

