23-24高一下·全国·期末
1 . 回答下列问题:
(1)用20% H2SO4浸取软锰矿(主要成分为MnO2、SiO2等)制备高纯MnO2,酸浸时,通常加入FeSO4作催化剂加快反应速率。为提高酸浸速率,还可以采取的措施有______________ (写一种)。
(2)工业上用稀硫酸浸取碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)生产锰酸锂(LiMn2O4),为了提高碳酸锰矿浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_______________ 等。
(3)用NaOH熔盐高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)制备白色颜料TiO2,为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是________________ 。
(1)用20% H2SO4浸取软锰矿(主要成分为MnO2、SiO2等)制备高纯MnO2,酸浸时,通常加入FeSO4作催化剂加快反应速率。为提高酸浸速率,还可以采取的措施有
(2)工业上用稀硫酸浸取碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)生产锰酸锂(LiMn2O4),为了提高碳酸锰矿浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③
(3)用NaOH熔盐高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)制备白色颜料TiO2,为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是
您最近一年使用:0次
2 . 物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第三周期元素I1变化规律如图所示,第三周期元素中I1处于Al与P之间的元素符号是___________ 。___________ 。
(3)已知固态HF、H2O、NH3的氢键键能和结构如下:
___________ 个水分子包围形成___________ 构型。
(4)碳化硅的结构与金刚石类似(如图所示),其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________ 个。
(1)第三周期元素I1变化规律如图所示,第三周期元素中I1处于Al与P之间的元素符号是

(3)已知固态HF、H2O、NH3的氢键键能和结构如下:
| 物质 | 氢键X-H···Y | 氢键键能kJ·mol-1 |
| (HF)n | F-H···F | 28.1 |
| 冰 | O-H···O | 18.8 |
| (NH3)n | N-H···N | 5.4 |

(4)碳化硅的结构与金刚石类似(如图所示),其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有

您最近一年使用:0次
23-24高二下·全国·期末
解题方法
3 . 已知某些共价键的键能、键长数据如表所示:
(1)下列推断正确的是___________(填字母,下同)。
(2)在HX(X=F、Cl、Br、I)分子中,键长最短的是___________ ,最长的是___________ ;O—O的键长___________ (填“大于”“小于”或“等于”)O=O的键长。
| 共价键 | Cl—Cl | Br—Br | I—I | H—F | H—Cl | H—Br | H—I | H—O |
| 键能/(kJ·mol-1) | 242.7 | 193.7 | 152.7 | 568 | 431.8 | 366 | 298.7 | 462.8 |
| 键长/pm | 198 | 228 | 267 | 96 | ||||
| 共价键 | C—C | C=C | C≡C | C—H | N—H | N=O | O—O | O=O |
| 键能/(kJ·mol-1) | 347.7 | 615 | 812 | 413.4 | 390.8 | 607 | 142 | 497.3 |
| 键长/pm | 154 | 133 | 120 | 109 | 101 |
| A.热稳定性:HF>HCl>HBr>HI |
| B.氧化性:I2>Br2>Cl2 |
| C.沸点:H2O>NH3 |
| D.还原性:HI>HBr>HCl>HF |
您最近一年使用:0次
4 . 某化学实验小组同学利用如图所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。___________ ;干燥氨气常用的干燥剂是___________ 。
(2)收集氨气时,请你选择氨气的进气口___________ (填“a”或“b”),理由是___________ 。
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是___________ 。
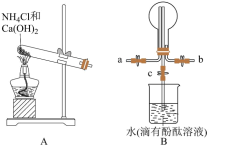
(2)收集氨气时,请你选择氨气的进气口
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是
您最近一年使用:0次
2024-05-21更新
|
153次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
名校
5 . 在一定条件下,可以发生反应:
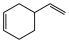 的化学方程式:
的化学方程式:(2)具有良好性能的工程塑ABS(
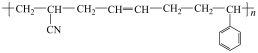 )可由苯乙烯与其他物质聚合得到。写出除苯乙烯外的另两种单体的结构简式:
)可由苯乙烯与其他物质聚合得到。写出除苯乙烯外的另两种单体的结构简式:
您最近一年使用:0次
2024-05-11更新
|
255次组卷
|
2卷引用:名校期末好题汇编-合成高分子(非选择题)
名校
解题方法
6 . 某小组同学设计实验实现几种价态硫元素的转化。
Ⅰ:从下列试剂中选择合适的试剂实现S(+6价)→S(+4价)的转化。
试剂清单:①浓H2SO4;②稀H2SO4;③酸性KMnO4溶液;④Na2SO3溶液;⑤Cu;⑥品红溶液。
(1)写出实现转化的化学方程式:___________ 。
(2)设计实验,证明实现了该转化(写出操作和现象):___________ 。
Ⅱ:实现硫元素在0价、+2价、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
SO2 Na2SO3溶液
Na2SO3溶液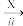 Na2S2O3溶液
Na2S2O3溶液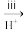 X
X
(3)ⅰ中加入的物质是___________ ,该转化说明SO2的类别是___________ 。
(4)写出ⅲ反应的离子方程式:___________ 。
Ⅰ:从下列试剂中选择合适的试剂实现S(+6价)→S(+4价)的转化。
试剂清单:①浓H2SO4;②稀H2SO4;③酸性KMnO4溶液;④Na2SO3溶液;⑤Cu;⑥品红溶液。
(1)写出实现转化的化学方程式:
(2)设计实验,证明实现了该转化(写出操作和现象):
Ⅱ:实现硫元素在0价、+2价、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
SO2
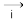 Na2SO3溶液
Na2SO3溶液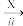 Na2S2O3溶液
Na2S2O3溶液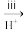 X
X(3)ⅰ中加入的物质是
(4)写出ⅲ反应的离子方程式:
您最近一年使用:0次
2024-05-11更新
|
92次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
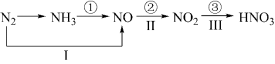
7 . 价类二维图是学习和研究物质转化及其性质的有效方法,如图是氮元素的价类二维图。回答下列问题:_______ ,B_______ 。
(2)从N元素的化合价分析,N2具有氧化性和还原性,请写出N2还原性化学方程式:_______ 。
(3)写出铜与硝酸反应生成物质A的离子方程式_______ 。
(4)HNO3与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为_______ 。
(5)物质D是一种重要的氮肥,写出检验D的阳离子的方法_______ 。

(2)从N元素的化合价分析,N2具有氧化性和还原性,请写出N2还原性化学方程式:
(3)写出铜与硝酸反应生成物质A的离子方程式
(4)HNO3与图中的物质C常用于检验
 的存在,则C的化学式为
的存在,则C的化学式为(5)物质D是一种重要的氮肥,写出检验D的阳离子的方法
您最近一年使用:0次
2024-05-08更新
|
135次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
8 . 氮及其化合物的转化关系如图所示: ___________ ,其中氧化剂与还原剂的质量之比是___________ 。
(2)某研究小组为了探究硝酸的性质,进行如下实验操作。
①从试剂柜中取一瓶浓硝酸,发现其保存在___________ 色试剂瓶中,取少量浓硝酸于试管中,发现其溶液呈“黄色”,其原因是___________ (用化学方程式表达)。该研究小组尝试将显“黄色”的浓硝酸恢复到原本的无色。下列措施合理的是___________ (填字母)。
a.加热浓硝酸 b.向硝酸中加水
c.向浓硝酸中通入适量空气 d.向浓硝酸中加入适量的NaOH固体
②向浓硝酸中加入稍过量铜片,在反应中硝酸体现的性质为___________ 。当实验完毕,该小组同学向试管中滴入少量稀硫酸,发现铜片又逐渐溶解,产生无色气体,请写出反应的离子方程式___________ 。
(2)某研究小组为了探究硝酸的性质,进行如下实验操作。
①从试剂柜中取一瓶浓硝酸,发现其保存在
a.加热浓硝酸 b.向硝酸中加水
c.向浓硝酸中通入适量空气 d.向浓硝酸中加入适量的NaOH固体
②向浓硝酸中加入稍过量铜片,在反应中硝酸体现的性质为
您最近一年使用:0次
2024-05-07更新
|
130次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
名校
9 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:
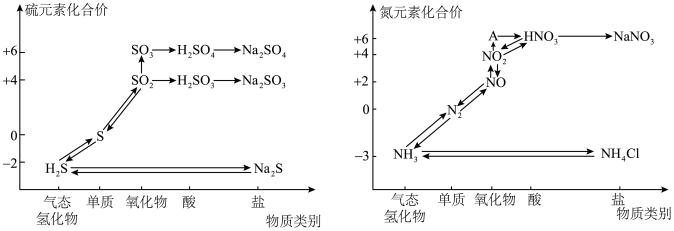
(1)根据A对应的化合价和物质类别, 为
为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式___________ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ ,反应的离子方程式为___________ 。
(4)工厂里常采用 溶液吸收
溶液吸收 气体,使其转化为化工产品
气体,使其转化为化工产品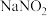 和
和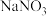 ,试写出其化学方程式:
,试写出其化学方程式:___________ 。
(5)铜与稀硫酸不反应,在一定条件下却可以与浓硫酸发生反应。写出铜与浓硫酸反应的化学方程式:___________ 。

(1)根据A对应的化合价和物质类别,
 为
为(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工厂里常采用
 溶液吸收
溶液吸收 气体,使其转化为化工产品
气体,使其转化为化工产品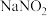 和
和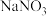 ,试写出其化学方程式:
,试写出其化学方程式:(5)铜与稀硫酸不反应,在一定条件下却可以与浓硫酸发生反应。写出铜与浓硫酸反应的化学方程式:
您最近一年使用:0次
2024-05-07更新
|
138次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
10 . 以下实验中分别利用了硫酸的哪些性质?
A.强酸性;B.强氧化性;C.高沸点、难挥发性;D.脱水性;E.吸水性
A.强酸性;B.强氧化性;C.高沸点、难挥发性;D.脱水性;E.吸水性
| 实验 | 性质 | |
| (1) | 浓硫酸使胆矾变白。 | |
| (2) | 浓硫酸滴在纸屑、棉花上变黑。 | |
| (3) | 亚硫酸钠中加入硫酸,产生二氧化硫。 | |
| (4) | 适量浓硫酸与蔗糖混合后,体积膨胀颜色变黑。 | |
| (5) | 浓硫酸与活泼金属反应无氢气生成。 | |
| (6) | 浓硫酸与铜反应,溶液变蓝,且生成刺激性气体。 | |
| (7) | 可以用铁制容器装运浓硫酸。 | |
| (8) | 固体氯化钠与浓硫酸共热制 。 。 |
您最近一年使用:0次
2024-05-05更新
|
102次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)



