1 . 工业上湿法合成硼氢化钠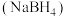 路线如下:
路线如下:

已知:硼酸的结构为: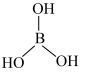
请回答下列问题:
(1)“合成”步骤中常将 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是___________ 。
(2)“合成”反应的化学方程式为___________ 。
(3)“合成”反应也可以利用KH,其还原能力比 更强,请说明原因
更强,请说明原因___________ 。
(4)硼氢化钠在催化剂钌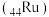 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。

(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素___________ 。并写出检验过程中涉及的离子方程式___________ 。
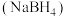 路线如下:
路线如下:
已知:硼酸的结构为:

请回答下列问题:
(1)“合成”步骤中常将
 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是(2)“合成”反应的化学方程式为
(3)“合成”反应也可以利用KH,其还原能力比
 更强,请说明原因
更强,请说明原因(4)硼氢化钠在催化剂钌
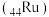 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。
A.元素钌 在元素周期表中位于第五周期Ⅷ族 在元素周期表中位于第五周期Ⅷ族 |
B. 分子中B原子为 分子中B原子为 杂化且不含孤对电子 杂化且不含孤对电子 |
C.过程④中产生 ,转移电子的物质的量为 ,转移电子的物质的量为 |
D.硼氢化钠中硼元素的化合价为 价,反应过程中硼元素的化合价始终保持不变 价,反应过程中硼元素的化合价始终保持不变 |
(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素
您最近一年使用:0次
14-15高二上·湖北荆州·期末
名校
解题方法
2 . NH4Al(SO4)2常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______ (用离子方程式说明)。
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c( )
)_______ (填“等于”“大于”或“小于”)0.1mol∙L-1NH4HSO4溶液中的c( )。
)。
(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。
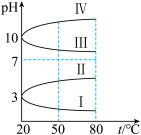
①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字),导致NH4Al(SO4)2溶液的pH随温度变化的原因是_______ 。
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c c
c 3cAl3=
3cAl3=_______ molL1。
(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是_______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是_______ 。
(1)NH4Al(SO4)2可作净水剂,其原理是
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c(
 )
) )。
)。(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c
 c
c 3cAl3=
3cAl3=(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
2022-12-01更新
|
1394次组卷
|
57卷引用:2014届山西省山大附中高三下学期第一次月考化学试卷
(已下线)2014届山西省山大附中高三下学期第一次月考化学试卷2016-2017学年内蒙古包头九中高二上10月月考化学卷2016-2017学年四川省成都七中高二上11月考试化学卷湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题河北省永年县第二中学2017-2018学年高二12月月考化学试题高二人教版选修4 期末学业测评(一)【全国百强校】江苏省扬州中学2018-2019学年高二第二学期五月检测化学试题河北省沧州市泊头市第一中学2019-2020学年高二上学期第三次月考化学试题山西省晋中市祁县中学校2019-2020学年高二11月月考化学试题河南省南阳市第一中学2021届高三上学期第二次月考(9月)化学试题四川省资阳中学2021-2022学年高二下学期3月月考化学试题广东省广州市华南师范大学附属中学2022-2023学年高二上学期12月月考化学试题山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷(已下线)2013-2014学年湖北省荆州市部分县市高二上学期期末考试化学试卷2015—2016学年河南省郑州一中高二上学期期末考试化学试卷山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题(已下线)2019年1月5日 《每日一题》人教选修4-周末培优(已下线)2019年10月13日《每日一题》2020年高考一轮复习——每周一测四川省武胜烈面中学校2019-2020学年高二上学期期中考试化学试题苏教版选修四化学反应原理专题3第三单元 盐类的水解 同步检测试卷(已下线)考点14 化学基本理论——《备战2020年高考精选考点专项突破题集》(已下线)2019年12月30日 《每日一题》人教版(选修4)——盐类水解的影响因素四川省成都市射洪县2018-2019学年高二下学期期末能力素质监测理综化学试题(英才班)鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时3 水解平衡的移动和水解原理的应用高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时2 盐类水解的影响因素及应用(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)浙江省苍南县金乡卫城中学2020-2021学年高二上学期第一次月考化学试题(已下线)3.3.2 影响盐类水解的主要因素和盐类水解的应用(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第25讲 盐类水解(精练)-2022年高考化学一轮复习讲练测选择性必修1 专题3 第三单元 课时2 盐类水解的影响因素及应用(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第23讲 盐类水解(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)(已下线)3.3.3 盐类水解的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.3.2 影响盐类水解的主要因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第15练 反应原理综合-2022年【寒假分层作业】高二化学(人教版2019选择性必修2)辽宁省渤海大学附属高级中学2021-2022学年高二上学期期中考试化学试题山西省运城市教育发展联盟2021-2022学年高二上学期11月期中检测化学试题(已下线)3.3.2 影响盐类的水解的主要因素-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)第20讲 盐类水解的影响因素及应用(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题(已下线)专题十三水溶液中的离子平衡四川省成都市树德中学2022-2023学年高二上学期期末考试化学试题四川省宜宾市第四中学校2022-2023学年高二下学期开学考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第49练 盐类的水解(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)盐类的水解宁夏育才中学2017-2018学年高二上学期期末考试化学试题湖北省宜昌市第一中学2017-2018学年高二上学期期末考试化学试题吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题山东省淄博市2019-2020学年高二上学期期中考试化学试题湖北省黄石市有色第一中学2020-2021学年高二上学期期末考试化学试题江苏省南通市海门实验学校2020-2021学年高二上学期期中考试化学试题福建省莆田锦江中学2020-2021学年高二上学期期末考试化学试题安徽省皖南八校2022届高三上学期摸底联考化学试题黑龙江省大庆铁人中学2023-2024学年高二上学期期中考试化学试题
3 . 氮的化合物在生产、生活中有广泛应用。例如N2H4是火箭发射燃料,NH3是国民经济基础。
(1)在绝热恒容密闭容器中充入一定量N2O4和N2H4,发生反应:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H。已知达到平衡时温度升高,下列说法正确的是_______(填字母)。
(2)工业上,采用NH3还原NO法消除NO污染。一定条件下,向恒容密闭容器中充入NH3和NO,在不同催化剂Catl、Cat2、Cat3作用下发生反应:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0。测得相同时间内NO的转化率随温度的变化如图所示。
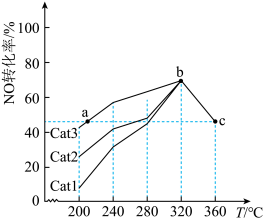
①其他条件相同,催化效率最高的是_______ (填“Cat1”“Cat2”或“Cat3”)。
②在a、b、c点中,达到平衡状态的是_______ (填代号)。
(3)工业上可以用天然气处理NO2,消除NO2的污染。发生反应CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2(g)。在一定温度下,向恒容密闭容器中充入1molCH4和2mol NO2,发生上述反应,起始时测得总压强为60kPa,N2分压与时间关系如图所示。0~10min内NO2分压变化率为
CO2(g)+2H2O(g)+N2(g)。在一定温度下,向恒容密闭容器中充入1molCH4和2mol NO2,发生上述反应,起始时测得总压强为60kPa,N2分压与时间关系如图所示。0~10min内NO2分压变化率为_______  ;该温度下,平衡常数Kp为
;该温度下,平衡常数Kp为_______ kPa。提示:Kp为用气体分压计算的平衡常数,气体分压=总压×物质的量分数。

(4)工业上利用氨气制备氢氰酸(HCN)的反应为CH4(g)+NH3(g) HCN(g)+3H2(g) △H>0。速率方程为
HCN(g)+3H2(g) △H>0。速率方程为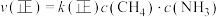 ,
, ,k(正)、k(逆)分别为正、逆反应速率常数,只与温度、催化剂有关。
,k(正)、k(逆)分别为正、逆反应速率常数,只与温度、催化剂有关。
①其他条件不变,反应达到平衡后,NH3转化率随着条件X的增大而减小,则X可能是_______ (答一种即可)。
②当平衡常数K=20,k(逆)=2时,k(正)=_______ 。
(1)在绝热恒容密闭容器中充入一定量N2O4和N2H4,发生反应:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H。已知达到平衡时温度升高,下列说法正确的是_______(填字母)。
| A.混合气体密度不随时间变化时,达到平衡状态 |
| B.平衡后,充入惰性气体,N2H4的平衡转化率增大 |
| C.上述反应中反应物总能量高于生成物总能量 |
| D.及时分离出水蒸气,能增大正反应速率 |

①其他条件相同,催化效率最高的是
②在a、b、c点中,达到平衡状态的是
(3)工业上可以用天然气处理NO2,消除NO2的污染。发生反应CH4(g)+2NO2(g)
 CO2(g)+2H2O(g)+N2(g)。在一定温度下,向恒容密闭容器中充入1molCH4和2mol NO2,发生上述反应,起始时测得总压强为60kPa,N2分压与时间关系如图所示。0~10min内NO2分压变化率为
CO2(g)+2H2O(g)+N2(g)。在一定温度下,向恒容密闭容器中充入1molCH4和2mol NO2,发生上述反应,起始时测得总压强为60kPa,N2分压与时间关系如图所示。0~10min内NO2分压变化率为 ;该温度下,平衡常数Kp为
;该温度下,平衡常数Kp为
(4)工业上利用氨气制备氢氰酸(HCN)的反应为CH4(g)+NH3(g)
 HCN(g)+3H2(g) △H>0。速率方程为
HCN(g)+3H2(g) △H>0。速率方程为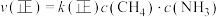 ,
, ,k(正)、k(逆)分别为正、逆反应速率常数,只与温度、催化剂有关。
,k(正)、k(逆)分别为正、逆反应速率常数,只与温度、催化剂有关。①其他条件不变,反应达到平衡后,NH3转化率随着条件X的增大而减小,则X可能是
②当平衡常数K=20,k(逆)=2时,k(正)=
您最近一年使用:0次
2022-11-05更新
|
208次组卷
|
2卷引用:湖南省河南省湘豫名校联考2022- 2023学年高二上学期阶段考试(一)化学试题
名校
4 . 氨基磺酸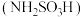 可用于合成除草剂、防火剂、甜味剂、防腐剂、金属清洗剂等,是一种常见的化工原料。
可用于合成除草剂、防火剂、甜味剂、防腐剂、金属清洗剂等,是一种常见的化工原料。
(1)由尿素 与发烟硫酸(用
与发烟硫酸(用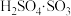 表示,)在40~70℃下进行磺化反应生成氨基磺酸,则该反应的化学方程式为
表示,)在40~70℃下进行磺化反应生成氨基磺酸,则该反应的化学方程式为_______ 。
(2)氨基磺酸在高温时的分解反应为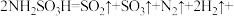
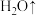 。
。
①检验该混合产物中含有 的试剂是
的试剂是_______ (填序号)。
A.品红溶液 B. 溶液 C.溴水 D.碳酸氢钠溶液
溶液 C.溴水 D.碳酸氢钠溶液
②高温时,该反应中转移2mol电子时,生成气体的总物质的量是_______ mol。
(3)硝酸与氨基磺酸能反应生成硫酸、水和一种氮氧化合物。
①0.5mol该氮氧化合物中氮元素的质量比氧元素的多6g,则该氮氧化合物的化学式为_______ 。
②下列有关浓硫酸和浓硝酸的说法正确的是_______ (填序号)。
A.浓硫酸可用于干燥 、
、 、HI
、HI
B.常温下,浓硫酸和浓硝酸均能将铝“钝化”,均体现其强氧化性
C.浓硫酸和浓硝酸分别长期露置在空气中,两者浓度变小的原理不同
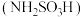 可用于合成除草剂、防火剂、甜味剂、防腐剂、金属清洗剂等,是一种常见的化工原料。
可用于合成除草剂、防火剂、甜味剂、防腐剂、金属清洗剂等,是一种常见的化工原料。(1)由尿素
 与发烟硫酸(用
与发烟硫酸(用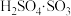 表示,)在40~70℃下进行磺化反应生成氨基磺酸,则该反应的化学方程式为
表示,)在40~70℃下进行磺化反应生成氨基磺酸,则该反应的化学方程式为(2)氨基磺酸在高温时的分解反应为
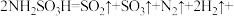
 。
。①检验该混合产物中含有
 的试剂是
的试剂是A.品红溶液 B.
 溶液 C.溴水 D.碳酸氢钠溶液
溶液 C.溴水 D.碳酸氢钠溶液②高温时,该反应中转移2mol电子时,生成气体的总物质的量是
(3)硝酸与氨基磺酸能反应生成硫酸、水和一种氮氧化合物。
①0.5mol该氮氧化合物中氮元素的质量比氧元素的多6g,则该氮氧化合物的化学式为
②下列有关浓硫酸和浓硝酸的说法正确的是
A.浓硫酸可用于干燥
 、
、 、HI
、HIB.常温下,浓硫酸和浓硝酸均能将铝“钝化”,均体现其强氧化性
C.浓硫酸和浓硝酸分别长期露置在空气中,两者浓度变小的原理不同
您最近一年使用:0次
2022-10-10更新
|
108次组卷
|
2卷引用:皖豫名校联盟2022-2023学年高三毕业班第一次联考化学试题
名校
解题方法
5 . 元素周期表是许多科学家共同努力的结晶。下图是元素周期表的一部分。
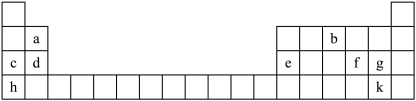
请回答下列问题:
(1)a元素的名称是_______ ,在实验室中c的单质通常保存在_______ 中。
(2)f、g、k三种元素的非金属性由强到弱的顺序是_______ (用元素符号表示)。
(3)e的最高价氧化物与h的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(4)b的简单氢化物沸点高于同主族相邻周期元素的简单氢化物,其原因是_______ 。

请回答下列问题:
(1)a元素的名称是
(2)f、g、k三种元素的非金属性由强到弱的顺序是
(3)e的最高价氧化物与h的最高价氧化物对应的水化物反应的离子方程式为
(4)b的简单氢化物沸点高于同主族相邻周期元素的简单氢化物,其原因是
您最近一年使用:0次
2022-10-10更新
|
462次组卷
|
2卷引用:皖豫名校联盟2022-2023学年高三毕业班第一次联考化学试题
6 . 丙烯是工业上合成精细化学品的原料,随着天然气和页岩气的可用性不断提高,制取丙烯的技术受到人们越来越多的关注。
(1)主反应I :C3H8(g) C3 H6(g)+H2(g) △H1
C3 H6(g)+H2(g) △H1
副反应Ⅱ :C3H8(g) C2H4(g)+CH4(g) △H2
C2H4(g)+CH4(g) △H2
已知H2、丙烷(C3H8 )和丙烯(C3 H6)的燃烧热(△H)分别是-285.8 kJ·mol-1、-2220 kJ·mol-1和-2051 kJ·mol-1,则△H=_______ kJ·mol-1.主反应I在_______ (填“高温”、“低温”或“任意温度”)时能自发进行。
(2)一定温度下,向总压恒定为p kPa的容器中充入一定量C3H8气体,在催化作用下,发生上述反应制备C3 H6。
①下列情况表明反应达到平衡状态的是_______ (填标号)。
A.气体密度不再改变
B.体系压强不再改变
C.混合气体的平均摩尔质量不再改变
D.单位时间内消耗C3H8的物质的量与生成C3 H6的物质的量相等
②从平衡移动的角度判断,达到平衡后通入N2的作用是_______ 。
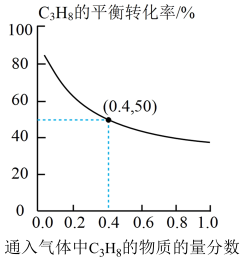
(3)在温度为T时,向起始压强为120 kPa的恒压容器中通入4 mol C3H8和6 mol N2发生反应,经10 min反应达到平衡,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图所示。该条件下,C3H8的选择性为80%,则0~ 10 min内生成C3 H6的平均速率为_______ kPa·min-1;反应I的平衡常数 Kp=_______ kPa(以分压表示,分压=总压X物质的量分数,保留一位小数)。
(4)向恒温刚性密闭容器中通入一定体积比的C3H8、O2、N2的混合气体,已知某反应条件下只发生如下反应(k、k'为速率常数):
反应I :2C3H8(g) +O2(g)=2C3 H6(g) +2H2O(g) k
反应Ⅳ :2C3 H6(g) + 9O2 (g)=6CO2(g)+ 6H2O(g) k'
实验测得丙烯的净生成速率方程为v(C3 H6)=kp(C3H8)-k'p(C3H6),可推测丙烯的浓度随时间的变化趋势为_______ ,其理由是_______
(1)主反应I :C3H8(g)
 C3 H6(g)+H2(g) △H1
C3 H6(g)+H2(g) △H1副反应Ⅱ :C3H8(g)
 C2H4(g)+CH4(g) △H2
C2H4(g)+CH4(g) △H2已知H2、丙烷(C3H8 )和丙烯(C3 H6)的燃烧热(△H)分别是-285.8 kJ·mol-1、-2220 kJ·mol-1和-2051 kJ·mol-1,则△H=
(2)一定温度下,向总压恒定为p kPa的容器中充入一定量C3H8气体,在催化作用下,发生上述反应制备C3 H6。
①下列情况表明反应达到平衡状态的是
A.气体密度不再改变
B.体系压强不再改变
C.混合气体的平均摩尔质量不再改变
D.单位时间内消耗C3H8的物质的量与生成C3 H6的物质的量相等
②从平衡移动的角度判断,达到平衡后通入N2的作用是
(3)在温度为T时,向起始压强为120 kPa的恒压容器中通入4 mol C3H8和6 mol N2发生反应,经10 min反应达到平衡,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图所示。该条件下,C3H8的选择性为80%,则0~ 10 min内生成C3 H6的平均速率为

(4)向恒温刚性密闭容器中通入一定体积比的C3H8、O2、N2的混合气体,已知某反应条件下只发生如下反应(k、k'为速率常数):
反应I :2C3H8(g) +O2(g)=2C3 H6(g) +2H2O(g) k
反应Ⅳ :2C3 H6(g) + 9O2 (g)=6CO2(g)+ 6H2O(g) k'
实验测得丙烯的净生成速率方程为v(C3 H6)=kp(C3H8)-k'p(C3H6),可推测丙烯的浓度随时间的变化趋势为
您最近一年使用:0次
22-23高一上·全国·阶段练习
名校
7 . 分类法是进行化学研究的重要方法。不同的标准可以把事物分为不同的类别。
Ⅰ.现有以下物质:①固体碳酸氢钠 ② ③CaCO3 ④Fe(OH)3胶体 ⑤NaHSO4溶液 ⑥干冰 ⑦稀盐酸 ⑧蔗糖
③CaCO3 ④Fe(OH)3胶体 ⑤NaHSO4溶液 ⑥干冰 ⑦稀盐酸 ⑧蔗糖
(1)以上物质中属于混合物的是_______ (填序号,下同),属于电解质的是_______ 。
(2)向④中逐滴滴加⑦至过量,可观察到先产生红褐色的沉淀后沉淀逐渐溶解,写出沉淀溶解的离子方程式_______ 。
(3)写出①在水中的电离方程式_______ 。
Ⅱ.采用不同的标准可以把化学反应分为:四种基本反应类型和离子反应、氧化还原反应。
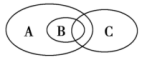
(4)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是_______ (填字母)。
(5)②和⑦的反应与上述三种反应类型均符合,写出其反应的离子方程式_______ 。
Ⅰ.现有以下物质:①固体碳酸氢钠 ②
 ③CaCO3 ④Fe(OH)3胶体 ⑤NaHSO4溶液 ⑥干冰 ⑦稀盐酸 ⑧蔗糖
③CaCO3 ④Fe(OH)3胶体 ⑤NaHSO4溶液 ⑥干冰 ⑦稀盐酸 ⑧蔗糖(1)以上物质中属于混合物的是
(2)向④中逐滴滴加⑦至过量,可观察到先产生红褐色的沉淀后沉淀逐渐溶解,写出沉淀溶解的离子方程式
(3)写出①在水中的电离方程式
Ⅱ.采用不同的标准可以把化学反应分为:四种基本反应类型和离子反应、氧化还原反应。
(4)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(5)②和⑦的反应与上述三种反应类型均符合,写出其反应的离子方程式
您最近一年使用:0次
22-23高一上·全国·阶段练习
8 . 在抗击新冠肺炎疫情的战役中,病毒在不断发生变异,现有疫苗对变异病毒的有效性有待进一步的验证,因此民众的防疫意识不能松懈。
(1)口罩作为基础防疫物资,可以有效防止飞沫的传播。最新的研究表明新冠病毒可能通过气溶胶传播。气溶胶属于_______ (填“胶体”或“溶液”);常利用_______ 区分溶液和胶体。
(2)为有效防止新冠病海的传播,除了戴口罩,还需加强对隔离场所的消毒。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备Cl2有三种常用方法:
a.MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑
b. KMnO4+
KMnO4+ HCl(浓)=
HCl(浓)= KCl+
KCl+ MnCl2+
MnCl2+ Cl2↑+
Cl2↑+ H2O
H2O
c.KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
①常温下,医用酒精、Cl2、KMnO4、MnCl2、浓盐酸中能导电的是_______ ,属于混合物的是_______ ,属于电解质的是_______ 。
②写出反应c对应的离子方程式:_______ [已知HCl(浓)可拆分为H+和Cl-]
③配平反应b的方程式_______ 。
④当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是_______ 反应(填“a”、“b”、“c”下同);当得到等质量的Cl2时,消耗HCl的质量最多的是_______ 反应。
(1)口罩作为基础防疫物资,可以有效防止飞沫的传播。最新的研究表明新冠病毒可能通过气溶胶传播。气溶胶属于
(2)为有效防止新冠病海的传播,除了戴口罩,还需加强对隔离场所的消毒。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备Cl2有三种常用方法:
a.MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑
b.
 KMnO4+
KMnO4+ HCl(浓)=
HCl(浓)= KCl+
KCl+ MnCl2+
MnCl2+ Cl2↑+
Cl2↑+ H2O
H2Oc.KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
①常温下,医用酒精、Cl2、KMnO4、MnCl2、浓盐酸中能导电的是
②写出反应c对应的离子方程式:
③配平反应b的方程式
④当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是
您最近一年使用:0次
2022-07-27更新
|
459次组卷
|
4卷引用:第一次月考测评卷-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
(已下线)第一次月考测评卷-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)湖南省祁东县育贤中学2022-2023学年高一上学期第一次月考化学试题山东省枣庄市第八中学南校2022-2023学年高一11月疫情返校测试(彩虹班)化学试题山东省枣庄市第八中学南校2022-2023学年高一11月疫情返校测试(2-18班)化学试题
22-23高一上·全国·阶段练习
名校
解题方法
9 . 现有下列10种物质:①铝,②纯醋酸,③CO2,④H2SO4,⑤NaOH,⑥硫酸铜溶液,⑦熔融的NaCl,⑧NaHSO4,⑨硝酸钾晶体,⑩乙醇。
(1)上述物质中属于非电解质的有_______ (填序号);①②⑥⑦⑨⑩这六种物质中能导电的有_______ (填序号)。
(2)向⑥中加入⑤的离子方程式是_______ 。
(3)⑧在水中的电离方程式为_______ 。
(4)上述物质中有两种物质在水溶液中发生的反应可用离子反应H++OH-=H2O表示,请写出该离子反应对应的其中一个化学方程式_______ 。
(5)用双线桥表示CaH2+2H2O=Ca(OH)2+2H2↑反应电子转移情况:_______ 。
(1)上述物质中属于非电解质的有
(2)向⑥中加入⑤的离子方程式是
(3)⑧在水中的电离方程式为
(4)上述物质中有两种物质在水溶液中发生的反应可用离子反应H++OH-=H2O表示,请写出该离子反应对应的其中一个化学方程式
(5)用双线桥表示CaH2+2H2O=Ca(OH)2+2H2↑反应电子转移情况:
您最近一年使用:0次
2022-07-27更新
|
476次组卷
|
4卷引用:第一次月考测评卷-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
(已下线)第一次月考测评卷-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)黑龙江省鹤岗市第一中学2022-2023学年高一上学期10月月考化学试题(已下线)期中测试卷一【测试范围:第一、二章】-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)宁夏回族自治区银川一中2023-2024学年高一上学期期中考试化学试题
10 . 测定溶液中的钙离子浓度的基本操作为:向溶液中加入(NH4)2C2O4将钙离子转化为CaC2O4沉淀,滤出沉淀,将沉淀溶于硫酸中,生成H2C2O4和CaSO4稀溶液。然后加入KMnO4标准溶液,将H2C2O4完全氧化。再用 (NH4)2Fe(SO4)2 溶液滴定过量的KMnO4,现取20.00mL某溶液进行上述处理。加入0.1000mol/LKMnO4标准溶液12.00mL,消耗0.2000mol/L的(NH4)2Fe(SO4)2溶液20.00mL。
(1)写出KMnO4与H2C2O4反应的离子方程式___________ 。
(2)求溶液中钙离子的浓度___________ 。
(1)写出KMnO4与H2C2O4反应的离子方程式
(2)求溶液中钙离子的浓度
您最近一年使用:0次



