1 . 化合物可分为离子化合物和共价化合物,其分类的依据就是看化合物中是否存在着阴、阳离子。共价化合物又可分为极性化合物和非极性化合物,若分子结构对称,则为非极性分子;反之,则为极性分子。在氮氧化物中, 是一种比较有趣的化合物。它在低温下呈固态,在温度稍高(如在夏天)就变成气态,同时发生部分分解,生成氮的低价氧化物和氧气。
是一种比较有趣的化合物。它在低温下呈固态,在温度稍高(如在夏天)就变成气态,同时发生部分分解,生成氮的低价氧化物和氧气。
(1)
 是
是 和
和 的化学方程式为
的化学方程式为(2)已知
 分子的经典结构为
分子的经典结构为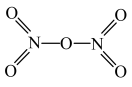 ,则气态时
,则气态时 是
是(3)
 在固态时,能发生如下电离:
在固态时,能发生如下电离: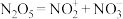 。因此,固态时的
。因此,固态时的 属于
属于(4)
 能和许多物质发生化学反应。与金属Na发生反应的化学方程式为
能和许多物质发生化学反应。与金属Na发生反应的化学方程式为
您最近一年使用:0次
2 . 回答下列问题。
(1)向含有NaOH和 的混合溶液中缓缓通入
的混合溶液中缓缓通入 直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
①___________ ;
②___________ ;
③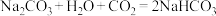 ;
;
④___________ 。
(2)高氯酸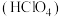 是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。
是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。
①高氯酸氯的化学式为___________ ,物质类别可归为___________ 。
②高氯酸氯在室温下即发生分解,形成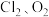 和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:
和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:___________ 。
(3)医药上可用石膏来固定骨折部位。石膏有熟石膏(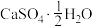 ,一种白色粉末)和生石膏(
,一种白色粉末)和生石膏( ,一种坚硬的固体)两种,固定骨折的石膏是
,一种坚硬的固体)两种,固定骨折的石膏是___________ (填化学式)。固定时发生反应的化学方程式为___________ 。
(4)CO与 溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为
溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为___________ ,反应中可能看到的现象是___________ 。
(1)向含有NaOH和
 的混合溶液中缓缓通入
的混合溶液中缓缓通入 直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:①
②
③
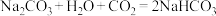 ;
;④
(2)高氯酸
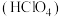 是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。
是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。①高氯酸氯的化学式为
②高氯酸氯在室温下即发生分解,形成
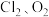 和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:
和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:(3)医药上可用石膏来固定骨折部位。石膏有熟石膏(
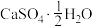 ,一种白色粉末)和生石膏(
,一种白色粉末)和生石膏( ,一种坚硬的固体)两种,固定骨折的石膏是
,一种坚硬的固体)两种,固定骨折的石膏是(4)CO与
 溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为
溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为
您最近一年使用:0次
10-11高二·河南洛阳·阶段练习
名校
3 . 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法
该法的工艺流程为:
CrO42-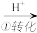 Cr2O72-
Cr2O72-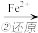 Cr3+
Cr3+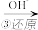 Cr(OH)3
Cr(OH)3
其中第①步存在平衡2CrO42-(黄色)+2H+ Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______ 色。
(2)能说明第①步反应达平衡状态的是_____ (填序号)
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要______ mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至
Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至______ 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为______ (用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______ 。
方法1:还原沉淀法
该法的工艺流程为:
CrO42-
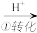 Cr2O72-
Cr2O72-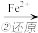 Cr3+
Cr3+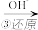 Cr(OH)3
Cr(OH)3 其中第①步存在平衡2CrO42-(黄色)+2H+
 Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O(1)若平衡体系的pH=2,该溶液显
(2)能说明第①步反应达平衡状态的是
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至
Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有
您最近一年使用:0次
2020-03-20更新
|
324次组卷
|
12卷引用:2014年高中化学苏教版选修四模块综合检测练习卷
(已下线)2014年高中化学苏教版选修四模块综合检测练习卷(已下线)2011-2012学年河南省偃师市高级中学高二第二次月考化学试卷(已下线)2011-2012学年度江西省临川十中上学期高三期末考试化学试卷四川省雅安中学2016-2017学年高二下学期半期考试化学试题陕西省西安市交通大学附属中学2017-2018学年高二第二次月考期末选修四测试化学试题福建省福州市第三中学2017-2018学年高二下学期期末考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)上学期期中考试化学试题陕西省西安市周至县第五中学2020届高三第二次模拟考试化学试题湖南省怀化市中方一中2020届高三下学期第一次模拟测试理综化学试题(已下线)2012-2013学年云南省玉溪一中高二第二次月考(6月)化学试卷(已下线)广西柳州铁路第一中学2017届高三第二次理科综合测试化学试题广东省化州市第一中学2019-2020学年高二4月线上统一测试化学试题
真题
4 . 臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是___________ 和_________ 。(填分子式)
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为0.0216 mol/L。
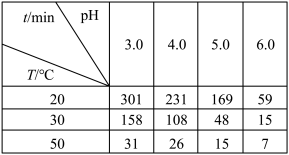
①pH增大能加速O3分解,表明对O3分解起催化作用的是___________ 。
②在30°C、pH=4.0条件下,O3的分解速率为__________ mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为______ 。(填字母代号)
a. 40℃、pH=3.0 b. 10℃、pH=4.0 c. 30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
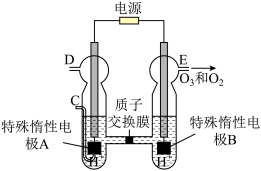
①图中阴极为_____ (填“A”或“B”),其电极反应式为_____ 。
②若C处通入O 2,则A极的电极反应式为_____ 。
③若C处不通入O 2,D、E处分别收集到x L和有y L气体(标准情况),则E处收集的气体中O 3 所占的体积分数为_____ 。(忽略O 3的分解)。
(1)O3与KI溶液反应生成的两种单质是
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为0.0216 mol/L。

①pH增大能加速O3分解,表明对O3分解起催化作用的是
②在30°C、pH=4.0条件下,O3的分解速率为
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
a. 40℃、pH=3.0 b. 10℃、pH=4.0 c. 30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。

①图中阴极为
②若C处通入O 2,则A极的电极反应式为
③若C处不通入O 2,D、E处分别收集到x L和有y L气体(标准情况),则E处收集的气体中O 3 所占的体积分数为
您最近一年使用:0次
5 . 在地壳中SiO2和HF存在以下平衡:SiO2(s)+4HF(g) SiF4(g)+2H2O(g)ΔH=-148.9kJ·mol-1。
SiF4(g)+2H2O(g)ΔH=-148.9kJ·mol-1。
(1)如果该反应在体积不变的密闭容器中发生,当反应达到平衡时_______ (填字母)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(2)若反应容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g·L-1,在这段时间内HF的平均反应速率为_____________ 。
 SiF4(g)+2H2O(g)ΔH=-148.9kJ·mol-1。
SiF4(g)+2H2O(g)ΔH=-148.9kJ·mol-1。(1)如果该反应在体积不变的密闭容器中发生,当反应达到平衡时
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(2)若反应容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g·L-1,在这段时间内HF的平均反应速率为
您最近一年使用:0次
6 . 698K时,向VL的密闭容器中充入2molH2(g)和2molI2(g),发生反应:H2(g)+I2(g) 2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。

请回答下列问题:
(1)V=______ 。
(2)该反应达到最大限度的时间是_______ ,该时间内平均反应速率v(HI)=________ 。
(3)下列说法中可以说明反应2HI(g) H2(g)+I2(g)已达到平衡状态的是
H2(g)+I2(g)已达到平衡状态的是_____ 。
A.单位时间内生成nmolH2的同时生成2nmolHI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)该反应达到平衡状态时,__________ (填“吸收”或“放出”)的热量为______ 。
 2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
请回答下列问题:
(1)V=
(2)该反应达到最大限度的时间是
(3)下列说法中可以说明反应2HI(g)
 H2(g)+I2(g)已达到平衡状态的是
H2(g)+I2(g)已达到平衡状态的是A.单位时间内生成nmolH2的同时生成2nmolHI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)该反应达到平衡状态时,
您最近一年使用:0次
解题方法
7 . 下列说法中能说明2HI(g) H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是__________ 。
(1)单位时间内生成nmol H2的同时生成nmolHI;
(2)一个H-H键断裂的同时有两个H-I键断裂;
(3)c(HI)=c(I2);
(4)反应速率:v(H2)=v(I2)= v(HI);
v(HI);
(5)c(HI)∶c(I2)∶c(H2)=2∶1∶1;
(6)温度和体积一定时,某一生成物浓度不再变化;
(7)温度和体积一定时,容器内压强不再变化;
(8)条件一定,混合气体的平均相对分子质量不再变化;
(9)温度和体积一定时,混合气体的颜色不再发生变化。
 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是(1)单位时间内生成nmol H2的同时生成nmolHI;
(2)一个H-H键断裂的同时有两个H-I键断裂;
(3)c(HI)=c(I2);
(4)反应速率:v(H2)=v(I2)=
 v(HI);
v(HI);(5)c(HI)∶c(I2)∶c(H2)=2∶1∶1;
(6)温度和体积一定时,某一生成物浓度不再变化;
(7)温度和体积一定时,容器内压强不再变化;
(8)条件一定,混合气体的平均相对分子质量不再变化;
(9)温度和体积一定时,混合气体的颜色不再发生变化。
您最近一年使用:0次
8 . 1 000 mL某待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):
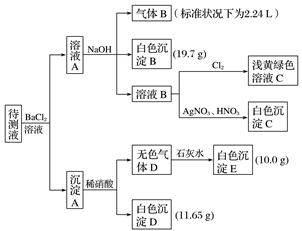
(1)写出生成白色沉淀B的离子方程式:__________________________________ 。
(2)待测液中肯定不存在的阳离子是________________ 。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在____ (填“是”或“否”),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:________________________ 。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是________________ 。
②沉淀A中能与稀硝酸反应的成分是____________ (写化学式)。
| 阳离子 | K+、NH 、Fe3+、Ba2+ 、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO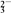 、HCO 、HCO 、SO 、SO 、SO 、SO |
现进行如下实验操作(每次实验所加试剂均过量):

(1)写出生成白色沉淀B的离子方程式:
(2)待测液中肯定不存在的阳离子是
(3)若无色气体D是单一气体:判断原溶液中K+是否存在
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是
②沉淀A中能与稀硝酸反应的成分是
您最近一年使用:0次
解题方法
9 . 铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况),最主要的原因是_____________________ ;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:___________ 。
(2)ZnFe2Ox是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2Ox和用于除去废气的转化关系为ZnFe2O4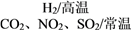 ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为
ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为________ 。请写出 ZnFe2Ox与NO2反应的化学方程式:_________________________ (x用前一问求出的具体值)。
(3)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以 FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,该反应还生成一种可燃性气体,则反应的化学方程式为___________________________ 。
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开)工作原理为FePO4+Li LiFePO4。则放电时正极上的电极反应式为
LiFePO4。则放电时正极上的电极反应式为___________________________________ 。
(4)已知25 ℃时Ksp[Fe(OH3)]=4.0×10-38,此温度下若在实验室中配制5 mol·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入______ mL 2 mol·L-1的盐酸(忽略加入盐酸时溶液体积的变化)。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况),最主要的原因是
(2)ZnFe2Ox是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2Ox和用于除去废气的转化关系为ZnFe2O4
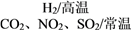 ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为
ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为(3)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以 FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,该反应还生成一种可燃性气体,则反应的化学方程式为
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开)工作原理为FePO4+Li
 LiFePO4。则放电时正极上的电极反应式为
LiFePO4。则放电时正极上的电极反应式为(4)已知25 ℃时Ksp[Fe(OH3)]=4.0×10-38,此温度下若在实验室中配制5 mol·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入
您最近一年使用:0次
10 . 亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
____ Na2SO3+____ KIO3+____ H2SO4===____ Na2SO4+____ K2SO4+____ I2+____ H2O
(1)配平上面的氧化还原方程式。
(2)若反应中有5 mol电子转移,则生成的碘单质是________ mol。
(1)配平上面的氧化还原方程式。
(2)若反应中有5 mol电子转移,则生成的碘单质是
您最近一年使用:0次



