1 . 纯碱工业是基本无机化工之一。完成下列填空:
(1)常温下向纯碱溶液中滴加酚酞试液,溶液变红,原因是___ (用离子方程式表示);继续滴加足量氯化钡溶液,可以看到__ 。
(2)最早的勒布朗法制碱涉及如下反应:Na2SO4+2C+CaCO3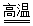 Na2CO3+CaS+2CO2↑。该反应中被还原的元素是
Na2CO3+CaS+2CO2↑。该反应中被还原的元素是___ 。若转移6.02×1024个电子,生成CO2在标准状况下的体积为__ L。
(3)索尔维法(氨碱法)是工业生产纯碱的主要方法,其主要原理可以表示为:NaCl(饱和)+H2O+CO2+NH3=NaHCO3↓+NH4Cl。该反应涉及的各物质中,属于弱电解质的是___ 。综合平衡理论解释通入CO2和NH3后为何会有NaHCO3析出___ 。
(4)侯德榜对索尔维法进行了改进,利用平衡移动原理从析出NaHCO3后的母液中提取NH4Cl产品,所需的物质有___ (填化学式)。
(5)纯碱厂在生产过程中要时刻关注设备的腐蚀情况。输送饱和食盐水的铸铁管道受到腐蚀时,正极的电极反应方程式为:___ 。为缓解腐蚀,可在铸铁管道上固定铝-锌-镉三元合金,该方法称为___ 。
(1)常温下向纯碱溶液中滴加酚酞试液,溶液变红,原因是
(2)最早的勒布朗法制碱涉及如下反应:Na2SO4+2C+CaCO3
 Na2CO3+CaS+2CO2↑。该反应中被还原的元素是
Na2CO3+CaS+2CO2↑。该反应中被还原的元素是(3)索尔维法(氨碱法)是工业生产纯碱的主要方法,其主要原理可以表示为:NaCl(饱和)+H2O+CO2+NH3=NaHCO3↓+NH4Cl。该反应涉及的各物质中,属于弱电解质的是
(4)侯德榜对索尔维法进行了改进,利用平衡移动原理从析出NaHCO3后的母液中提取NH4Cl产品,所需的物质有
(5)纯碱厂在生产过程中要时刻关注设备的腐蚀情况。输送饱和食盐水的铸铁管道受到腐蚀时,正极的电极反应方程式为:
您最近一年使用:0次
解题方法
2 . 氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为原子序数依次增大的同族元素。完成下列填空:
(1)铋在元素周期表中的位置是___ 。 Mc原子核内中子数与核外电子数之差为
Mc原子核内中子数与核外电子数之差为___ 。
(2)已知:P(s,红磷) P(s,白磷)-17.6kJ;P(s,白磷)
P(s,白磷)-17.6kJ;P(s,白磷) P(s,黑磷)+39.3kJ。红磷、白磷、黑鳞互为
P(s,黑磷)+39.3kJ。红磷、白磷、黑鳞互为___ ,其中最稳定的是___ 。
(3)SbCl3能发生较强的水解:Sb3++Cl-+H2O SbOCl↓+2H+。该水解反应的平衡常数表达式为
SbOCl↓+2H+。该水解反应的平衡常数表达式为____ 。配制SbCl3溶液应注意___ 。
(4)写出能够比较磷与砷最高价氧化物对应水化物酸性强弱的一个实验事实___ 。
(5)科学家发明了用H2治理废水中硝酸盐的污染的方法,其原理可以表示为:5H2+2NO
 N2+2OH-+4H2O。25℃时,反应进行10min,废水的pH由7变为12,这段时间内NO
N2+2OH-+4H2O。25℃时,反应进行10min,废水的pH由7变为12,这段时间内NO 的平均反应速率为
的平均反应速率为__ 。
(1)铋在元素周期表中的位置是
 Mc原子核内中子数与核外电子数之差为
Mc原子核内中子数与核外电子数之差为(2)已知:P(s,红磷)
 P(s,白磷)-17.6kJ;P(s,白磷)
P(s,白磷)-17.6kJ;P(s,白磷) P(s,黑磷)+39.3kJ。红磷、白磷、黑鳞互为
P(s,黑磷)+39.3kJ。红磷、白磷、黑鳞互为(3)SbCl3能发生较强的水解:Sb3++Cl-+H2O
 SbOCl↓+2H+。该水解反应的平衡常数表达式为
SbOCl↓+2H+。该水解反应的平衡常数表达式为(4)写出能够比较磷与砷最高价氧化物对应水化物酸性强弱的一个实验事实
(5)科学家发明了用H2治理废水中硝酸盐的污染的方法,其原理可以表示为:5H2+2NO

 N2+2OH-+4H2O。25℃时,反应进行10min,废水的pH由7变为12,这段时间内NO
N2+2OH-+4H2O。25℃时,反应进行10min,废水的pH由7变为12,这段时间内NO 的平均反应速率为
的平均反应速率为
您最近一年使用:0次
3 . 铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。
(1)生铁含有C、Si、Mn、S、P等元素,其中属于金属元素的除Fe外,还有_______ 元素。
(2)铁元素有三种常见的氧化物,分别是FeO、Fe2O3、Fe3O4。其中具有磁性的是____________ ,可作为红色颜料的是____________ 。
(3)某补铁口服液中含有Fe2+,为检验其是否被氧化变质,可取少量该口服液,向其中滴加KSCN溶液,若溶液变为____________ 色,则说明其已变质。向该口服液中加入维生素C可防止其被氧化变质,此过程中利用了维生素C的____________ 性。
(4)FeCl3可作为铜电路板的腐蚀液,其反应原理为Cu与FeCl3溶液反应生成FeCl2和CuCl2,该反应的化学方程式为____________ 。向反应后的溶液中加入____________ ,可回收Cu,并得到FeCl2溶液。
(1)生铁含有C、Si、Mn、S、P等元素,其中属于金属元素的除Fe外,还有
(2)铁元素有三种常见的氧化物,分别是FeO、Fe2O3、Fe3O4。其中具有磁性的是
(3)某补铁口服液中含有Fe2+,为检验其是否被氧化变质,可取少量该口服液,向其中滴加KSCN溶液,若溶液变为
(4)FeCl3可作为铜电路板的腐蚀液,其反应原理为Cu与FeCl3溶液反应生成FeCl2和CuCl2,该反应的化学方程式为
您最近一年使用:0次
2019-10-31更新
|
343次组卷
|
2卷引用:重庆市2019年普通高中学业水平合格性模拟考试化学试题



