1 . 我国的歼-20战机使用了大量的钛金属, 是生产钛的重要中间原料,实验室用如下装置制备
是生产钛的重要中间原料,实验室用如下装置制备 (夹持装置略去)。
(夹持装置略去)。 溶液反应产生黑色金属钯。
溶液反应产生黑色金属钯。
②有关物质的性质。
请回答下列问题:
(1)装置A中a的作用是_______ ,A中制 的离子方程式为
的离子方程式为_______ 。
(2)装置C中的药品为_______ ,装置E用冰盐水浴的目的是_______ 。
(3)装置D中发生两个反应,其中副反应为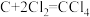 ,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式
,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式_______ 。
(4)进一步提纯E中产物的方法是_______(填编号)。
(5)测定产品纯度:准确量取3.4g产品,配成250mL含 的溶液,取25.00mL该溶液,加入还原剂将
的溶液,取25.00mL该溶液,加入还原剂将 全部转化为
全部转化为 ,再加入指示剂,用
,再加入指示剂,用 标准溶液滴定至终点,将
标准溶液滴定至终点,将 氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。
氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。
①滴定时所用的指示剂为_______ (填标号)。
A.酚酞溶液 B.甲基橙 C.KSCN溶液 D. 溶液
溶液
②产品中 的纯度为
的纯度为_______ 。
 是生产钛的重要中间原料,实验室用如下装置制备
是生产钛的重要中间原料,实验室用如下装置制备 (夹持装置略去)。
(夹持装置略去)。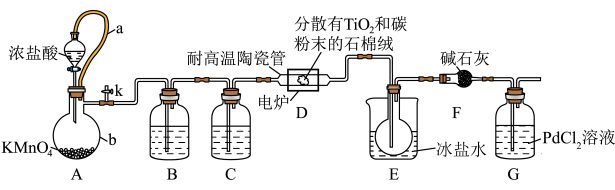
 溶液反应产生黑色金属钯。
溶液反应产生黑色金属钯。②有关物质的性质。
| 熔点/℃ | 沸点/℃ | 密度 | 水溶性 | |
 | -24 | 136.4 | 1.7 | 遇水极易水解,同时出现白雾 |
 | -23 | 76.8 | 1.6 | 难溶于水,与 互溶 互溶 |
(1)装置A中a的作用是
 的离子方程式为
的离子方程式为(2)装置C中的药品为
(3)装置D中发生两个反应,其中副反应为
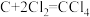 ,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式
,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式(4)进一步提纯E中产物的方法是_______(填编号)。
| A.过滤 | B.蒸发 | C.蒸馏 | D.分液 |
(5)测定产品纯度:准确量取3.4g产品,配成250mL含
 的溶液,取25.00mL该溶液,加入还原剂将
的溶液,取25.00mL该溶液,加入还原剂将 全部转化为
全部转化为 ,再加入指示剂,用
,再加入指示剂,用 标准溶液滴定至终点,将
标准溶液滴定至终点,将 氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。
氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。①滴定时所用的指示剂为
A.酚酞溶液 B.甲基橙 C.KSCN溶液 D.
 溶液
溶液②产品中
 的纯度为
的纯度为
您最近一年使用:0次
名校
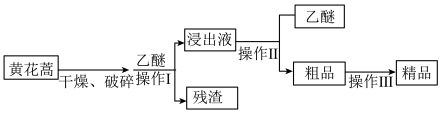
2 . Ⅰ.青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156—157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,提取青蒿素的方法之一是以萃取原理为基础,主要有乙醚萃取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:_______ (填序号)。_______ 。
(3)操作Ⅱ的名称是_______ 。操作Ⅲ的主要过程可能是_______ (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
Ⅱ.有机物M具有特殊香味,其完全燃烧的产物只有 和
和 。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:
。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:
步骤一:确定M的实验式和分子式。
(4)利用元素分析仪测得有机物M中碳的质量分数为54.5%,氢的质量分数为9.1%。
①M实验式为_______ 。
②已知M的密度是同温同压下 密度的2倍,则M的分子式为
密度的2倍,则M的分子式为_______ 。
步骤二:确定M的结构简式。
(5)用核磁共振仪测出M的核磁共振氢谱如图2所示,图中峰面积之比为 ;利用红外光谱仪测得M的红外光谱如图3所示。
;利用红外光谱仪测得M的红外光谱如图3所示。_______ 。
②M的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是____ (填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.X射线衍射仪
A. B.
B. C.
C.
(3)操作Ⅱ的名称是
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
Ⅱ.有机物M具有特殊香味,其完全燃烧的产物只有
 和
和 。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:
。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:步骤一:确定M的实验式和分子式。
(4)利用元素分析仪测得有机物M中碳的质量分数为54.5%,氢的质量分数为9.1%。
①M实验式为
②已知M的密度是同温同压下
 密度的2倍,则M的分子式为
密度的2倍,则M的分子式为步骤二:确定M的结构简式。
(5)用核磁共振仪测出M的核磁共振氢谱如图2所示,图中峰面积之比为
 ;利用红外光谱仪测得M的红外光谱如图3所示。
;利用红外光谱仪测得M的红外光谱如图3所示。
②M的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.X射线衍射仪
您最近一年使用:0次
名校
解题方法
3 . 高铁酸钠 微溶于
微溶于 溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生
溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生 。某化学兴趣小组利用如图所示装置(夹持装置略),制取
。某化学兴趣小组利用如图所示装置(夹持装置略),制取 并探究有关性质。回答下列问题:
并探究有关性质。回答下列问题:___________ 。
(2)检查装置B气密性的方法:关闭 ,
, ,
,___________ ,则装置气密性良好。
(3)盛放氯酸钾的仪器名称为___________ ,装置B中试剂的作用为___________ 。
(4)装置C中产生 的离子方程式为
的离子方程式为___________ 。
(5)充分反应后,将装置C中所得混合物经净化处理后得到产品 ,进行如下性质探究:
,进行如下性质探究:
①净水作用:取适量样品溶于蒸馏水后,用一束光照射出现丁达尔效应,用离子方程式解释该出现该现象的原因:___________ 。
②强氧化性:将样品溶于 制成稀溶液,取该溶液滴入
制成稀溶液,取该溶液滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,证明氧化性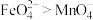 。判断该实验设计是否合理并说明理由:
。判断该实验设计是否合理并说明理由:___________ 。
 微溶于
微溶于 溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生
溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生 。某化学兴趣小组利用如图所示装置(夹持装置略),制取
。某化学兴趣小组利用如图所示装置(夹持装置略),制取 并探究有关性质。回答下列问题:
并探究有关性质。回答下列问题: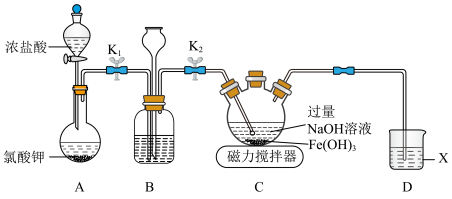
(2)检查装置B气密性的方法:关闭
 ,
, ,
,(3)盛放氯酸钾的仪器名称为
(4)装置C中产生
 的离子方程式为
的离子方程式为(5)充分反应后,将装置C中所得混合物经净化处理后得到产品
 ,进行如下性质探究:
,进行如下性质探究:①净水作用:取适量样品溶于蒸馏水后,用一束光照射出现丁达尔效应,用离子方程式解释该出现该现象的原因:
②强氧化性:将样品溶于
 制成稀溶液,取该溶液滴入
制成稀溶液,取该溶液滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,证明氧化性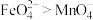 。判断该实验设计是否合理并说明理由:
。判断该实验设计是否合理并说明理由:
您最近一年使用:0次
名校
解题方法
4 . 按要求回答下列问题:
(1)A.乙烷 B.乙烯 C.乙炔 D.苯是有机化学中的代表物质,其中:
①既有 键又有
键又有 键的是
键的是_______ (填序号,下同)。
②碳碳键的键长由大到小排序是:_______ 。
③上述分子中所有原子均在同一平面是:_______ 。
(2)含硫元素的微粒有很多,例如 、
、 、
、 、
、 、
、 ,其中
,其中 的分子结构如下图所示,像一顶皇冠,请回答下列问题:
的分子结构如下图所示,像一顶皇冠,请回答下列问题: 中含有的
中含有的 键数目是
键数目是_______ 。
② 中S原子的杂化轨道类型是
中S原子的杂化轨道类型是_______ , 的空间结构是
的空间结构是_______ 。
③ 分子的VSEPR模型是
分子的VSEPR模型是_______ , 是
是_______ (填“极性”或“非极性”)分子。
④沸点:
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是_______ 。
(1)A.乙烷 B.乙烯 C.乙炔 D.苯是有机化学中的代表物质,其中:
①既有
 键又有
键又有 键的是
键的是②碳碳键的键长由大到小排序是:
③上述分子中所有原子均在同一平面是:
(2)含硫元素的微粒有很多,例如
 、
、 、
、 、
、 、
、 ,其中
,其中 的分子结构如下图所示,像一顶皇冠,请回答下列问题:
的分子结构如下图所示,像一顶皇冠,请回答下列问题: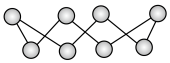
 中含有的
中含有的 键数目是
键数目是②
 中S原子的杂化轨道类型是
中S原子的杂化轨道类型是 的空间结构是
的空间结构是③
 分子的VSEPR模型是
分子的VSEPR模型是 是
是④沸点:

 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是
您最近一年使用:0次
解题方法
5 . 回答下列问题
(1)有下列物质① ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥ ,其中含非极性键的离子化合物有
,其中含非极性键的离子化合物有________ (用物质前的序号填空,下同),只含共价键的物质有______ ,熔化时只破坏范德华力的是____________ 。
(2)硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图,图2是硫元素的“价类二维图”,回答下列问题: 均为图1中的物质,写出X与Y反应的化学方程式
均为图1中的物质,写出X与Y反应的化学方程式__________ 。
②芒硝的化学式为_________ 。
③工业制硫酸时, 参与的化学方程式为
参与的化学方程式为______________ 。
(3)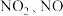 是大气污染物的主要成分,可以用
是大气污染物的主要成分,可以用 溶液吸收,当
溶液吸收,当 与
与 的体积比为
的体积比为 时,所得
时,所得 与
与 的物质的量之比为
的物质的量之比为_________ .用 也能处理
也能处理 和
和 ,反应原理如图所示,当
,反应原理如图所示,当 与
与 的物质的量之比为
的物质的量之比为 ,写出相应的化学方程式
,写出相应的化学方程式______ 。
(1)有下列物质①
 ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥ ,其中含非极性键的离子化合物有
,其中含非极性键的离子化合物有(2)硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图,图2是硫元素的“价类二维图”,回答下列问题:

 均为图1中的物质,写出X与Y反应的化学方程式
均为图1中的物质,写出X与Y反应的化学方程式②芒硝的化学式为
③工业制硫酸时,
 参与的化学方程式为
参与的化学方程式为(3)
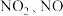 是大气污染物的主要成分,可以用
是大气污染物的主要成分,可以用 溶液吸收,当
溶液吸收,当 与
与 的体积比为
的体积比为 时,所得
时,所得 与
与 的物质的量之比为
的物质的量之比为 也能处理
也能处理 和
和 ,反应原理如图所示,当
,反应原理如图所示,当 与
与 的物质的量之比为
的物质的量之比为 ,写出相应的化学方程式
,写出相应的化学方程式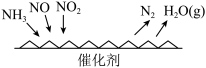
您最近一年使用:0次
名校
6 . 硅、硫、氮是重要的非金属元素,请根据题意回答问题。
(1)大气污染物主要成分包括:SO2、NO2、CO、可吸入颗粒物等,主要来源于燃煤、机动车尾气和工业废气。
①其中SO2、NO2能形成酸雨,酸雨的pH<_____ ,SO2型酸雨久置后溶液的pH会_____ (填“增大”、“减小”、“不变”),NO2能形成酸雨的原因是(用化学方程式表示):_____ 。
②SO2在人们的生活也担任着重要的角色,其中SO2、H2O2、浓硝酸均具有漂白作用,其漂白原理与其他物质不同的是:_____ 。
(2)SiO2可用于制作光导纤维,但遇强碱溶液会发生“断路”现象,其原因是:_____ (用离子方程式表示)
(3)硝酸盐受热亦会发生分解且复杂,某学习小组对Cu(NO3)2的分解产生了兴趣,已知Cu(NO3)2受热分解的化学方程式为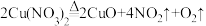 ,将少量Cu(NO3)2固体放入试管中,然后用带火星的木条放入试管中,发现木条复燃,针对此现象下列分析合理的是_____。
,将少量Cu(NO3)2固体放入试管中,然后用带火星的木条放入试管中,发现木条复燃,针对此现象下列分析合理的是_____。
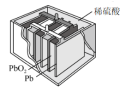
(4)铅酸蓄电池是我们生活中常见的二次电池,其结构示意图如下,电池工作时正极的电极方程式为:_____ 。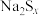 )分别作为两个电极的反应物,
)分别作为两个电极的反应物,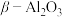 陶瓷(可传导
陶瓷(可传导 )为电解质,装置示意图如下,请写出负极的电极方程式:
)为电解质,装置示意图如下,请写出负极的电极方程式:_____
(1)大气污染物主要成分包括:SO2、NO2、CO、可吸入颗粒物等,主要来源于燃煤、机动车尾气和工业废气。
①其中SO2、NO2能形成酸雨,酸雨的pH<
②SO2在人们的生活也担任着重要的角色,其中SO2、H2O2、浓硝酸均具有漂白作用,其漂白原理与其他物质不同的是:
(2)SiO2可用于制作光导纤维,但遇强碱溶液会发生“断路”现象,其原因是:
(3)硝酸盐受热亦会发生分解且复杂,某学习小组对Cu(NO3)2的分解产生了兴趣,已知Cu(NO3)2受热分解的化学方程式为
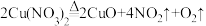 ,将少量Cu(NO3)2固体放入试管中,然后用带火星的木条放入试管中,发现木条复燃,针对此现象下列分析合理的是_____。
,将少量Cu(NO3)2固体放入试管中,然后用带火星的木条放入试管中,发现木条复燃,针对此现象下列分析合理的是_____。| A.NO2能支持燃烧 |
| B.无法确定NO2是否支持燃烧 |
| C.产物中有氧气,所以木条复燃 |
| D.NO2肯定不支持燃烧 |
(4)铅酸蓄电池是我们生活中常见的二次电池,其结构示意图如下,电池工作时正极的电极方程式为:
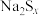 )分别作为两个电极的反应物,
)分别作为两个电极的反应物,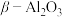 陶瓷(可传导
陶瓷(可传导 )为电解质,装置示意图如下,请写出负极的电极方程式:
)为电解质,装置示意图如下,请写出负极的电极方程式: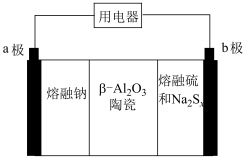
您最近一年使用:0次
名校
7 . 化学反应中会伴随放热和吸热的现象,请回答下列问题:
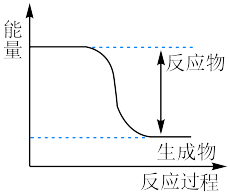
在人体内,O2与葡萄糖反应生成H2O和CO2的能量变化如图所示:___________ (填“放热”或“吸热”)反应,断开氧气分子中的化学键会___________ (填“放出”或“吸收”)能量,形成H-O键会___________ (填“放出”或“吸收”)能量,反应物的总能量___________ (填“大于”、“小于”或“等于”)生成物的总能量。
(2)某同学进行如下实验,研究化学反应中的热量变化。___________ (填“放热”或“吸热”)反应,Ba(OH)2·8H2O与NH4Cl的反应是___________ (填“放热”或“吸热”)反应。
(3)①中反应的离子方程式为___________ ,该反应的还原剂是___________ (填化学式)。
在人体内,O2与葡萄糖反应生成H2O和CO2的能量变化如图所示:
(2)某同学进行如下实验,研究化学反应中的热量变化。
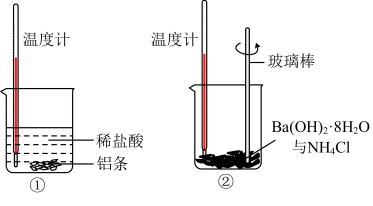
(3)①中反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 依据原子结构知识回答下列问题。
(1)基态Cr原子的电子排布式是___________ 。
(2)下列有关微粒性质的排列顺序错误的是___________。
(3)下列硼原子电子排布图表示的状态中,能量最高的为___________(填选项字母)。
(4)O的基态原子核外电子空间运动状态有___________ 种,其原子半径___________  (填“大于”或“小于”)。
(填“大于”或“小于”)。
(1)基态Cr原子的电子排布式是
(2)下列有关微粒性质的排列顺序错误的是___________。
A.元素的电负性: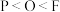 | B.元素的第一电离能: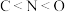 |
C.离子半径: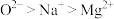 | D.原子的未成对电子数: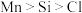 |
(3)下列硼原子电子排布图表示的状态中,能量最高的为___________(填选项字母)。
A. | B.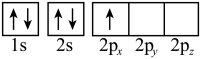 |
C.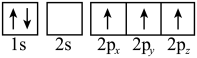 | D.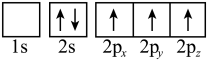 |
(4)O的基态原子核外电子空间运动状态有
 (填“大于”或“小于”)。
(填“大于”或“小于”)。
您最近一年使用:0次
名校
解题方法
9 . 元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。如表是元素周期表的一部分,数字①~⑨代表前四周期的九种主族元素。请按题目要求回答下列问题:______ ;元素①有 H、D、T三种质子数相同,中子数不同的核素,它们互称为
H、D、T三种质子数相同,中子数不同的核素,它们互称为______ ,物质DT属于______ (选填“单质”、“化合物”)。
(2)元素①与元素②可形成10电子分子和18电子分子,写出该18电子分子转化成10电子分子的化学方程式:_______ 。
(3)元素②的简单氢化物与⑧的单质反应的离子方程式为_______ 。
(4)③、④、⑤、⑦简单离子的半径由大到小的顺序是______ (用离子符号作答)。
(5)④、⑤、⑧三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是______ (用化学式作答)。
(6)元素⑨的氢化物可与H2O反应生成一种碱和一种单质,该单质的化学式为______ 。
(7)某小组同学设计实验比较VIIA族元素的非金属性:Cl>Br>I
甲同学设计实验如图1所示:打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙黄色,湿润的淀粉KI试纸变蓝,已知:常温下浓盐酸与高锰酸钾反应生成氯气。
①上述______ (选填“甲同学”、“乙同学”或“两位同学”)的实验能证明非金属性:Cl>Br>I。
②除了利用卤素单质间的置换反应,下列可作为卤族元素非金属性递变规律的判断依据有______ 。
A.Cl2、Br2、I2的熔点逐渐升高 B.HCl、HBr、HI的稳定性逐渐减弱
C.HCl、HBr、HI水溶液的酸性逐渐增强 D.Cl-、Br-、I-的还原性逐渐增强

 H、D、T三种质子数相同,中子数不同的核素,它们互称为
H、D、T三种质子数相同,中子数不同的核素,它们互称为(2)元素①与元素②可形成10电子分子和18电子分子,写出该18电子分子转化成10电子分子的化学方程式:
(3)元素②的简单氢化物与⑧的单质反应的离子方程式为
(4)③、④、⑤、⑦简单离子的半径由大到小的顺序是
(5)④、⑤、⑧三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是
(6)元素⑨的氢化物可与H2O反应生成一种碱和一种单质,该单质的化学式为
(7)某小组同学设计实验比较VIIA族元素的非金属性:Cl>Br>I
甲同学设计实验如图1所示:打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙黄色,湿润的淀粉KI试纸变蓝,已知:常温下浓盐酸与高锰酸钾反应生成氯气。

①上述
②除了利用卤素单质间的置换反应,下列可作为卤族元素非金属性递变规律的判断依据有
A.Cl2、Br2、I2的熔点逐渐升高 B.HCl、HBr、HI的稳定性逐渐减弱
C.HCl、HBr、HI水溶液的酸性逐渐增强 D.Cl-、Br-、I-的还原性逐渐增强
您最近一年使用:0次
2024-04-08更新
|
432次组卷
|
2卷引用:重庆市第一中学校2023-2024学年高一下学期3月定时练习化学试题
名校
解题方法
10 . 卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
(1) 的离子结构示意图为
的离子结构示意图为______ 。
(2)卤素单质有着相似的化学性质,但同时也有差别。比如 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: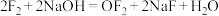 。其中
。其中 的电子式为
的电子式为______ ,用电子式描述NaF的形成过程:______ 。
(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性______ (填“大于”或“小于”)HI的稳定性,AgAt______ (填“易”或“难”)溶于水。
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。
① 与水反应的产物可能为
与水反应的产物可能为______ (填化学式)。
②下列说法不正确的是______ 。
A.HF、HCl、HBr的沸点依次升高
B. 沸点依次升高
沸点依次升高
C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D. (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(1)
 的离子结构示意图为
的离子结构示意图为(2)卤素单质有着相似的化学性质,但同时也有差别。比如
 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: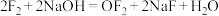 。其中
。其中 的电子式为
的电子式为(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如
 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。①
 与水反应的产物可能为
与水反应的产物可能为②下列说法不正确的是
A.HF、HCl、HBr的沸点依次升高
B.
 沸点依次升高
沸点依次升高C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D.
 (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
您最近一年使用:0次
2024-04-04更新
|
197次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一下学期3月月考化学试题



