1 . 赤铜矿(主要成分为 ,含少量
,含少量 、
、 )含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备
)含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备 晶体的流程为:
晶体的流程为: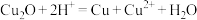
(1) 晶体结构如下图所示。晶体中存在的作用力包括离子键、
晶体结构如下图所示。晶体中存在的作用力包括离子键、_______ 。_______ 。 发生反应的离子方程式为
发生反应的离子方程式为_______ 。检验氧化完全的试剂为_______ (填化学式)。
(4)沉铁。离子浓度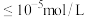 时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则
时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则 的
的 为
为_______ 。
(5)试从产率、试剂选择角度评价该制备流程并提出修改建议_______ 。
 ,含少量
,含少量 、
、 )含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备
)含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备 晶体的流程为:
晶体的流程为:
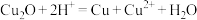
(1)
 晶体结构如下图所示。晶体中存在的作用力包括离子键、
晶体结构如下图所示。晶体中存在的作用力包括离子键、

 发生反应的离子方程式为
发生反应的离子方程式为(4)沉铁。离子浓度
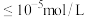 时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则
时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则 的
的 为
为(5)试从产率、试剂选择角度评价该制备流程并提出修改建议
您最近一年使用:0次
2 . 乙二胺四乙酸铁钠(化学式 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。
已知:① 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为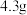 。
。
②乙二胺四乙酸( ,用
,用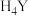 表示)是一种弱酸。
表示)是一种弱酸。
Ⅰ.制备
实验室用铁屑制备 的主要流程如下:
的主要流程如下:___________
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量 ,过程中浓度减少的离子有
,过程中浓度减少的离子有___________ (填离子符号)。
(3)“制备”步骤,向氧化所得的 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。
①从反应后的混合物中获得较高产率的 粗品的实验操作是,
粗品的实验操作是,___________ ,过滤,水洗,干燥。检验 是否洗净的试剂是
是否洗净的试剂是___________
②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是___________ 。
样品中乙二胺四乙酸铁钠纯度可用 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为 发生反应:
发生反应: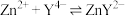 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
(4)补充完整实验方案:准确称取 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:___________ 。
 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。已知:①
 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为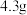 。
。②乙二胺四乙酸(
 ,用
,用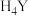 表示)是一种弱酸。
表示)是一种弱酸。Ⅰ.制备

实验室用铁屑制备
 的主要流程如下:
的主要流程如下:
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量
 ,过程中浓度减少的离子有
,过程中浓度减少的离子有(3)“制备”步骤,向氧化所得的
 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。①从反应后的混合物中获得较高产率的
 粗品的实验操作是,
粗品的实验操作是, 是否洗净的试剂是
是否洗净的试剂是②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液
 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是
样品中乙二胺四乙酸铁钠纯度可用
 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为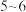 发生反应:
发生反应: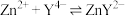 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。(4)补充完整实验方案:准确称取
 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:
您最近一年使用:0次
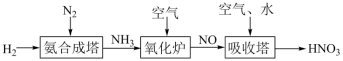
3 . 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题: 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。
(2)氨气在氧化炉中发生反应的化学方程式为___________ 。
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为___________ 。
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为___________ 。
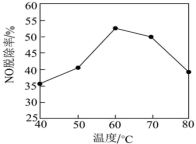
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是___________ 。
 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。A.工业合成 需要在高温、高压、催化剂下进行 需要在高温、高压、催化剂下进行 |
B. 可用来生产碳铵和尿素等化肥 可用来生产碳铵和尿素等化肥 |
C. 可用浓硫酸或无水氯化钙干燥 可用浓硫酸或无水氯化钙干燥 |
D. 受热易分解,须置于冷暗处保存 受热易分解,须置于冷暗处保存 |
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成
 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是
您最近一年使用:0次
解题方法
4 . 某化学兴趣小组为探究 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题:_______ ,A中发生反应的化学方程式为_______ 。
(2)B中出现淡黄色沉淀,则证明 具有
具有______ 性,发生反应的化学方程式为______ 。
(3)装置B、C、D中能够证明 具有还原性的是
具有还原性的是____ (填字母),观察到的现象为____ 。
(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:_______ (填“只有Cu”“只有 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为_______ 。
(5)在三颈烧瓶中加入 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取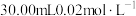 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
已知实验过程中发生的反应的计算关系式为: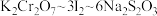 。则该样品的纯度为
。则该样品的纯度为_______ %(保留三位有效数字)。
 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题: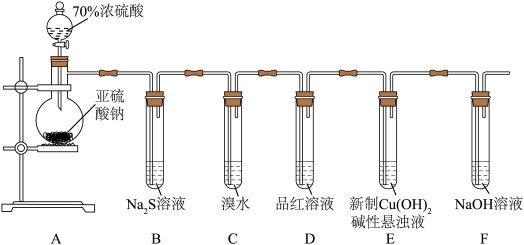
(2)B中出现淡黄色沉淀,则证明
 具有
具有(3)装置B、C、D中能够证明
 具有还原性的是
具有还原性的是(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:

 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为(5)在三颈烧瓶中加入
 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取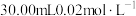 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。已知实验过程中发生的反应的计算关系式为:
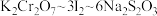 。则该样品的纯度为
。则该样品的纯度为
您最近一年使用:0次
解题方法
5 . “价—类”二维图是学习元素化合物的一种好方法。硫或氮及其化合物的部分“价—类”二维图如图所示,回答下列问题: ,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):
,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):_______ 。
(2)若B为 ,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸( ),该反应的化学方程式为
),该反应的化学方程式为_______ ;某厂废液中含有2%~5%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为
转化为 的是
的是_______ (填字母)。
A.NaOH B. C.
C. D.浓硫酸
D.浓硫酸
(4)D可以是 ,已知同温同压下,同体积的
,已知同温同压下,同体积的 与
与 (蒸气)的质量比为7:64,则x=
(蒸气)的质量比为7:64,则x=_____ 。
(5) 在空气中易变质,写出检验
在空气中易变质,写出检验 发生变质的实验方法:
发生变质的实验方法:_______ 。
(6)常温下,G的浓溶液可以用干燥的铁或铝制容器盛装,原因是_______ 。
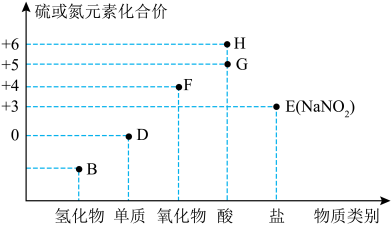
 ,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):
,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):(2)若B为
 ,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
,则下列关于氨气的性质和用途描述正确的是_______(填字母)。| A.氨气易液化;液氨可用作制冷剂 | B.可用排水法收集氨气 |
| C.氨气是一种无色、无味的气体 | D.向氨水中滴加酚酞,溶液变红 |
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(
 ),该反应的化学方程式为
),该反应的化学方程式为 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为
转化为 的是
的是A.NaOH B.
 C.
C. D.浓硫酸
D.浓硫酸(4)D可以是
 ,已知同温同压下,同体积的
,已知同温同压下,同体积的 与
与 (蒸气)的质量比为7:64,则x=
(蒸气)的质量比为7:64,则x=(5)
 在空气中易变质,写出检验
在空气中易变质,写出检验 发生变质的实验方法:
发生变质的实验方法:(6)常温下,G的浓溶液可以用干燥的铁或铝制容器盛装,原因是
您最近一年使用:0次
6 . 以软锰矿浆(含 及少量
及少量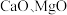 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。
(1)吸收 。
。
①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是_______ 。 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿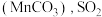 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是_______ 。
(2)净化 。
。
①过滤脱硫后的软锰矿浆液,用 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于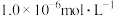 )。此时应控制溶液中
)。此时应控制溶液中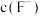 略大于
略大于_______  。(已知:
。(已知: 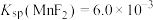 、
、 ,
, 、)
、)
②净化时生成的 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为_______ 。 。
。
①向反应器中加入 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:_______ 。
②实际生产中,常将 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入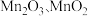 等,其原因是
等,其原因是_______ 。
 及少量
及少量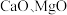 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。(1)吸收
 。
。①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的
 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是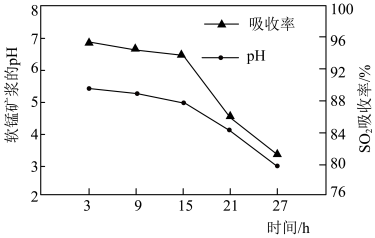
 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿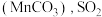 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是(2)净化
 。
。①过滤脱硫后的软锰矿浆液,用
 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于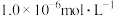 )。此时应控制溶液中
)。此时应控制溶液中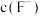 略大于
略大于 。(已知:
。(已知: 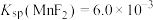 、
、 ,
, 、)
、)②净化时生成的
 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为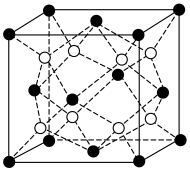
 。
。①向反应器中加入
 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:②实际生产中,常将
 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入 等,其原因是
等,其原因是
您最近一年使用:0次
7日内更新
|
236次组卷
|
2卷引用:江苏省苏锡常镇四市2024届高三下学期教学情况调研(二)(二模)化学试题
解题方法
7 . 试运用所学的电化学知识回答下列问题:
(1)①请设计一个原电池,可自发进行反应: ,该电池的两电极分别为铜棒、银棒,请画出该实验的装置示意图:
,该电池的两电极分别为铜棒、银棒,请画出该实验的装置示意图:_______ 。该电池中,电子的流向为_______ 。
②该电化学装置的能量变化形式为_______ 。若开始时两电极质量相等,当电路中转移0.2mol电子时,理论上两电极的质量差为_______ g。
(2)科学家用氮化镓材料与铜组装成如图所示的人工光合系统实现 的再利用。电池的总反应为
的再利用。电池的总反应为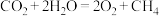 (已知:质子交换膜仅允许
(已知:质子交换膜仅允许 通过)。
通过)。_______ (填“GaN”或“Cu”)。
②该电池的Cu电极上发生的电极反应为_______ 。
③生成 ,消耗
,消耗 的物质的量为
的物质的量为_______ mol。
(1)①请设计一个原电池,可自发进行反应:
 ,该电池的两电极分别为铜棒、银棒,请画出该实验的装置示意图:
,该电池的两电极分别为铜棒、银棒,请画出该实验的装置示意图:②该电化学装置的能量变化形式为
(2)科学家用氮化镓材料与铜组装成如图所示的人工光合系统实现
 的再利用。电池的总反应为
的再利用。电池的总反应为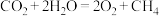 (已知:质子交换膜仅允许
(已知:质子交换膜仅允许 通过)。
通过)。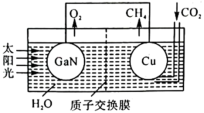
②该电池的Cu电极上发生的电极反应为
③生成
 ,消耗
,消耗 的物质的量为
的物质的量为
您最近一年使用:0次
名校
8 . 目前世界上60%的镁是从海水中提取的,下面是提取镁的流程图: 的熔点为712℃。
的熔点为712℃。
(1)从海水中获取淡水最常用的方法是___________ 。
(2)操作A是___________ ,试剂a为___________ (填化学式)。
(3)由无水 制取金属镁的化学方程式为
制取金属镁的化学方程式为___________ ,该反应中___________ (填元素符号)得电子被还原。
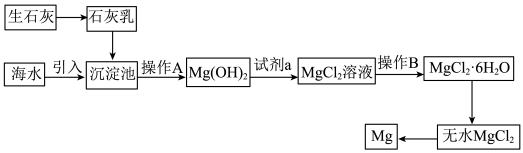
 的熔点为712℃。
的熔点为712℃。(1)从海水中获取淡水最常用的方法是
(2)操作A是
(3)由无水
 制取金属镁的化学方程式为
制取金属镁的化学方程式为
您最近一年使用:0次
9 . 烃是一类重要有机化合物,回答下列有关问题。
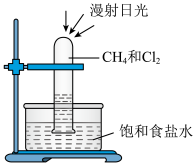
(1)甲烷分子的空间构型是_______ 。甲烷与氯气光照下反应生成产物共 ____ 种。
(2)甲烷和氯气在光照条件下发生取代反应的装置如图所示。______ 。
(3)下列各烷烃的沸点由低到高的顺序为_____(用序号表示)。
(4) 某烷烃完全燃烧时消耗氧气的物质的量为
某烷烃完全燃烧时消耗氧气的物质的量为 ,其化学式为
,其化学式为________ ,若其结构中含有 个
个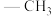 ,其结构简式为
,其结构简式为_______ 。
(5)聚乙烯可用于制造食品包装袋,由乙烯制备聚乙烯的化学方程式为_______ 。写出丙烯CH3CH=CH2发生加聚反应的化学方程式:______ 。
(1)甲烷分子的空间构型是
(2)甲烷和氯气在光照条件下发生取代反应的装置如图所示。
(3)下列各烷烃的沸点由低到高的顺序为_____(用序号表示)。
| A.异丁烷 | B.异戊烷 | C.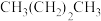 | D. |
 某烷烃完全燃烧时消耗氧气的物质的量为
某烷烃完全燃烧时消耗氧气的物质的量为 ,其化学式为
,其化学式为 个
个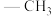 ,其结构简式为
,其结构简式为(5)聚乙烯可用于制造食品包装袋,由乙烯制备聚乙烯的化学方程式为
您最近一年使用:0次
10 . 某化学实验小组同学利用如图所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。___________ ;干燥氨气常用的干燥剂是___________ 。
(2)收集氨气时,请你选择氨气的进气口___________ (填“a”或“b”),理由是___________ 。
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是___________ 。
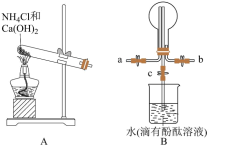
(2)收集氨气时,请你选择氨气的进气口
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是
您最近一年使用:0次



