名校
解题方法
1 . 完成下列问题。
(1)实验室用碳酸钙与盐酸反应制取 气体,反应的离子方程式为
气体,反应的离子方程式为___________ ,常用澄清石灰水检验 气体的离子方程式为
气体的离子方程式为___________ 。
(2)将表面附有铁锈(主要成分为 )的铁钉放入稀硫酸中一段时间,开始反应的离子方程式为
)的铁钉放入稀硫酸中一段时间,开始反应的离子方程式为___________ ;反应片刻后,可观察到有气体产生,其离子方程式为___________ 。
(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片( )治疗胃酸过多的离子方程式为
)治疗胃酸过多的离子方程式为___________ 。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是 ],反应的离子方程式为
],反应的离子方程式为___________ 。
(1)实验室用碳酸钙与盐酸反应制取
 气体,反应的离子方程式为
气体,反应的离子方程式为 气体的离子方程式为
气体的离子方程式为(2)将表面附有铁锈(主要成分为
 )的铁钉放入稀硫酸中一段时间,开始反应的离子方程式为
)的铁钉放入稀硫酸中一段时间,开始反应的离子方程式为(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(
 )治疗胃酸过多的离子方程式为
)治疗胃酸过多的离子方程式为②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是
 ],反应的离子方程式为
],反应的离子方程式为
您最近一年使用:0次
2023-08-23更新
|
226次组卷
|
8卷引用:江苏省启东市2020-2021学年高一上学期期中考试化学试题
名校
2 . 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式_______ (如果系数是1,不用填写):

(2)整个过程中的还原剂是_______ 。
(3)把KI换成KBr,则CCl4层变为_______ 色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_______ 。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)500kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2_______ L(标准状况,保留2位小数)。
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式

(2)整个过程中的还原剂是
(3)把KI换成KBr,则CCl4层变为
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)500kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2
您最近一年使用:0次
2023-04-26更新
|
297次组卷
|
3卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
名校
解题方法
3 . 下列物质中,互为同系物的有_______ ,互为同分异构体的有_______ ,互为同素异形体的有_______ ,属于同位素的有_______ ,是同一种物质的有_______ 。
①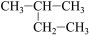 ②白磷 ③2,3-二甲基丁烷 ④
②白磷 ③2,3-二甲基丁烷 ④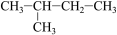 ⑤
⑤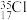 ⑥红磷⑦
⑥红磷⑦ ⑧
⑧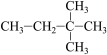
①
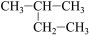 ②白磷 ③2,3-二甲基丁烷 ④
②白磷 ③2,3-二甲基丁烷 ④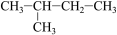 ⑤
⑤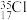 ⑥红磷⑦
⑥红磷⑦ ⑧
⑧
您最近一年使用:0次
2022-12-09更新
|
286次组卷
|
3卷引用:2020年人教版高二化学选修5有机化学第二章《烃和卤代烃》练习3-1
名校
解题方法
4 . 常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____ (填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是___ 。
(2)溶液②呈______ (填“酸”“碱”或“中”)性。其原因是___ (用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是____ (填字母)。
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)______ (填“>”“<”或“=”,下同)c( ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3)____ c( )
)
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH
(2)溶液②呈
(3)下列有关①和②两种溶液的说法正确的是
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)
 ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3) )
)
您最近一年使用:0次
2022-12-05更新
|
581次组卷
|
9卷引用:江苏省海安市2020-2021学年高二上学期期中考试化学试题
江苏省海安市2020-2021学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)云南省通海县一中2020-2021学年高二下学期期中考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)【石家庄新东方】2021-2022石家庄23中高二10月月考化学试题辽宁省朝阳市建平县高级中学2021-2022学年高二上学期第二次月考化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题
14-15高二上·湖北荆州·期末
名校
解题方法
5 . NH4Al(SO4)2常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______ (用离子方程式说明)。
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c( )
)_______ (填“等于”“大于”或“小于”)0.1mol∙L-1NH4HSO4溶液中的c( )。
)。
(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。
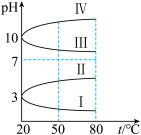
①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字),导致NH4Al(SO4)2溶液的pH随温度变化的原因是_______ 。
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c c
c 3cAl3=
3cAl3=_______ molL1。
(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是_______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是_______ 。
(1)NH4Al(SO4)2可作净水剂,其原理是
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c(
 )
) )。
)。(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c
 c
c 3cAl3=
3cAl3=(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
2022-12-01更新
|
1390次组卷
|
57卷引用:【全国百强校】江苏省扬州中学2018-2019学年高二第二学期五月检测化学试题
【全国百强校】江苏省扬州中学2018-2019学年高二第二学期五月检测化学试题江苏省南通市海门实验学校2020-2021学年高二上学期期中考试化学试题(已下线)2013-2014学年湖北省荆州市部分县市高二上学期期末考试化学试卷(已下线)2014届山西省山大附中高三下学期第一次月考化学试卷2016-2017学年内蒙古包头九中高二上10月月考化学卷2016-2017学年四川省成都七中高二上11月考试化学卷2015—2016学年河南省郑州一中高二上学期期末考试化学试卷湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题河北省永年县第二中学2017-2018学年高二12月月考化学试题宁夏育才中学2017-2018学年高二上学期期末考试化学试题湖北省宜昌市第一中学2017-2018学年高二上学期期末考试化学试题高二人教版选修4 期末学业测评(一)山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题(已下线)2019年1月5日 《每日一题》人教选修4-周末培优吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题(已下线)2019年10月13日《每日一题》2020年高考一轮复习——每周一测四川省武胜烈面中学校2019-2020学年高二上学期期中考试化学试题苏教版选修四化学反应原理专题3第三单元 盐类的水解 同步检测试卷(已下线)考点14 化学基本理论——《备战2020年高考精选考点专项突破题集》(已下线)2019年12月30日 《每日一题》人教版(选修4)——盐类水解的影响因素河北省沧州市泊头市第一中学2019-2020学年高二上学期第三次月考化学试题山东省淄博市2019-2020学年高二上学期期中考试化学试题四川省成都市射洪县2018-2019学年高二下学期期末能力素质监测理综化学试题(英才班)山西省晋中市祁县中学校2019-2020学年高二11月月考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时3 水解平衡的移动和水解原理的应用河南省南阳市第一中学2021届高三上学期第二次月考(9月)化学试题高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时2 盐类水解的影响因素及应用(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)浙江省苍南县金乡卫城中学2020-2021学年高二上学期第一次月考化学试题(已下线)3.3.2 影响盐类水解的主要因素和盐类水解的应用(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)湖北省黄石市有色第一中学2020-2021学年高二上学期期末考试化学试题福建省莆田锦江中学2020-2021学年高二上学期期末考试化学试题(已下线)第25讲 盐类水解(精练)-2022年高考化学一轮复习讲练测选择性必修1 专题3 第三单元 课时2 盐类水解的影响因素及应用安徽省皖南八校2022届高三上学期摸底联考化学试题(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第23讲 盐类水解(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)(已下线)3.3.3 盐类水解的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.3.2 影响盐类水解的主要因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第15练 反应原理综合-2022年【寒假分层作业】高二化学(人教版2019选择性必修2)辽宁省渤海大学附属高级中学2021-2022学年高二上学期期中考试化学试题四川省资阳中学2021-2022学年高二下学期3月月考化学试题山西省运城市教育发展联盟2021-2022学年高二上学期11月期中检测化学试题(已下线)3.3.2 影响盐类的水解的主要因素-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)第20讲 盐类水解的影响因素及应用(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题(已下线)专题十三水溶液中的离子平衡四川省成都市树德中学2022-2023学年高二上学期期末考试化学试题四川省宜宾市第四中学校2022-2023学年高二下学期开学考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第49练 盐类的水解(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)广东省广州市华南师范大学附属中学2022-2023学年高二上学期12月月考化学试题(已下线)盐类的水解黑龙江省大庆铁人中学2023-2024学年高二上学期期中考试化学试题山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷
2017高二·全国·课时练习
名校
解题方法
6 . 某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
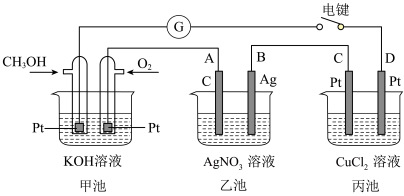
请回答下列问题:
(1)甲池为____ (填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为___ 。
(2)乙池中A(石墨)电极的名称为____ (填“正极”“负极”“阴极”或“阳极”),乙池总反应式为____ 。
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为____ mL(标准状况下),丙池中____ 极析出____ g铜。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将____ (填“增大”“减小”或“不变”);丙中溶液的pH将___ (填“增大”“减小”或“不变”)。

请回答下列问题:
(1)甲池为
(2)乙池中A(石墨)电极的名称为
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将
您最近一年使用:0次
2022-10-27更新
|
1566次组卷
|
26卷引用:4.3.2 电解原理的应用
(已下线)4.3.2 电解原理的应用高中化学人教版 选修四 第四章 电化学基础 第三节 电解池 电解池第二课时(电解原理的应用)(已下线)解密09 电化学(教师版)——备战2018年高考化学之高频考点解密2018-2019学年人教版高中化学选修四电化学基础章末综合测评题(四)【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学2018-2019学年高二上学期期末考试化学试题甘肃省兰州市第五十八中学2018-2019学年高二(理科)第一学期期末考试化学试题云南省勐海县第三中学2019-2020学年高二上学期期末考试化学试题2020届高考化学二轮复习大题精准训练——高考大题中方程式(电极、氧化还原、热化学)书写专练2020届高考化学二轮复习大题精准训练 ——原电池、电解池填空题甘肃省天水市第一中学2019-2020学年高二上学期期末考试化学试题河南省平顶山市鲁山县第一高级中学2019-2020学年高二3月月考化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 章末总结人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 章末总结河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷黑龙江省哈尔滨市第六中学2020-2021学年高二上学期期末考试化学试题黑龙江省龙西北地区八校2020-2021学年高二下学期3月联考化学试题(已下线)专题1 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)浙江省诸暨市2021-2022学年高二上学期期末考试化学试题河南省温县第一高级中学2021-2022学年高二下学期开学考试化学试题河南省南阳市第六完全学校高级中学2022-2023学年高二上学期9月半月考化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高二上学期12月月考化学试题(已下线)第六章 化学反应与能量 第39讲 多池、多室的电化学装置(已下线)专题突破卷07 化学反应与能量?-2024年高考化学一轮复习考点通关卷(新教材新高考)作业(二十五) 电解原理的应用
7 . 按要求回答下列问题:
(1)研究发现,在CO2低压合成甲醇反应CO2+3H2=CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布为___________ ;元素Mn与O中,第一电离能较大的是___________ ,基态原子核外未成对电子数较多的是___________ 。
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价层电子排布图为___________ 。
②元素的基态的气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第二周期部分元素的E1变化趋势如图所示。
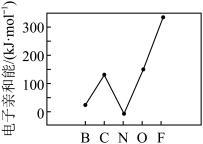
其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________ ,氮元素E1呈现异常的原因是___________ 。
(1)研究发现,在CO2低压合成甲醇反应CO2+3H2=CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布为
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价层电子排布图为
②元素的基态的气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第二周期部分元素的E1变化趋势如图所示。

其中除氮元素外,其他元素的E1自左而右依次增大的原因是
您最近一年使用:0次
2022-10-20更新
|
210次组卷
|
10卷引用:湖北省咸宁市嘉鱼县第一中学2019-2020学年高二下学期期末考试化学试题
湖北省咸宁市嘉鱼县第一中学2019-2020学年高二下学期期末考试化学试题常州市武进区礼嘉中学2021-2022学年高二下学期第二次阶段测试化学试题(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)广东省东莞市新世纪英才学校2021-2022学年高二上学期第一次教学质量检测化学试题(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)第一章 本章达标检测2河北省石家庄市第23中学2022-2023学年高二上学期第一次月考化学试题湖南省衡阳县第四中学 2022-2023学年高二下学期开学摸底考试(平行班)化学试题(已下线)第一章 原子结构与性质(B卷)
8 . H2O2在Fe2+、Cu2+的存在下生成具有强氧化性的·OH(羟基自由基),·OH可将有机物氧化降解。
(1)Cu2+-H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)= CuOOH+(aq)+H+(aq) ΔH1=a kJ·mol-1
CuOOH+(aq)=Cu+(aq)+·OH(aq)+ O2(g) ΔH2=b kJ·mol-1
O2(g) ΔH2=b kJ·mol-1
2CuOOH+(aq)=2Cu+(aq)+H2O2(aq)+O2(g) ΔH3=c kJ·mol-1
则H2O2(aq)=2·OH(aq) ΔH=________ kJ·mol-1。
(2)为探究Fe2+-Cu2+-H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图1所示。得出“Fe2+-Cu2+-H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为_______ 。
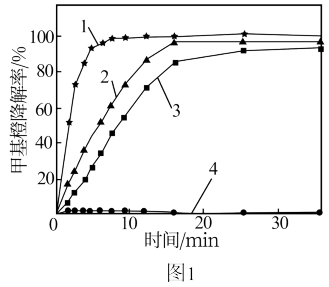
实验条件:200 mL甲基橙模拟废水(1.5 g·L-1,pH=3.0),温度60 ℃、V(H2O2)=2.0 mL
1—V(H2O2)∶m(FeSO4)∶m(CuSO4)=2∶0.02∶0.4
2—V(H2O2)∶m(FeSO4)∶m(CuSO4)=2∶0.02∶0
3—V(H2O2)∶m(FeSO4)∶m(CuSO4)=2∶0∶0.4
4—V(H2O2)∶m(FeSO4)∶m(CuSO4)=2∶0∶0
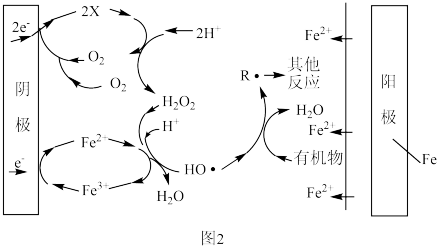
(3)EFH2O2FeOx法可用于水体中有机污染物降解,其反应机理如图2所示。阳极的电极反应式为______ ,X微粒的化学式为________ ,阴极附近Fe2+参与反应的离子方程式为_______ 。
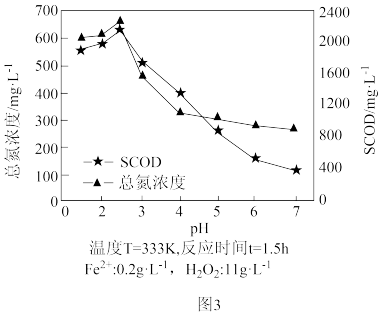
(4)SCOD是指溶解性化学需氧量,是衡量水中有机物质含量多少的指标。水体SCOD越大,说明其有机物含量越高。用Fe2+-H2O2法氧化破解啤酒工业污泥中的微生物,释放出有机物和氮等。测得不同初始pH下污泥经氧化破解后上层清液中的SCOD及总氮浓度如图3所示。当pH>2.5时,总氮浓度、SCOD均降低,其原因可能是__________ 。
(1)Cu2+-H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)= CuOOH+(aq)+H+(aq) ΔH1=a kJ·mol-1
CuOOH+(aq)=Cu+(aq)+·OH(aq)+
 O2(g) ΔH2=b kJ·mol-1
O2(g) ΔH2=b kJ·mol-12CuOOH+(aq)=2Cu+(aq)+H2O2(aq)+O2(g) ΔH3=c kJ·mol-1
则H2O2(aq)=2·OH(aq) ΔH=
(2)为探究Fe2+-Cu2+-H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图1所示。得出“Fe2+-Cu2+-H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为

实验条件:200 mL甲基橙模拟废水(1.5 g·L-1,pH=3.0),温度60 ℃、V(H2O2)=2.0 mL
1—V(H2O2)∶m(FeSO4)∶m(CuSO4)=2∶0.02∶0.4
2—V(H2O2)∶m(FeSO4)∶m(CuSO4)=2∶0.02∶0
3—V(H2O2)∶m(FeSO4)∶m(CuSO4)=2∶0∶0.4
4—V(H2O2)∶m(FeSO4)∶m(CuSO4)=2∶0∶0
(3)EFH2O2FeOx法可用于水体中有机污染物降解,其反应机理如图2所示。阳极的电极反应式为

(4)SCOD是指溶解性化学需氧量,是衡量水中有机物质含量多少的指标。水体SCOD越大,说明其有机物含量越高。用Fe2+-H2O2法氧化破解啤酒工业污泥中的微生物,释放出有机物和氮等。测得不同初始pH下污泥经氧化破解后上层清液中的SCOD及总氮浓度如图3所示。当pH>2.5时,总氮浓度、SCOD均降低,其原因可能是

您最近一年使用:0次
名校
解题方法
9 . 下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、 、CO2、CuO
、CO2、CuO
②HCl、 、
、 、
、
③NaOH、 、KOH、
、KOH、
(1)三种物质依次是(填化学式):A___________ ;B___________ ;C___________ 。
(2)这三种物质相互作用可生成一种新物质 ,该反应
,该反应___________ (填“是”或“不是”)氧化还原反应。
(3)写出物质C与足量稀硫酸反应的离子方程式___________ 。
(4) 与
与 、
、 在溶液中能大量共存吗
在溶液中能大量共存吗___________ ,?试用离子方程式说明: ___________ ,___________ 。
①MgO、
 、CO2、CuO
、CO2、CuO ②HCl、
 、
、 、
、
③NaOH、
 、KOH、
、KOH、
(1)三种物质依次是(填化学式):A
(2)这三种物质相互作用可生成一种新物质
 ,该反应
,该反应(3)写出物质C与足量稀硫酸反应的离子方程式
(4)
 与
与 、
、 在溶液中能大量共存吗
在溶液中能大量共存吗
您最近一年使用:0次
2022-01-07更新
|
421次组卷
|
9卷引用:2016-2017学年甘肃省天水一中高一上开学考试化学试卷
2016-2017学年甘肃省天水一中高一上开学考试化学试卷湖北省沙市中学2017-2018学年高一上学期第四次双周考试化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高一上学期第二次月考化学试题2018-2019学年人教版高中化学必修一:18-19 章末综合测评2 化学物质及其变化(已下线)第一章 总结与检测(测)——2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)江苏省泰州中学2022-2023学年高一上学期第一次月考化学试题宁夏青铜峡市高级中学2021-2022学年高一上学期11月测试化学试题辽宁省铁岭市清河高级中学2022-2023学年高一上学期第一次月考化学试题天津市耀华中学2022-2023学年高一上学期期中考试化学试题
名校
10 . 回答下列问题:
(1)在密闭容器中加入NaHCO3和NaOH的混合物共18.4g,加热至300℃,经充分反应后排出气体,冷却得到剩余固体质量为16.6g。试确定混合物的组成:m(NaHCO3)=__ g。
(2)为测定镁铝合金的成分,取13.5g合金全部溶于500mL3mol/L的H2SO4中,充分反应后,再加入400mL8mol/L的NaOH溶液,结果得到了白色沉淀和滤液B。
①滤液B中n(NaAlO2)=__ mol。
②若白色沉淀只有一种成分,则合金中镁的质量分数范围为__ 。
(1)在密闭容器中加入NaHCO3和NaOH的混合物共18.4g,加热至300℃,经充分反应后排出气体,冷却得到剩余固体质量为16.6g。试确定混合物的组成:m(NaHCO3)=
(2)为测定镁铝合金的成分,取13.5g合金全部溶于500mL3mol/L的H2SO4中,充分反应后,再加入400mL8mol/L的NaOH溶液,结果得到了白色沉淀和滤液B。
①滤液B中n(NaAlO2)=
②若白色沉淀只有一种成分,则合金中镁的质量分数范围为
您最近一年使用:0次



