名校
1 . 有机物具有广泛的用途。现有下列有机物:①乙烯 ②1,3-丁二烯 ③甲醛 ④油脂请将相应的序号 填入空格内。
(1)能用于制备肥皂的是_______ ;
(2)能用于制备聚乙烯塑料的是_______ ;
(3)能用于制备顺丁橡胶的是_______ ;
(4)能用于制备酚醛树脂的是_______ ;
(5)为室内主要污染物的有毒的是_______ 。
(1)能用于制备肥皂的是
(2)能用于制备聚乙烯塑料的是
(3)能用于制备顺丁橡胶的是
(4)能用于制备酚醛树脂的是
(5)为室内主要污染物的有毒的是
您最近一年使用:0次
2024-01-11更新
|
74次组卷
|
2卷引用:2018-2019学年度耀华实验学校第二学期高二实验化学期末试卷
2 . 某校化学兴趣小组同学猜想自来水中可能含有大量Cu2+、Ca2+、Mg2+和某些阴离子,从而进行了三组实验:
①取适量自来水于试管中,滴加足量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加足量的Na2CO3溶液,又有白色沉淀生成;
③另取适量自来水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请回答以下问题:
(1)不用做实验就可排除的离子是___________ 。
(2)通过实验可初步确定自来水中___________ (填“含有”或“不含有”)大量Ca2+、Mg2+;判断依据的离子方程式有___________ 。
(3)自来水中所含阴离子可以确定有___________ ,理由是___________ 。
(4)确定实验②中滴加的Na2CO3溶液已过量的检验方法是___________ 。
①取适量自来水于试管中,滴加足量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加足量的Na2CO3溶液,又有白色沉淀生成;
③另取适量自来水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请回答以下问题:
(1)不用做实验就可排除的离子是
(2)通过实验可初步确定自来水中
(3)自来水中所含阴离子可以确定有
(4)确定实验②中滴加的Na2CO3溶液已过量的检验方法是
您最近一年使用:0次
2023-10-08更新
|
165次组卷
|
19卷引用:第2章《元素与物质世界》期中复习检测试卷
第2章《元素与物质世界》期中复习检测试卷2019年10月16日《每日一题》2019-2020学年高一化学人教必修1——常见离子的检验辽宁省朝阳市柳城高中2019-2020学年高一上学期期中考试化学试题步步为赢 高一化学寒假作业:作业七 阶段检测(二)天津市西青区2019-2020学年高一上学期期末考试化学试题广东省揭阳市第三中学2020-2021学年高一上学期第一次阶段考化学试题(已下线)【浙江新东方】39天津市东丽区2020-2021学年高一上学期期末考试化学试题(已下线)专题3 从海水中获得的化学物质 综合评价-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)湖南师范大学附属中学2020-2021学年高一下学期期末考试化学试题天津市西青区杨柳青第一中学2021-2022学年高一下学期期末适应性测试化学试题云南省昆明市第十中学2021-2022学年高一上学期10月月考化学试题广东省梅州市兴宁市叶塘中学2021-2022学年高一上学期摸底考试化学试题贵州省贵阳市花溪第六中学2022-2023学年高一上学期期中考试化学试题安徽亳州市利辛县启明中学2022-2023学年高一上学期期末考试化学试题陕西省商洛市洛南中学2022-2023学年高一上学期12月月考化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高一上学期期中考试化学试题(已下线)BBWYhjhx1001.pdf新疆石河子第一中学2023-2024学年高一上学期9月月考化学试题
名校
解题方法
3 . H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L 的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L 的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率a1=___________ %,反应平衡常数K=___________ 。
(2)在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率a2___________ (填“>”“<”或“=”,下同)a1,该反应的ΔH___________ 0。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是___________(填字母)。
 COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L 的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L 的空钢瓶中,反应平衡后水的物质的量分数为0.02。(1)H2S的平衡转化率a1=
(2)在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率a2
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是___________(填字母)。
| A.H2S | B.CO2 |
| C.COS | D.N2 |
您最近一年使用:0次
2023-08-27更新
|
656次组卷
|
22卷引用:2018-2019学年鲁科版高中化学选修四:第2章检测题
2018-2019学年鲁科版高中化学选修四:第2章检测题山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题(已下线)2019年9月18日《每日一题》选修4—— 平衡转化率的判断山东省济南外国语学校三箭分校2019-2020学年高二上学期期中考试化学试题(已下线)专题7.3 化学平衡常数 化学反应进行的方向(练)-《2020年高考一轮复习讲练测》(已下线)专题7.3 化学平衡常数 化学反应进行的方向(讲)-《2020年高考一轮复习讲练测》(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度(已下线)易错13 化学反应速率和化学平衡计算-备战2021年高考化学一轮复习易错题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考山东省临沂市费县第二中学2020-2021学年高二上学期11月月考化学试题(已下线)第20讲 化学平衡常数及转化率的计算(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)2.2.1 化学平衡常数-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)湖南省长沙市雅礼中学2022-2023学年高二上学期入学考试化学试题(已下线)第20讲 化学平衡常数及转化率的计算(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)题型123 平衡转化率的计算章末检测卷(二)化学反应的方向、限度与速率(已下线)上海市华东师范大学第二附属中2023-2024学年高三上学期9月考试化学试题吉林省长春市东北师范大学附属中学2023-2024学年高二上学期第一次月考化学试题江西省遂川中学2021-2022学年高二上学期第二次月考化学(A卷)试题宁夏青铜峡市高级中学2021-2022学年高二下学期开学考试化学试题湖南省衡阳县第四中学2023-2024年高二上学期期中考试化学B卷
4 . 从NO 、SO
、SO 、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
(1)两极分别放出H2和O2时,电解质的化学式可能是___________ (至少答一种,下同)。
(2)若阴极析出金属、阳极放出O2时,电解质的化学式可能是___________ 。
(3)两极分别放出气体,且体积比为1∶1,电解质的化学式可能是___________ 。
 、SO
、SO 、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。(1)两极分别放出H2和O2时,电解质的化学式可能是
(2)若阴极析出金属、阳极放出O2时,电解质的化学式可能是
(3)两极分别放出气体,且体积比为1∶1,电解质的化学式可能是
您最近一年使用:0次
2023-08-26更新
|
139次组卷
|
6卷引用:高二人教版选修4 第四章 第三节 电解池
高二人教版选修4 第四章 第三节 电解池湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题15 电解池(已下线)1.2.3 电解池的工作原理及应用(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)4.2.1 电解池原理-同步学习必备知识第1课时 电解原理第1课时 电解的原理
名校
解题方法
5 . 回答下列问题
(1)下列物质的电离方程式如下:
HClO4=H++ClO ;
;
Ba(OH)2=Ba2++2OH-;
Fe2(SO4)3=2Fe3++3SO ;
;
KHSO4=K++H++SO 。
。
属于酸的物质是________ (写化学式,下同);属于碱的物质是________ ;属于盐的物质是____________________ 。
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的物质是____________________ 。
②上述物质中既不是电解质也不是非电解质的是________ ,依据是_________ 。
③写出纯碱的电离方程式:______________________ 。
(1)下列物质的电离方程式如下:
HClO4=H++ClO
 ;
;Ba(OH)2=Ba2++2OH-;
Fe2(SO4)3=2Fe3++3SO
 ;
;KHSO4=K++H++SO
 。
。属于酸的物质是
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的物质是
②上述物质中既不是电解质也不是非电解质的是
③写出纯碱的电离方程式:
您最近一年使用:0次
2023-08-16更新
|
514次组卷
|
7卷引用:2017-2018学年高一人教版必修一:8 酸、碱、盐在水溶液中的电离课时训练化学试题
2017-2018学年高一人教版必修一:8 酸、碱、盐在水溶液中的电离课时训练化学试题(已下线)2018年9月25日《每日一题》人教必修1-电离方程式的书写(已下线)2019年9月24日 《每日一题》必修1—— 电离方程式的书写贵州省普定县一中2018-2019学年高一上学期期中考试化学试题云南省保山市昌宁县一中2019-2020学年高一10月月考化学试题第1课时 电解质的电离河北省石家庄市第二十四中学2023-2024高一上学期第一次月考化学试题
解题方法
6 . 现有A、B、C、D四种可溶性物质,它们溶于水后电离产生的所有离子如下表所示:(各物质中所含离子均不相同)
已知:①A物质是中学里用来检验 的盐;
的盐;
②向B物质的溶液中滴入无色酚酞溶液,呈红色;
③C物质分别与其它三种物质在溶液中反应均能产生白色沉淀,且B和C反应产生的白色沉淀会迅速变为灰绿色,最后变为红褐色。
回答下列问题:
(1)写出下列物质的化学式:A_______ ,D_______ 。
(2)写出③中沉淀颜色变化过程中涉及的化学反应方程式_______ 。
(3)检验溶液中 是否变质的方法是
是否变质的方法是_______ 。
(4)D物质和C物质在溶液中反应的离子方程式为_______ 。
| 阳离子 |  、 、 、 、 、 、 |
| 阴离子 |  、 、 、 、 、 、 |
 的盐;
的盐;②向B物质的溶液中滴入无色酚酞溶液,呈红色;
③C物质分别与其它三种物质在溶液中反应均能产生白色沉淀,且B和C反应产生的白色沉淀会迅速变为灰绿色,最后变为红褐色。
回答下列问题:
(1)写出下列物质的化学式:A
(2)写出③中沉淀颜色变化过程中涉及的化学反应方程式
(3)检验溶液中
 是否变质的方法是
是否变质的方法是(4)D物质和C物质在溶液中反应的离子方程式为
您最近一年使用:0次
7 . 化学与人类生产、生活密切相关,按要求回答下列问题。
(1)工业上制造光导纤维的基本原料是_______ (填化学式)。
(2)钠的化合物中,可用作潜水艇中供氧剂的是_______ ,其与 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)饮用水质量是关系人类健康的重要问题。暴雨过后,井水混浊无法饮用。为了能让井水变澄清,可向井水中投入_______(填字母)。
(4)工业上以氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是_______ (填化学式)。
(5)新型陶瓷氮化铝可用氧化铝高温还原法制备: (未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目
(未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目_______ 。若反应中共转移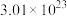 个电子,则产生
个电子,则产生 气体的体积为
气体的体积为_______ L(标准状况下)。
(1)工业上制造光导纤维的基本原料是
(2)钠的化合物中,可用作潜水艇中供氧剂的是
 发生反应的化学方程式为
发生反应的化学方程式为(3)饮用水质量是关系人类健康的重要问题。暴雨过后,井水混浊无法饮用。为了能让井水变澄清,可向井水中投入_______(填字母)。
A. | B. | C. | D. |
(5)新型陶瓷氮化铝可用氧化铝高温还原法制备:
 (未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目
(未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目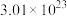 个电子,则产生
个电子,则产生 气体的体积为
气体的体积为
您最近一年使用:0次
2023-07-31更新
|
371次组卷
|
4卷引用:陕西省汉中市2020-2021学年高一上学期期末考试化学试题
陕西省汉中市2020-2021学年高一上学期期末考试化学试题(已下线)结构与性质(已下线)期末测试卷02-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)
名校
解题方法
8 . 经检测,某化工厂排出的废水呈酸性,且其中含有大量  、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:
(1)下列离子中,能大量存在于该废水中的是_______ 填标号
填标号
(2)取 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、____  用离子符号表示
用离子符号表示 。
。
(3)某化学社团小组成员欲除去废水样品中的 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
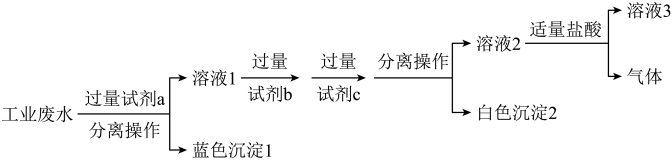
 试剂
试剂 为
为_______  写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、________ 。
 “分离操作”的名称是
“分离操作”的名称是______ ,需用到的玻璃仪器主要有______ 。
 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为______ 。
 、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:(1)下列离子中,能大量存在于该废水中的是_______
 填标号
填标号
A. | B. | C. | D. |
 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、 用离子符号表示
用离子符号表示 。
。(3)某化学社团小组成员欲除去废水样品中的
 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
 试剂
试剂 为
为 写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、 “分离操作”的名称是
“分离操作”的名称是 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为
您最近一年使用:0次
2023-07-30更新
|
543次组卷
|
8卷引用:山东省青岛市黄岛区2020-2021学年高一上学期期中考试化学试题
名校
9 . 制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol•L-1硫酸铝酸性溶液,经检验,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5(温室下,0.1 mol•L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_______ 。
(2)往溶液中加入H2O2的作用是_______ (用离子方程式表示)。
(3)加入的X试剂(填选项编号)是_______ 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是_______ 。
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为
(2)往溶液中加入H2O2的作用是
(3)加入的X试剂(填选项编号)是
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
您最近一年使用:0次
10 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+aNa2O2═2Na2FeO4+bX+2Na2SO4+cO2↑
该反应中物质X应是___________ ,b与c的关系是___________ 。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。
②每生成1molFeO 转移
转移___________ mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为___________ mol。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+aNa2O2═2Na2FeO4+bX+2Na2SO4+cO2↑
该反应中物质X应是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1molFeO
 转移
转移
您最近一年使用:0次



