名校
1 . 工厂烟气(主要污染物NO)直接排放会造成空气污染,需处理后才能排放。“纳米零价铁— ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的 。
。
(1)制备纳米零价铁将 溶液与碱性
溶液与碱性 溶液混合可生成纳米零价铁、
溶液混合可生成纳米零价铁、 和
和 等。
等。
 中
中 电子排布式为
电子排布式为___________ 。
(2)NO的氧化:在一定温度下,将 溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
①X催化 分解产生HO·,HO·将NO氧化为
分解产生HO·,HO·将NO氧化为 的机理如图所示,则Y的化学式为
的机理如图所示,则Y的化学式为___________ ,纳米零价铁的作用是___________ 。___________ 。
③ 与Y反应可实现X再生,同时产生
与Y反应可实现X再生,同时产生 ,写出
,写出 的电子式
的电子式___________ ,此时 作为
作为___________ 剂。
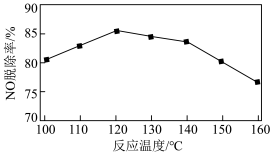
④NO脱除率随温度的变化如下图所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是___________ 。 表示),可大致分为2个过程,反应原理如下图所示。
表示),可大致分为2个过程,反应原理如下图所示。___________ 。
 ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的 。
。(1)制备纳米零价铁将
 溶液与碱性
溶液与碱性 溶液混合可生成纳米零价铁、
溶液混合可生成纳米零价铁、 和
和 等。
等。 中
中 电子排布式为
电子排布式为(2)NO的氧化:在一定温度下,将
 溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。①X催化
 分解产生HO·,HO·将NO氧化为
分解产生HO·,HO·将NO氧化为 的机理如图所示,则Y的化学式为
的机理如图所示,则Y的化学式为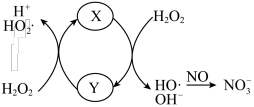
③
 与Y反应可实现X再生,同时产生
与Y反应可实现X再生,同时产生 ,写出
,写出 的电子式
的电子式 作为
作为④NO脱除率随温度的变化如下图所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是
 表示),可大致分为2个过程,反应原理如下图所示。
表示),可大致分为2个过程,反应原理如下图所示。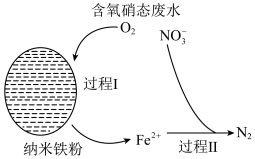
您最近一年使用:0次
解题方法
2 . 如图是元素周期表的一部分,图中所列字母分别代表一种化学元素。
(1)元素b位于周期表中________ 区,其基态原子电子排布式为________ 。
(2)基态c原子中有________ 个未成对电子,其中能量最高的电子所在原子轨道的电子云轮廓图为________ 形。
(3)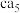 理论上为离子化合物,猜测其电子式为
理论上为离子化合物,猜测其电子式为________ 。
(4)基态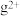 外围电子的轨道表示式为
外围电子的轨道表示式为________ ,已知高温下化合物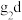 比化合物gd更稳定,试从核外电子排布的角度解释原因
比化合物gd更稳定,试从核外电子排布的角度解释原因________ 。
(5)基态f原子的原子结构示意图为________ 。

(1)元素b位于周期表中
(2)基态c原子中有
(3)
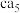 理论上为离子化合物,猜测其电子式为
理论上为离子化合物,猜测其电子式为(4)基态
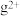 外围电子的轨道表示式为
外围电子的轨道表示式为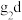 比化合物gd更稳定,试从核外电子排布的角度解释原因
比化合物gd更稳定,试从核外电子排布的角度解释原因(5)基态f原子的原子结构示意图为
您最近一年使用:0次
3 . 回答下列问题
(1)金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息如下,回答下列问题:
钼在元素周期表中的位置是________ ,基态Mo原子核外有________ 种不同运动状态的电子,其中核外电子占据最高电子层的符号是________ 。
(2)氰化钾是一种由剧毒的物质,贮存和使用时必须注意安全。已知: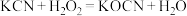 ,回答下列问题:
,回答下列问题:
 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为________ (用元素符号表示,下同),电负性从大到小的顺序为________ ,基态氮原子外围电子排布式为________ 。
(1)金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息如下,回答下列问题:
钼在元素周期表中的位置是
(2)氰化钾是一种由剧毒的物质,贮存和使用时必须注意安全。已知:
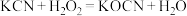 ,回答下列问题:
,回答下列问题: 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为
您最近一年使用:0次
名校
解题方法
4 . 铁及铁的化合物在污水治理中有广泛的应用。
(1)石墨烯负载纳米铁能迅速有效地还原污水中的 ,纳米铁还原废水中的
,纳米铁还原废水中的 可能反应机理如图表示:
可能反应机理如图表示: 的过程可描述为纳米
的过程可描述为纳米 失去电子生成
失去电子生成 ,
, 在纳米铁表面
在纳米铁表面________________ , 在纳米铁表面
在纳米铁表面________________ 。
(2)有氧条件下, 催化还原
催化还原 是主要的烟气脱硝技术。在以
是主要的烟气脱硝技术。在以 为主的催化剂上可能发生的反应过程如图,写出总反应的化学方程式:
为主的催化剂上可能发生的反应过程如图,写出总反应的化学方程式:________________ 。 转化为
转化为 或
或 的过程中有两步氧化还原反应,其中第一步的还原剂是
的过程中有两步氧化还原反应,其中第一步的还原剂是________ ,第二步反应的还原剂是________ 。 活化
活化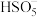 (过一硫酸根离子)产生三种主要的有效强氧化性自由基(
(过一硫酸根离子)产生三种主要的有效强氧化性自由基( 、
、 和
和 )。自由基对氨氮的去除具有一定的选择性,
)。自由基对氨氮的去除具有一定的选择性, 活化
活化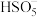 过程的主要反应机理如下:
过程的主要反应机理如下: 、
、 、
、 。
。
①酸性条件下,经氯化亚铁活化的过一硫酸盐可将废水中的 转化为
转化为 沉淀被全部回收,写出生成沉淀的离子方程式:
沉淀被全部回收,写出生成沉淀的离子方程式:________ 。
②研究表明,过一硫酸盐溶液中单独投加 可将废水中的
可将废水中的 全部去除,但
全部去除,但 的去除率却很低。额外投加一定量
的去除率却很低。额外投加一定量 后,
后, 和
和 的去除率均达到
的去除率均达到 ,单独投加
,单独投加 时,
时, 去除率很低的可能原因是
去除率很低的可能原因是________ 。
(1)石墨烯负载纳米铁能迅速有效地还原污水中的
 ,纳米铁还原废水中的
,纳米铁还原废水中的 可能反应机理如图表示:
可能反应机理如图表示: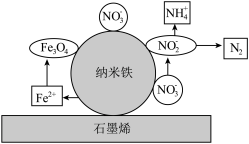
 的过程可描述为纳米
的过程可描述为纳米 失去电子生成
失去电子生成 ,
, 在纳米铁表面
在纳米铁表面 在纳米铁表面
在纳米铁表面(2)有氧条件下,
 催化还原
催化还原 是主要的烟气脱硝技术。在以
是主要的烟气脱硝技术。在以 为主的催化剂上可能发生的反应过程如图,写出总反应的化学方程式:
为主的催化剂上可能发生的反应过程如图,写出总反应的化学方程式: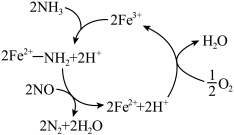
 转化为
转化为 或
或 的过程中有两步氧化还原反应,其中第一步的还原剂是
的过程中有两步氧化还原反应,其中第一步的还原剂是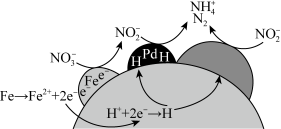
 活化
活化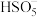 (过一硫酸根离子)产生三种主要的有效强氧化性自由基(
(过一硫酸根离子)产生三种主要的有效强氧化性自由基( 、
、 和
和 )。自由基对氨氮的去除具有一定的选择性,
)。自由基对氨氮的去除具有一定的选择性, 活化
活化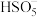 过程的主要反应机理如下:
过程的主要反应机理如下: 、
、 、
、 。
。①酸性条件下,经氯化亚铁活化的过一硫酸盐可将废水中的
 转化为
转化为 沉淀被全部回收,写出生成沉淀的离子方程式:
沉淀被全部回收,写出生成沉淀的离子方程式:②研究表明,过一硫酸盐溶液中单独投加
 可将废水中的
可将废水中的 全部去除,但
全部去除,但 的去除率却很低。额外投加一定量
的去除率却很低。额外投加一定量 后,
后, 和
和 的去除率均达到
的去除率均达到 ,单独投加
,单独投加 时,
时, 去除率很低的可能原因是
去除率很低的可能原因是
您最近一年使用:0次
名校
解题方法
5 . 二氧化硫的污染治理是化学研究的重要课题。
(1)石灰石-石膏法是一种常见的“钙基固硫”方法。其中,石灰石的溶解率与脱硫效果有着密切的关系。
可将催化条件下CaCO3吸收SO2宏观反应分为三步:
i.CaCO3由固相溶解进入液相,溶解速率为RA;
ii.SO2由气相扩散进入液相,扩散速率为RB;
iii.在催化剂作用下,溶解的SO2和Ca2+发生化学反应,且反应在液相中进行,反应速率为RC。温度变化对总反应速率的影响如图所示。___________ (填“RA”、“RB”或“Rc”)控制。
②45~55℃(催化剂活性不变)曲线呈下降趋势的原因:一是二氧化硫溶解度随温度升高而降低;二是___________ 。
(2)利用MnO2与SO2反应既可消除污染又可以制备MnSO4,将含有SO2尾气和一定比例的空气通入MnO2悬浊液中,保持温度不变的情况下,测得溶液中c(Mn2+)和c( )随反应时间的变化如图所示。导致溶液中c(Mn2+)和c(
)随反应时间的变化如图所示。导致溶液中c(Mn2+)和c( )的变化产生明显差异的原因是:
)的变化产生明显差异的原因是:_______ 。 与NO2反应的离子方程式为
与NO2反应的离子方程式为___________ 。
②请描述水催化促进硫酸盐形成的化学机制:通过“水分子桥”,处于纳米液滴中的 或
或 可以将电子快速转移给周围的气相NO2分子,
可以将电子快速转移给周围的气相NO2分子,___________ 。
(1)石灰石-石膏法是一种常见的“钙基固硫”方法。其中,石灰石的溶解率与脱硫效果有着密切的关系。
可将催化条件下CaCO3吸收SO2宏观反应分为三步:
i.CaCO3由固相溶解进入液相,溶解速率为RA;
ii.SO2由气相扩散进入液相,扩散速率为RB;
iii.在催化剂作用下,溶解的SO2和Ca2+发生化学反应,且反应在液相中进行,反应速率为RC。温度变化对总反应速率的影响如图所示。
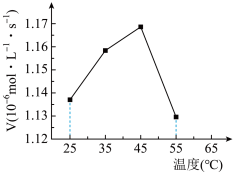
②45~55℃(催化剂活性不变)曲线呈下降趋势的原因:一是二氧化硫溶解度随温度升高而降低;二是
(2)利用MnO2与SO2反应既可消除污染又可以制备MnSO4,将含有SO2尾气和一定比例的空气通入MnO2悬浊液中,保持温度不变的情况下,测得溶液中c(Mn2+)和c(
 )随反应时间的变化如图所示。导致溶液中c(Mn2+)和c(
)随反应时间的变化如图所示。导致溶液中c(Mn2+)和c( )的变化产生明显差异的原因是:
)的变化产生明显差异的原因是: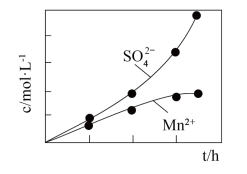
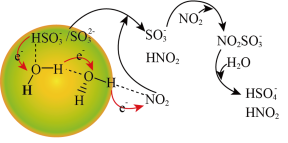
 与NO2反应的离子方程式为
与NO2反应的离子方程式为②请描述水催化促进硫酸盐形成的化学机制:通过“水分子桥”,处于纳米液滴中的
 或
或 可以将电子快速转移给周围的气相NO2分子,
可以将电子快速转移给周围的气相NO2分子,
您最近一年使用:0次
2023-12-25更新
|
339次组卷
|
5卷引用:江苏省丹阳高级中学2023届高三上学期第一次阶段考试化学试题
江苏省丹阳高级中学2023届高三上学期第一次阶段考试化学试题江苏省南师附中、天一中学、海安中学、海门中学四校2021-2022学年高三12月联考化学试题江苏省建湖高级中学2023-2024学年高三上学期暑期学情检测(一)化学试题江苏省如皋中学2023-2024学年高三上学期阶段考试(二) 化学试题(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
解题方法
6 . 化学反应原理在生产、生活及科学研究中有着广泛的应用。25℃时,部分物质的电离平衡常数如表所示,请结合所提供的数据回答下列问题(注:本题所涉及的选择题,选项不唯一)。
(1)根据上表数据,判断下列反应不能发生的是_____ (填字母)。
A.
B.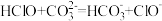
C.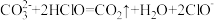
D.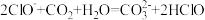
E.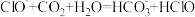
(2)25℃时,浓度均为 的①
的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液,pH由大到小的顺序为
溶液,pH由大到小的顺序为_____ (用序号表示)。
(3)25℃时,在浓度均为 的①
的① 、②
、② 、③
、③ 的溶液中,
的溶液中, 由大到小的顺序为
由大到小的顺序为_____ (用序号表示)。
(4)25℃时,将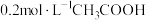 溶液与
溶液与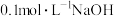 溶液等体积混合,混合溶液中①
溶液等体积混合,混合溶液中① 、②
、② 、③
、③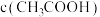 由大到小的顺序为
由大到小的顺序为_____ (用序号表示)。
(5)25℃时,用 的
的 溶液滴定
溶液滴定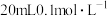 的
的 溶液,当滴加
溶液,当滴加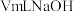 溶液时,混合溶液的
溶液时,混合溶液的 。
。 的电离常数以
的电离常数以 表示,忽略混合时引起的溶液体积的变化,下列叙述不正确的是_____(填写字母)。
表示,忽略混合时引起的溶液体积的变化,下列叙述不正确的是_____(填写字母)。
(6)在水溶液中某些离子因相互之间发生反应而不能大量共存,请按照要求解释其不能大量共存的原因。
①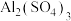 溶液和
溶液和 溶液混合,溶液变浑浊是因为
溶液混合,溶液变浑浊是因为_____ (写离子方程式)。
② 溶液和
溶液和 溶液混合,溶液变浑浊是因为
溶液混合,溶液变浑浊是因为_____ (写离子方程式)。
③ 溶液和
溶液和 溶液混合,溶液变浑浊是因为
溶液混合,溶液变浑浊是因为_____ (写化学方程式)。
④用 溶液制备
溶液制备 的过程如图所示,
的过程如图所示, 溶液和
溶液和 溶液混合,溶液变浑浊,说明结合质子的能力
溶液混合,溶液变浑浊,说明结合质子的能力
_____  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。

| 化学式 | 电离平衡常数(25℃) |
 | 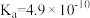 |
 |  |
 |  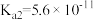 |
 | 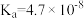 |
(1)根据上表数据,判断下列反应不能发生的是
A.

B.
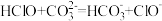
C.
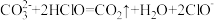
D.
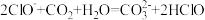
E.
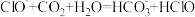
(2)25℃时,浓度均为
 的①
的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液,pH由大到小的顺序为
溶液,pH由大到小的顺序为(3)25℃时,在浓度均为
 的①
的① 、②
、② 、③
、③ 的溶液中,
的溶液中, 由大到小的顺序为
由大到小的顺序为(4)25℃时,将
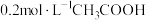 溶液与
溶液与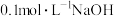 溶液等体积混合,混合溶液中①
溶液等体积混合,混合溶液中① 、②
、② 、③
、③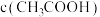 由大到小的顺序为
由大到小的顺序为(5)25℃时,用
 的
的 溶液滴定
溶液滴定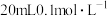 的
的 溶液,当滴加
溶液,当滴加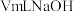 溶液时,混合溶液的
溶液时,混合溶液的 。
。 的电离常数以
的电离常数以 表示,忽略混合时引起的溶液体积的变化,下列叙述不正确的是_____(填写字母)。
表示,忽略混合时引起的溶液体积的变化,下列叙述不正确的是_____(填写字母)。A. | B.混合溶液的 时: 时: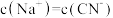 |
C.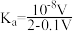 | D.滴定过程中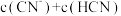 始终不变 始终不变 |
(6)在水溶液中某些离子因相互之间发生反应而不能大量共存,请按照要求解释其不能大量共存的原因。
①
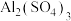 溶液和
溶液和 溶液混合,溶液变浑浊是因为
溶液混合,溶液变浑浊是因为②
 溶液和
溶液和 溶液混合,溶液变浑浊是因为
溶液混合,溶液变浑浊是因为③
 溶液和
溶液和 溶液混合,溶液变浑浊是因为
溶液混合,溶液变浑浊是因为④用
 溶液制备
溶液制备 的过程如图所示,
的过程如图所示, 溶液和
溶液和 溶液混合,溶液变浑浊,说明结合质子的能力
溶液混合,溶液变浑浊,说明结合质子的能力
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
名校
解题方法
7 . 根据提供的情境书写指定反应的方程式。
(1)通过如图转化可回收废旧锂电池电极材料 (难溶于水)中钴元素和锂元素。
(难溶于水)中钴元素和锂元素。
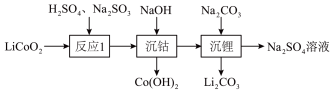
写出反应1的离子方程式:_______ 。
(2)活性自由基 可有效除去废水中的苯酚等有机污染物,原理如图所示。写出
可有效除去废水中的苯酚等有机污染物,原理如图所示。写出 除去苯酚(
除去苯酚( )反应的化学方程式:
)反应的化学方程式:_______ 。

(3)现代工业上用氧化锌烟灰(主要成分为 ,含少量
,含少量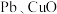 和
和 )制取高纯锌的部分工艺流程如图所示。
)制取高纯锌的部分工艺流程如图所示。
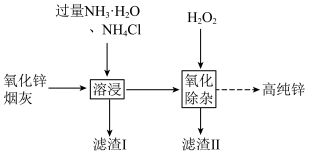
①已知:“溶浸”后浸出液中含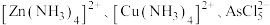 等。写出该过程中生成
等。写出该过程中生成 的相关离子方程式:
的相关离子方程式:_______ 。
②“氧化除杂”的目的是将“ ”转化为
”转化为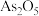 胶体,再经吸附聚沉除去。写出氧化反应的离子方程式:
胶体,再经吸附聚沉除去。写出氧化反应的离子方程式:_______ 。
(1)通过如图转化可回收废旧锂电池电极材料
 (难溶于水)中钴元素和锂元素。
(难溶于水)中钴元素和锂元素。
写出反应1的离子方程式:
(2)活性自由基
 可有效除去废水中的苯酚等有机污染物,原理如图所示。写出
可有效除去废水中的苯酚等有机污染物,原理如图所示。写出 除去苯酚(
除去苯酚( )反应的化学方程式:
)反应的化学方程式:
(3)现代工业上用氧化锌烟灰(主要成分为
 ,含少量
,含少量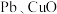 和
和 )制取高纯锌的部分工艺流程如图所示。
)制取高纯锌的部分工艺流程如图所示。
①已知:“溶浸”后浸出液中含
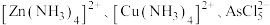 等。写出该过程中生成
等。写出该过程中生成 的相关离子方程式:
的相关离子方程式:②“氧化除杂”的目的是将“
 ”转化为
”转化为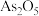 胶体,再经吸附聚沉除去。写出氧化反应的离子方程式:
胶体,再经吸附聚沉除去。写出氧化反应的离子方程式:
您最近一年使用:0次
2023-08-28更新
|
499次组卷
|
2卷引用:江苏省镇江市丹阳市吕叔湘中学2023-2024学年高三上学期10月月考化学试题
名校
8 . 工业废水中的氨氮(以 、
、 形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
(1)微生物法:酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 再与
再与 作用生
作用生 。
。 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为 而除去。
而除去。
①NaClO氧化 的离子方程式为
的离子方程式为___________ 。
②一定pH下,NaClO的投加量对污水中氨氮去除率的影响如图所示。当 时,总氮(溶液中所有含氮元素的微粒)的去除率随
时,总氮(溶液中所有含氮元素的微粒)的去除率随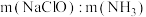 的增大不升反降的原因是
的增大不升反降的原因是______________________ 。

(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比 更强。
更强。

活性炭-臭氧氧化氨氮的机理可描述为______________________ 。
 、
、 形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。(1)微生物法:酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 再与
再与 作用生
作用生 。
。 转化为
转化为 的离子方程式为
的离子方程式为(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为
 而除去。
而除去。①NaClO氧化
 的离子方程式为
的离子方程式为②一定pH下,NaClO的投加量对污水中氨氮去除率的影响如图所示。当
 时,总氮(溶液中所有含氮元素的微粒)的去除率随
时,总氮(溶液中所有含氮元素的微粒)的去除率随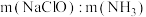 的增大不升反降的原因是
的增大不升反降的原因是
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比
 更强。
更强。
活性炭-臭氧氧化氨氮的机理可描述为
您最近一年使用:0次
名校
9 . 铁元素的纳米材料因具备良好的电学特性和磁学特性,而引起了广泛的研究。纳米零价铁可用于去除水体中的六价铬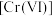 与硝酸盐等污染物。
与硝酸盐等污染物。
(1)用 溶液与
溶液与 (H元素为-1价)溶液反应制备纳米零价铁的化学方程式:
(H元素为-1价)溶液反应制备纳米零价铁的化学方程式: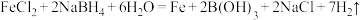 。当生成
。当生成 时,反应中转移电子的物质的量为
时,反应中转移电子的物质的量为___________ 。
(2)纳米铁碳微电技术是一种利用铁和碳的原电池反应去除水中污染物的技术达到无害排放,该技术处理酸性废水中 时,正极电极反应式为
时,正极电极反应式为___________ 。
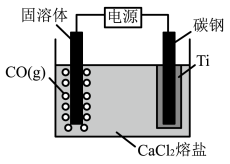
(3)我国科学家研究出USTB工艺制取金属钛,其原理如图。该方法使用的固溶体为具有导电性的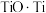 ,电解质为氯化钙熔盐,电解时阳极发生的主要电极反应为
,电解质为氯化钙熔盐,电解时阳极发生的主要电极反应为___________ 。
(4)聚合硫酸铁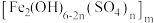 广泛用于水的净化。以
广泛用于水的净化。以 为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品
为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品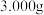 ,置于
,置于 锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的
锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的 溶液(
溶液( 将
将 还原为
还原为 ),充分反应后,除去过量的
),充分反应后,除去过量的 。用
。用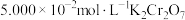 溶液滴定至终点(滴定过程中
溶液滴定至终点(滴定过程中 与
与 反应生成
反应生成 和
和 ),消耗
),消耗 溶液
溶液 。
。
①上述实验中若不除去过量的 ,样品中铁的质量分数的测定结果将
,样品中铁的质量分数的测定结果将___________ (填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)___________ 。
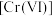 与硝酸盐等污染物。
与硝酸盐等污染物。(1)用
 溶液与
溶液与 (H元素为-1价)溶液反应制备纳米零价铁的化学方程式:
(H元素为-1价)溶液反应制备纳米零价铁的化学方程式: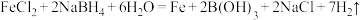 。当生成
。当生成 时,反应中转移电子的物质的量为
时,反应中转移电子的物质的量为(2)纳米铁碳微电技术是一种利用铁和碳的原电池反应去除水中污染物的技术达到无害排放,该技术处理酸性废水中
 时,正极电极反应式为
时,正极电极反应式为(3)我国科学家研究出USTB工艺制取金属钛,其原理如图。该方法使用的固溶体为具有导电性的
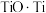 ,电解质为氯化钙熔盐,电解时阳极发生的主要电极反应为
,电解质为氯化钙熔盐,电解时阳极发生的主要电极反应为
(4)聚合硫酸铁
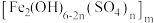 广泛用于水的净化。以
广泛用于水的净化。以 为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品
为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品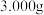 ,置于
,置于 锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的
锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的 溶液(
溶液( 将
将 还原为
还原为 ),充分反应后,除去过量的
),充分反应后,除去过量的 。用
。用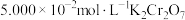 溶液滴定至终点(滴定过程中
溶液滴定至终点(滴定过程中 与
与 反应生成
反应生成 和
和 ),消耗
),消耗 溶液
溶液 。
。①上述实验中若不除去过量的
 ,样品中铁的质量分数的测定结果将
,样品中铁的质量分数的测定结果将②计算该样品中铁的质量分数(写出计算过程)
您最近一年使用:0次
名校
10 . "碳达峰”“碳中和”是我国社会发展重大战略之一
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以CO2为原料制CH3OH.在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.1kJmol-1
CO(g)+H2O(g) △H1=+41.1kJmol-1
②CO(g)+2H2(g) CH3OH(g) △H2=-90.0kJmol-1
CH3OH(g) △H2=-90.0kJmol-1
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
(1)5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
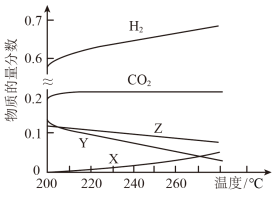
①图中Y代表___________ (填化学式)。
②体系中CO2的物质的量分数受温度影响不大,原因是___________ 。
II.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
①CH4(g)+CO2(g) 2CO(g)+2H2(g) K1
2CO(g)+2H2(g) K1
②CO2(g)+H2(g) CO(g)+H2O(g) K2
CO(g)+H2O(g) K2
请回答:
(2)反应CH4(g)+3CO2(g) 4CO(g)+2H2O(g)的K=
4CO(g)+2H2O(g)的K=___________ (用K1,K2表示)。
(3)恒压,750°C时,CH4和CO2按物质的量之比1:3投料,经如下流程可实现CO2高效转化。
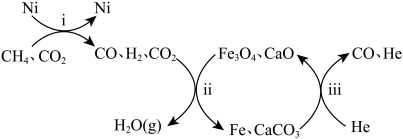
①写出过程ii产生H2O(g)的化学方程式___________ 。
②过程ii的催化剂是___________ ,若CH4和CO2按物质的量之比1:1投料,则会导致过程ii___________ 。
③过程ii平衡后通入稀有气体He,测得一段时间内CO物质的量上升,根据过程iii,结合平衡移动原理,解释CO物质的量上升的原因___________ 。
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以CO2为原料制CH3OH.在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41.1kJmol-1
CO(g)+H2O(g) △H1=+41.1kJmol-1②CO(g)+2H2(g)
 CH3OH(g) △H2=-90.0kJmol-1
CH3OH(g) △H2=-90.0kJmol-1③CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
CH3OH(g)+H2O(g) △H3=-48.9kJmol-1(1)5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。

①图中Y代表
②体系中CO2的物质的量分数受温度影响不大,原因是
II.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
①CH4(g)+CO2(g)
 2CO(g)+2H2(g) K1
2CO(g)+2H2(g) K1②CO2(g)+H2(g)
 CO(g)+H2O(g) K2
CO(g)+H2O(g) K2请回答:
(2)反应CH4(g)+3CO2(g)
 4CO(g)+2H2O(g)的K=
4CO(g)+2H2O(g)的K=(3)恒压,750°C时,CH4和CO2按物质的量之比1:3投料,经如下流程可实现CO2高效转化。

①写出过程ii产生H2O(g)的化学方程式
②过程ii的催化剂是
③过程ii平衡后通入稀有气体He,测得一段时间内CO物质的量上升,根据过程iii,结合平衡移动原理,解释CO物质的量上升的原因
您最近一年使用:0次



