名校
解题方法
1 . “微生物法”处理含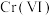 废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含
废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含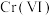 废水。
废水。
(1)硫酸盐还原菌能将水中的 转化为
转化为 ,
, 与
与 可反应生成
可反应生成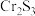 和
和 两种沉淀。写出
两种沉淀。写出 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(2)用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在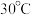 左右,温度过高,
左右,温度过高,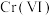 的去除率低的原因是
的去除率低的原因是___________ 。
(3)硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的 会完全转化为
会完全转化为 ,则
,则 腐蚀后生成
腐蚀后生成 和
和 的物质的量之比为
的物质的量之比为___________ 。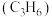 为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。___________ ,乙为___________ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为___________ 。
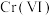 废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含
废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含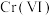 废水。
废水。(1)硫酸盐还原菌能将水中的
 转化为
转化为 ,
, 与
与 可反应生成
可反应生成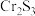 和
和 两种沉淀。写出
两种沉淀。写出 与
与 反应的离子方程式:
反应的离子方程式:(2)用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在
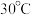 左右,温度过高,
左右,温度过高,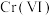 的去除率低的原因是
的去除率低的原因是(3)硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的
 会完全转化为
会完全转化为 ,则
,则 腐蚀后生成
腐蚀后生成 和
和 的物质的量之比为
的物质的量之比为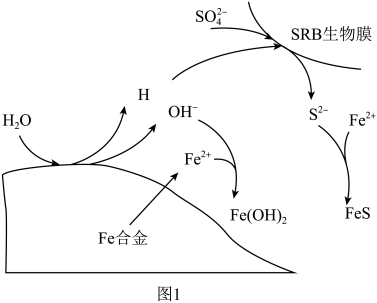
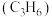 为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。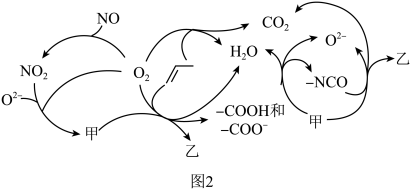
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为
您最近一年使用:0次
20-21高一上·江苏镇江·阶段练习
名校
解题方法
2 . 按要求完成下列填空
(1)现有标准状况下CO和CO2混合气体8.96L,其质量为16g,则此混合气体中,CO的体积分数是_______ ,质量之比是_______ 。
(2)40.5g某金属氯化物MCl2中含有0.6 mol Cl-,则金属M的相对原子质量为_______
(3)已知16gA和20gB恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为_______
(4)将10.6g Na2CO3溶于水配成1L溶液,向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4 mol/L(假设溶液体积不变),需加入NaCl的质量为_______ ;Cl-的物质的量浓度为_______ 。
(5)将4g NaOH溶于_______ g水中,可使溶液中H2O与Na+的物质的量之比等于20:1,若测得该溶液的密度为1.1g/cm-3,溶液中c(Na+)为_______ 。
(1)现有标准状况下CO和CO2混合气体8.96L,其质量为16g,则此混合气体中,CO的体积分数是
(2)40.5g某金属氯化物MCl2中含有0.6 mol Cl-,则金属M的相对原子质量为
(3)已知16gA和20gB恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为
(4)将10.6g Na2CO3溶于水配成1L溶液,向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4 mol/L(假设溶液体积不变),需加入NaCl的质量为
(5)将4g NaOH溶于
您最近一年使用:0次
名校
解题方法
3 . 元素铬(Cr)在溶液中主要以 Cr3+(蓝紫色)、Cr(OH) (绿色)、Cr2O
(绿色)、Cr2O (橙红色)、CrO
(橙红色)、CrO (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与 Al3+的化学性质相似,在 Cr2(SO4)3溶液中逐滴加入 NaOH 溶液直至过量,可观察到的现象是_____________________ 。
(2)三价铬 Cr(Ⅲ)与双氧水反应可用于合成铬黄(PbCrO4)。控制其他条件不变,调节反应温度, 考察反应温度对 Cr( Ⅲ) 转化率的影响( 如图所示)。温度超过 70 ℃时,Cr( Ⅲ) 转化率下降的原因是_______________ 。

(3)光照下,草酸(H2C2O4)能将 Cr2O 转化为 Cr3+。化学式为 Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用。为确定一瓶久置发盐的化学成分,进行实验如下:
转化为 Cr3+。化学式为 Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用。为确定一瓶久置发盐的化学成分,进行实验如下:
①取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份。
②其中一份与酸性 KMnO4溶液充分反应(反应后 MnO 被还原成 Mn2+),消耗浓度为 0.4000 mol·L-1的 KMnO4溶液 20.00 mL。
被还原成 Mn2+),消耗浓度为 0.4000 mol·L-1的 KMnO4溶液 20.00 mL。
③往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得 9.100g 干燥固体粉末。
计算并合理猜想,推测该久置发盐的可能化学组成______________ (写出计算过程)。
 (绿色)、Cr2O
(绿色)、Cr2O (橙红色)、CrO
(橙红色)、CrO (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(1)Cr3+与 Al3+的化学性质相似,在 Cr2(SO4)3溶液中逐滴加入 NaOH 溶液直至过量,可观察到的现象是
(2)三价铬 Cr(Ⅲ)与双氧水反应可用于合成铬黄(PbCrO4)。控制其他条件不变,调节反应温度, 考察反应温度对 Cr( Ⅲ) 转化率的影响( 如图所示)。温度超过 70 ℃时,Cr( Ⅲ) 转化率下降的原因是

(3)光照下,草酸(H2C2O4)能将 Cr2O
 转化为 Cr3+。化学式为 Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用。为确定一瓶久置发盐的化学成分,进行实验如下:
转化为 Cr3+。化学式为 Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用。为确定一瓶久置发盐的化学成分,进行实验如下:①取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份。
②其中一份与酸性 KMnO4溶液充分反应(反应后 MnO
 被还原成 Mn2+),消耗浓度为 0.4000 mol·L-1的 KMnO4溶液 20.00 mL。
被还原成 Mn2+),消耗浓度为 0.4000 mol·L-1的 KMnO4溶液 20.00 mL。③往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得 9.100g 干燥固体粉末。
计算并合理猜想,推测该久置发盐的可能化学组成
您最近一年使用:0次
名校
4 . 某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样0.352g,置于铂舟并放入燃烧管中,不断通入氧气流.用酒精喷灯持续加热样品,将生成物先后通过浓硫酸和碱石灰,两者分别增重0.144g和0.528g,生成物完全被吸收.试回答以下问题:
(1)维生素C中碳的质量分数是______ ,氢的质量分数______
(2)维生素中是否含有氧元素?为什么?(试通过计算说明)______________
(1)维生素C中碳的质量分数是
(2)维生素中是否含有氧元素?为什么?(试通过计算说明)
您最近一年使用:0次
2020-11-12更新
|
414次组卷
|
4卷引用:江苏省镇江市吕叔湘中学2019-2020学年高二下学期期中考试(再选班)化学试题
江苏省镇江市吕叔湘中学2019-2020学年高二下学期期中考试(再选班)化学试题(已下线)1.4 研究有机化合物的一般步骤和方法(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)(已下线)专题四 研究有机化合物的一般步骤和方法-2020-2021学年高二《新题速递·化学》(人教版选修5)2月刊 (同步课堂必刷题)(已下线)专题二 研究有机化合物的一般方法-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修3)2月刊 (同步课堂必刷题)
5 . 碘是人体必需的微量元素之一,我国以前在食盐中加KI加工碘盐。
(1) 目前加碘食盐中,不用KI的主要原因是__________________________ 。
(2) 将Fe3I8加入到K2CO3溶液中,生成Fe3O4、KI和一种气体,该反应的化学方程式为__________ 。
(3) 准确称取某KI样品3.500 0 g配制成100.00 mL溶液;取25.00 mL所配溶液置于锥形瓶中,加入15.00 mL 0.100 0 mol·L-1 K2Cr2O7酸性溶液(Cr2O72-转化为Cr3+),充分反应后,煮沸除去生成的I2;冷却后加入过量KI,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定至终点(I2和S2O32-反应生成I-和S4O62-),消耗Na2S2O3标准溶液24.00 mL。计算该样品中KI的质量分数____________ (写出计算过程)。
(1) 目前加碘食盐中,不用KI的主要原因是
(2) 将Fe3I8加入到K2CO3溶液中,生成Fe3O4、KI和一种气体,该反应的化学方程式为
(3) 准确称取某KI样品3.500 0 g配制成100.00 mL溶液;取25.00 mL所配溶液置于锥形瓶中,加入15.00 mL 0.100 0 mol·L-1 K2Cr2O7酸性溶液(Cr2O72-转化为Cr3+),充分反应后,煮沸除去生成的I2;冷却后加入过量KI,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定至终点(I2和S2O32-反应生成I-和S4O62-),消耗Na2S2O3标准溶液24.00 mL。计算该样品中KI的质量分数
您最近一年使用:0次
2020-06-09更新
|
386次组卷
|
3卷引用:江苏省镇江市吕叔湘中学2019-2020学年高二下学期期末考试化学试题
名校
解题方法
6 . 双氧水是重要的化学试剂。
(1)一定条件下,O2得电子转化为超氧自由基(·O ),并实现如下图所示的转化:
),并实现如下图所示的转化:
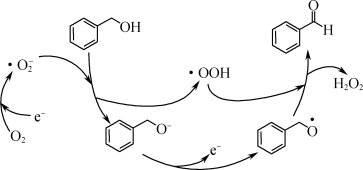
①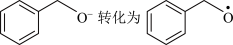 是
是________ (填“氧化”或“还原”)反应。
②写出图示转化总反应的化学方程式:________ 。
(2) K2Cr2O7酸性条件下与H2O2反应生成CrO5,反应为非氧化还原反应。据此分析,CrO5中-2价O与-1价O的数目比为________ 。
(3) H2O2可用于测定酒精饮料中乙醇的含量。现有20.00 mL某鸡尾酒,将其中CH3CH2OH蒸出并通入17.0 mL 0.200 0 mol·L-1 K2Cr2O7溶液(H2SO4酸化)中,发生反应:K2Cr2O7+C2H5OH+H2SO4―→Cr2(SO4)3+CH3COOH+K2SO4+H2O(未配平)
再用0.400 0 mol·L-1的双氧水滴定反应后所得的混合液,用去19.00 mL双氧水,滴定过程中发生如下反应:
反应1:4H2O2+K2Cr2O7+H2SO4===K2SO4+2CrO5+5H2O
反应2:H2O2+CH3COOH===CH3COOOH+H2O
则该鸡尾酒中CH3CH2OH的物质的量浓度为________ mol·L-1(写出计算过程)。
(1)一定条件下,O2得电子转化为超氧自由基(·O
 ),并实现如下图所示的转化:
),并实现如下图所示的转化:
①
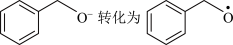 是
是②写出图示转化总反应的化学方程式:
(2) K2Cr2O7酸性条件下与H2O2反应生成CrO5,反应为非氧化还原反应。据此分析,CrO5中-2价O与-1价O的数目比为
(3) H2O2可用于测定酒精饮料中乙醇的含量。现有20.00 mL某鸡尾酒,将其中CH3CH2OH蒸出并通入17.0 mL 0.200 0 mol·L-1 K2Cr2O7溶液(H2SO4酸化)中,发生反应:K2Cr2O7+C2H5OH+H2SO4―→Cr2(SO4)3+CH3COOH+K2SO4+H2O(未配平)
再用0.400 0 mol·L-1的双氧水滴定反应后所得的混合液,用去19.00 mL双氧水,滴定过程中发生如下反应:
反应1:4H2O2+K2Cr2O7+H2SO4===K2SO4+2CrO5+5H2O
反应2:H2O2+CH3COOH===CH3COOOH+H2O
则该鸡尾酒中CH3CH2OH的物质的量浓度为
您最近一年使用:0次
2020-05-21更新
|
363次组卷
|
3卷引用:江苏省镇江市吕叔湘中学2021届高三上学期10月教学调研化学试题
名校
解题方法
7 . 含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,其蒸气相对于氢气的密度为58,它能与小苏打反应放出CO2,也能使溴水褪色,0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应。试回答:
(1)该有机物中各原子个数比N(C)∶N(H)∶N(O)=______________
(2)该有机物的摩尔质量为__________ ,写出分子式_____________
(3)该有机物的可能结构简式有___________________
(1)该有机物中各原子个数比N(C)∶N(H)∶N(O)=
(2)该有机物的摩尔质量为
(3)该有机物的可能结构简式有
您最近一年使用:0次
2019-12-04更新
|
142次组卷
|
2卷引用:江苏省镇江市吕叔湘中学2019-2020学年高二上学期10月月考化学试题
名校
8 . 两种饱和一元醇A和B(通式为CnH2n+2O),分子中相差一个碳原子。现有A和B的混合物19.5 g,与足量的钠反应后,生成了5.6L(标准状况)H2。求:
(1)A.B的名称______________________ ;
(2)混合物中A、B的质量分数____ 。
(1)A.B的名称
(2)混合物中A、B的质量分数
您最近一年使用:0次
名校
9 . 人们从蛋白质水解产物中分离出一种含有1个氮原子的氨基酸进行分析时,从0.19g该氨基酸得16mL的氮气(在标准状况下),试计算该氨基酸的含氮量和式量,假如19.95g该氨基酸可以和100mL1.5mol/L的Ba(OH)2溶液恰好完全反应,试推出该氨基酸的结构简式。
您最近一年使用:0次
名校
10 . 荷尔蒙胰岛素是一种蛋白质,含硫3.4%。
(1)胰岛素可能的最小相对分子质量为_______________ 。
(2)它的确定相对分子质量为5734,则每一分子中可能含有_______________ 个硫原子。
(1)胰岛素可能的最小相对分子质量为
(2)它的确定相对分子质量为5734,则每一分子中可能含有
您最近一年使用:0次



