解题方法
1 . 填空题。
(1)有下列七种物质:①石灰水②KOH③稀硫酸④液氯⑤蔗糖⑥CuSO4•5H2O⑦SO2。其中属于氧化物的是_______ (填序号,下同);属于混合物的是_______ ;属于电解质的是_______ ;属于非电解质的是_______ 。
(2)3.4克NH3中所含氢原子数目与标准状况下约______ LH2S所含氢原子数目相等。
(3)15.6gNa2X中含有Na+0.4mol,则X的摩尔质量为_______ 。
(4)标准状态下,672mL某气体质量为1.92g,该气体的摩尔质量为_______ 。
(5)同温同压下,同质量的甲烷(CH4)和氨气物质的量之比为_______ ;氢原子总数之比为_______ ;体积之比为_______ ;密度之比为_______ 。
(1)有下列七种物质:①石灰水②KOH③稀硫酸④液氯⑤蔗糖⑥CuSO4•5H2O⑦SO2。其中属于氧化物的是
(2)3.4克NH3中所含氢原子数目与标准状况下约
(3)15.6gNa2X中含有Na+0.4mol,则X的摩尔质量为
(4)标准状态下,672mL某气体质量为1.92g,该气体的摩尔质量为
(5)同温同压下,同质量的甲烷(CH4)和氨气物质的量之比为
您最近一年使用:0次
名校
解题方法
2 . 化学计量在化学中占有重要地位。请回答下列问题:
(1)青蒿素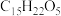 的摩尔质量为
的摩尔质量为___________ 。
(2)___________ 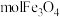 中含有
中含有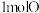 ,含有
,含有___________ 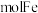 。
。
(3)在标准状况下, 由
由 和
和 组成的混合气体中,含有的分子总数约为
组成的混合气体中,含有的分子总数约为___________ 。
(4)在标准状况下,含有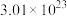 个氦原子的氦气的体积约为
个氦原子的氦气的体积约为___________ 。
(5)某消毒小组人员用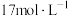 的浓硫酸配制
的浓硫酸配制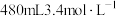 的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为___________  ;所配溶液中的
;所配溶液中的 的物质的量浓度为
的物质的量浓度为___________ 。
(6)如图所示,气缸的总体积一定,内部被活塞隔成I、II两部分,活塞可以自由移动,也可以固定。 时向I中充入
时向I中充入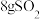 ,II中充入
,II中充入
 ,则当活塞不再移动时,I、II两部分体积比为
,则当活塞不再移动时,I、II两部分体积比为___________ 。

(1)青蒿素
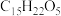 的摩尔质量为
的摩尔质量为(2)
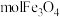 中含有
中含有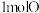 ,含有
,含有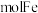 。
。(3)在标准状况下,
 由
由 和
和 组成的混合气体中,含有的分子总数约为
组成的混合气体中,含有的分子总数约为(4)在标准状况下,含有
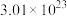 个氦原子的氦气的体积约为
个氦原子的氦气的体积约为(5)某消毒小组人员用
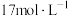 的浓硫酸配制
的浓硫酸配制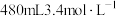 的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为 ;所配溶液中的
;所配溶液中的 的物质的量浓度为
的物质的量浓度为(6)如图所示,气缸的总体积一定,内部被活塞隔成I、II两部分,活塞可以自由移动,也可以固定。
 时向I中充入
时向I中充入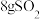 ,II中充入
,II中充入
 ,则当活塞不再移动时,I、II两部分体积比为
,则当活塞不再移动时,I、II两部分体积比为
您最近一年使用:0次
2023-12-23更新
|
55次组卷
|
2卷引用:贵州省顶效开发区顶兴学校2023-2024学年高三第三次月考化学试题
3 . 物质的量是联系宏观物质和微观粒子的重要桥梁,根据以物质的量为中心的转化关系,完成下列计算:
(1)CO和CO2是碳的两种重要氧化物。在标准状况下,56L CO的物质的量是_______________ ,质量是______________ ; 0.5mol CO2中含有O的数目约为______________ 个。(填空)
(2)配制500mL 0.2 mol/L NaCl溶液,需要NaCl的质量是_____ (写出计算过程)
(1)CO和CO2是碳的两种重要氧化物。在标准状况下,56L CO的物质的量是
(2)配制500mL 0.2 mol/L NaCl溶液,需要NaCl的质量是
您最近一年使用:0次
4 . 用20.00 mL NaClO溶液恰好能氧化一定质量的Ba(HC2O4)2·6H2O固体,氧化产物为CO2。同样质量的Ba(HC2O4)2·6H2O固体又恰好能被25.00 mL 0.150 mol·L-1的Ba(OH)2溶液中和(假设反应后体积不变)。(计算结果保留到小数点后三位)
(1)中和后的溶液中Ba2+的浓度为_________ 。
(2)列式计算求NaClO溶液的浓度:_________ 。
(1)中和后的溶液中Ba2+的浓度为
(2)列式计算求NaClO溶液的浓度:
您最近一年使用:0次
2022-12-13更新
|
111次组卷
|
2卷引用:贵州省思南县梵净山中学2021-2022学年高三下学期3月月考化学试题
名校
解题方法
5 . 回答下列问题:
(1)已知在酸性条件下溴酸盐可发生如下离子反应:
I.2 +10Cl-+12H+=5Cl2↑+Br2+6H2O
+10Cl-+12H+=5Cl2↑+Br2+6H2O
II.6 +5Cl-+6H+=5
+5Cl-+6H+=5 +3Br2+3H2O
+3Br2+3H2O
III. +5Br-+6H+=3Br2+3H2O
+5Br-+6H+=3Br2+3H2O
现将120mL 0.4mol·L-1 KBrO3溶液和100mL 0.6mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为_______ 。
(2)黑火药(硫黄、木炭和硝酸钾的混合物,杂质忽略不计)是我国的四大发明之一、现有黑火药样品124 g,燃烧后生成33.6 L(标准状况下)气体和由K2CO3、K2SO4组成的固体混合物。33.6 L气体中CO和CO2占 ,其余气体为N2,则该黑火药中硫黄的质量为_______g。
,其余气体为N2,则该黑火药中硫黄的质量为_______g。
(1)已知在酸性条件下溴酸盐可发生如下离子反应:
I.2
 +10Cl-+12H+=5Cl2↑+Br2+6H2O
+10Cl-+12H+=5Cl2↑+Br2+6H2OII.6
 +5Cl-+6H+=5
+5Cl-+6H+=5 +3Br2+3H2O
+3Br2+3H2OIII.
 +5Br-+6H+=3Br2+3H2O
+5Br-+6H+=3Br2+3H2O现将120mL 0.4mol·L-1 KBrO3溶液和100mL 0.6mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为
(2)黑火药(硫黄、木炭和硝酸钾的混合物,杂质忽略不计)是我国的四大发明之一、现有黑火药样品124 g,燃烧后生成33.6 L(标准状况下)气体和由K2CO3、K2SO4组成的固体混合物。33.6 L气体中CO和CO2占
 ,其余气体为N2,则该黑火药中硫黄的质量为_______g。
,其余气体为N2,则该黑火药中硫黄的质量为_______g。| A.22g | B.16g | C.11g | D.8g |
您最近一年使用:0次
6 . 为测定某有机化合物A的结构,进行如下实验:
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质的实验式是_______ 。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图所示的质谱图,则其相对分子质量为_______ ,该物质的分子式是_______ 。
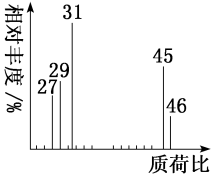
(3)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如甲基氯甲基醚(Cl-CH2-O-CH3,有2种氢原子)的核磁共 振氢谱如左图所示,经测定,有机物A的核磁共振氢谱图如右图所示,则A的结构简式为_______ 。
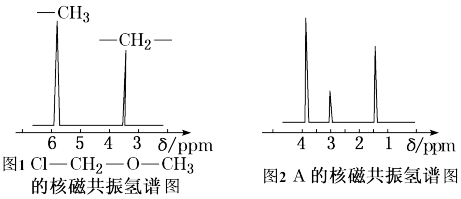
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质的实验式是
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图所示的质谱图,则其相对分子质量为

(3)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如甲基氯甲基醚(Cl-CH2-O-CH3,有2种氢原子)的核磁共 振氢谱如左图所示,经测定,有机物A的核磁共振氢谱图如右图所示,则A的结构简式为

您最近一年使用:0次
7 . 一定温度下,在10L密闭容器中加入5molSO2和3molO2,发生反应:2SO2(g)+O2(g) 2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
(1)反应生成了____ molSO3,v(SO2)=____ 。
(2)平衡时SO3的浓度是____ ,SO2的转化率是____ 。
(3)平衡时容器内气体的总物质的量为___ mol。
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是___ (填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3):n(O2):n(SO2)=2:1:2
(5)该温度下,SO3(g) SO2(g)+
SO2(g)+ O2(g)的平衡常数K=
O2(g)的平衡常数K=___ 。
 2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。(1)反应生成了
(2)平衡时SO3的浓度是
(3)平衡时容器内气体的总物质的量为
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3):n(O2):n(SO2)=2:1:2
(5)该温度下,SO3(g)
 SO2(g)+
SO2(g)+ O2(g)的平衡常数K=
O2(g)的平衡常数K=
您最近一年使用:0次
2022-04-11更新
|
532次组卷
|
2卷引用:贵州省黔西南州金成实验学校2022-2023学年高二上学期9月月考化学试题
解题方法
8 . 为了更好地利用化学反应中物质和能量的变化,在化学研究和工业生产中还需要关注化学反应的快慢和限度。能量、速率与限度是认识和研究化学反应的重要因素。
Ⅰ.某温度下,在2 L的恒容密闭容器中,A、B、C(均为气体)三种物质的物质的量随时间的变化曲线如图所示。

(1)该反应的化学方程式为___________ 。
(2)能说明此时反应已达到了平衡状态的是___________ (填标号)。
a.A、B、C三种物质的浓度保持不变
b.气体A的消耗速率等于气体C的生成速率
c.混合气体的密度不变
d.总压强不变
Ⅱ.某温度下,向2.0 L的恒容密闭容器中充入2.0 molN2和2.0 molH2,发生反应,一段时间后反应达到平衡状态,实验数据如下表所示:
(3)0~50 s内的平均反应速率v(N2)=___________  。
。
(4)键能指在标准状况下,将1 mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为 ,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中
,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中___________ (填“吸收”或“放出”)的能量为___________  。
。
(5)为加快反应速率,可采取的措施是___________ (填标号)。
a.升高温度 b.增大容器体积 c.恒容时充入He d.加入合适催化剂
Ⅰ.某温度下,在2 L的恒容密闭容器中,A、B、C(均为气体)三种物质的物质的量随时间的变化曲线如图所示。

(1)该反应的化学方程式为
(2)能说明此时反应已达到了平衡状态的是
a.A、B、C三种物质的浓度保持不变
b.气体A的消耗速率等于气体C的生成速率
c.混合气体的密度不变
d.总压强不变
Ⅱ.某温度下,向2.0 L的恒容密闭容器中充入2.0 molN2和2.0 molH2,发生反应,一段时间后反应达到平衡状态,实验数据如下表所示:
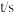 | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
 。
。(4)键能指在标准状况下,将1 mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为
 ,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中
,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中 。
。(5)为加快反应速率,可采取的措施是
a.升高温度 b.增大容器体积 c.恒容时充入He d.加入合适催化剂
您最近一年使用:0次
9 . 某气体分子由三原子构成,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA,则:
(1)该气体的物质的量为___________ mol;
(2)该气体在标准状况下的体积为___________ L;
(3)该气体在标准状况下的密度为___________ g/L;
(4)该气体所含原子总数为___________ 个;
(5)该气体的一个分子的质量为___________ g。
(1)该气体的物质的量为
(2)该气体在标准状况下的体积为
(3)该气体在标准状况下的密度为
(4)该气体所含原子总数为
(5)该气体的一个分子的质量为
您最近一年使用:0次
解题方法
10 . (1)氟磷灰石在高温下制备黄磷的热化学方程式为4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
已知相同条件下:①4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
②2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
③SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
则ΔH=__ (用ΔH1、ΔH2、ΔH3表示)。
(2)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-846.3 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=__ 。
已知相同条件下:①4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
②2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
③SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
则ΔH=
(2)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-846.3 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=
您最近一年使用:0次



